胃腺癌組織p-STAT3、survivin、Mcl-1蛋白表達變化及意義
黃雷,殷濤,崔殿生
(湖北省腫瘤醫院,武漢430079)
胃癌是臨床常見的消化道惡性腫瘤之一,在全世界的惡性腫瘤病死率中高居第2位[1]。目前,胃癌的發病機制仍未研究清楚。信號傳導與轉錄激活因子(STAT)蛋白家族是一組可被不同細胞因子受體激活的蛋白,能特異性地在細胞內傳遞信號。STAT3是STAT蛋白家族成員之一,可在多種信號傳遞過程中被激活,從而發揮相應的生物學作用;STAT3也被認為是一種癌基因,廣泛表達于不同類型的細胞和組織中,其激活狀態即磷酸化STAT3(p-STAT3),可導致細胞異常增殖和惡性轉化。生存素(survivin)是一種凋亡抑制因子,廣泛表達于各種腫瘤細胞或組織中,是凋亡抑制蛋白(IAP)家族成員之一,可參與抑制細胞凋亡。髓樣細胞白血病1(Mcl-1)是一種特殊的蛋白質,屬于抗凋亡蛋白,最初在人髓樣白血病細胞系的分化中發現[2],在調控細胞凋亡過程中發揮重要作用。本研究觀察了胃腺癌組織p-STAT3、survivin和Mcl-1蛋白表達變化,并分析其與胃腺癌患者臨床病理特征的關系,旨在探討p-STAT3、survivin和Mcl-1在胃腺癌發生、發展中的作用。
1 資料與方法
1.1 臨床資料 收集2014~2016年湖北省腫瘤醫院診斷明確的胃腺癌患者,術中收集胃腺癌組織57例份(觀察組)及相應癌旁正常胃黏膜組織53例份(對照組)。其中,男35例,女22例;年齡41~81歲,<60歲25例、≥60歲32例;腫瘤直徑:<5 cm 39例,≥5 cm 18例;浸潤深度:未侵及漿膜12例,侵及漿膜45例;組織分化程度:高中分化12例,低未分化45例;臨床分期:Ⅰ、Ⅱ期18例,Ⅲ、Ⅳ期39例;無淋巴結轉移11例,有淋巴結轉移46例。患者術前均未接受任何抗腫瘤治療。本研究經湖北省腫瘤醫院醫學倫理委員會批準,患者或其家屬知情同意。
1.2 p-STAT3、survivin和Mcl-1蛋白表達檢測 采用免疫組化SP法。兔抗人p-STAT3、兔抗人survivin抗體購自武漢博士德生物工程有限公司,Mcl-1多克隆抗體購自美國Santa Cruz公司;山羊抗鼠IgG二抗、免疫組化SP試劑盒、DAB顯色試劑盒及其他試劑均購自北京中杉金橋生物技術有限公司。所有標本常規脫蠟水化,3%過氧化氫消除內源性過氧化物酶,PBS沖洗,微波加熱抗原修復,室溫自然冷卻。按照試劑盒說明常規行免疫組化SP染色,DAB顯色,蘇木素復染。以PBS代替一抗作為陰性對照,用已知陽性組織切片作為陽性對照。陽性染色定位于細胞質或細胞核,呈棕黃色或棕褐色顆粒。根據陽性細胞所占比例及染色程度綜合判定陽性表達。陽性細胞所占比例評分:≤5%為0分,>5%~25%為1分,>25%~50%為2分,>50%~75%為3分,>75%為4分;染色程度評分:無著色為0分,淺黃色為1分,黃色為2分,棕黃色為3分。兩項評分乘積≤3為陰性表達、>3為陽性表達。
1.3 統計學方法 采用SPSS17.0統計軟件。計數資料比較采用χ2檢驗或Fisher精確概率檢驗。相關性分析采用Spearman相關分析。P<0.05為差異有統計學意義。
2 結果
2.1 兩組p-STAT3、survivin、Mcl-1蛋白表達比較 觀察組p-STAT3、survivin、Mcl-1蛋白陽性表達率分別為78.95%(45/57)、70.18%(40/57)、75.44%(43/57),對照組分別為18.87%(10/53)、22.64%(12/53)、30.19%(16/53)。兩組比較差異均有統計學意義(P均<0.01)。
2.2 胃腺癌組織p-STAT3、survivin、Mcl-1蛋白陽性表達與患者臨床病理特征的關系 p-STAT3、survivin、Mcl-1蛋白陽性表達在腫瘤侵及漿膜者高于未侵及漿膜者,組織分化程度低未分化者高于中高分化者,臨床分期Ⅲ、Ⅳ期者高于Ⅰ、Ⅱ期者,腫瘤直徑≥5 cm者高于<5 cm,有淋巴結轉移者高于無淋巴結轉移者(P均<0.05),三者陽性表達在不同性別、年齡腫瘤組織間比較差異均無統計學意義(P均>0.05)。見表1。
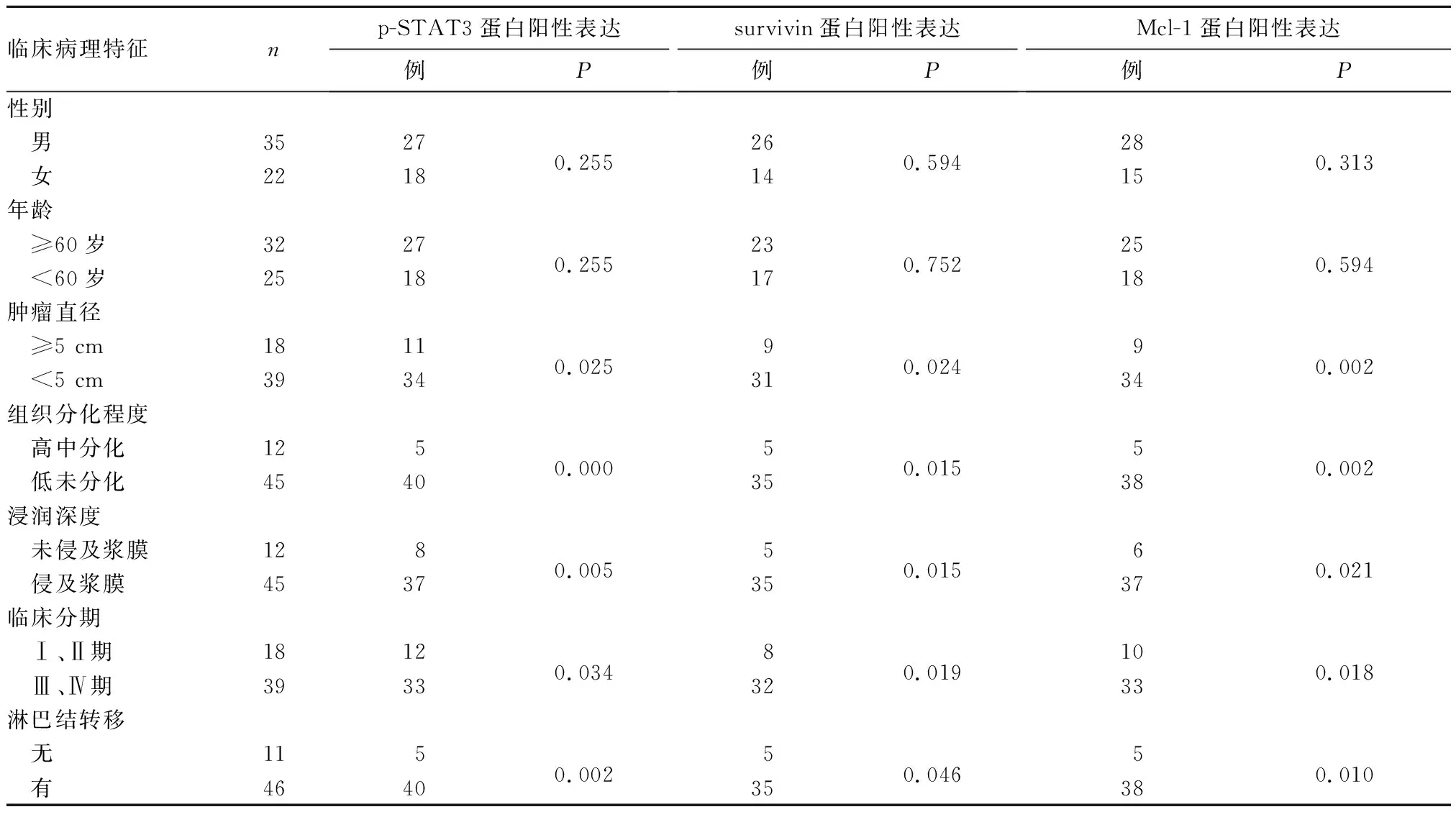
表1 胃腺癌組織p-STAT3、survivin、Mcl-1蛋白陽性表達與患者臨床病理特征的關系
2.3 胃腺癌組織p-STAT3、survivin、Mcl-1蛋白陽性表達的關系 Spearman相關分析顯示,胃腺癌組織p-STAT3蛋白陽性表達與survivin、Mcl-1蛋白陽性表達呈正相關關系(r分別為0.334、0.417,P均<0.05),survivin蛋白陽性表達與Mcl-1蛋白陽性表達呈正相關關系(r=0.342,P<0.05)。
3 討論
隨著細胞分子生物學研究的進步,對胃癌的研究已經進入分子水平,并取得了較大研究成果。近年越來越多研究顯示,STAT3在胃癌的發生、發展中具有關鍵性作用,尤其是p-STAT3,能明顯促進胃癌的增殖、侵襲和轉移。STAT3是細胞內信號傳遞的關鍵因子,在受到外界信號刺激后,以活化的p-STAT3進入細胞核中,啟動并調控其下游基因的轉錄,從而促進腫瘤細胞的增殖和侵襲,并抑制腫瘤細胞凋亡,最終導致腫瘤無限生長。Yu等[3]研究顯示,STAT3信號通路相關蛋白表達在胃癌早期即可明顯升高,可作為胃癌早期診斷的指標之一。但更多的研究顯示,STAT3信號通路相關蛋白不僅僅在胃癌早期表達升高,在進展期和晚期亦可過表達。Chen等[4]研究提示,過表達STAT3信號通路相關蛋白能顯著增加胃癌細胞的增殖、浸潤及轉移,抑制其表達則能明顯降低胃癌細胞的增殖、浸潤及轉移。Ollila等[5]研究發現,STAT3與胃腸道腫瘤的發生密切相關,Tao等[6]也得出相同的研究結論。說明STAT3信號通路在胃癌的發生、發展中發揮重要作用。
胃癌是以高病死率為特征的惡性腫瘤,主要是因為胃癌具有高轉移風險,患者預后非常差。有研究顯示,激活STAT3信號通路,能明顯促進胃癌細胞的增殖和侵襲,而抑制STAT3信號通路則能明顯抑制胃癌細胞的增殖和侵襲[7]。但STAT3信號通路調控腫瘤細胞增殖和侵襲機制尚不清楚。Luo等[8]研究發現,STAT3在多種腫瘤的發生、發展過程中具有關鍵性作用;STAT3還能促進G1期細胞向S期細胞轉變,特別是在胃癌細胞中表現尤為突出。但STAT3信號通路影響細胞周期的機制尚不清楚。Ma等[9]研究顯示,與癌旁正常組織相比,胃癌組織STAT3高表達;進一步研究發現,激活STAT3信號通路能明顯增加腫瘤轉移風險,而且在腫瘤轉移患者中表達更明顯,說明STAT3在胃癌轉移中發揮重要作用。本研究結果顯示,p-STAT3蛋白陽性表達在腫瘤浸潤侵及漿膜者高于未侵及漿膜者,組織分化程度低未分化者高于中高分化者,臨床分期Ⅲ、Ⅳ期者高于Ⅰ、Ⅱ期者,腫瘤直徑≥5 cm者高于<5 cm者,有淋巴結轉移者高于無淋巴結轉移者。說明p-STAT3蛋白在胃癌的發生、發展中具有重要作用,與上述研究結論一致。
研究發現,STAT3可通過調節其下游靶基因表達,如Mcl-1、survivin、Bcl-2及VEGF等,促進腫瘤細胞增殖并抑制其凋亡,進而導致腫瘤侵襲、轉移[10]。survivin基因于1997年被耶魯大學Ambro-sini教授首先發現[11],是IAP家族中相對分子質量最小的蛋白。survivin的主要作用是抑制腫瘤細胞凋亡,促進腫瘤細胞增殖,同時還能影響化療藥物敏感性。survivin在分化良好的組織中幾乎不表達[12],但可高表達于胃癌、結直腸癌及胰腺癌組織。研究發現,survivin蛋白產物可高選擇性地結合并降解活化的Caspase-3、Caspase-7,直接抑制Caspase-3、Caspase-7活性及其與周期蛋白激酶相互作用,阻斷凋亡信號轉導通路,抑制細胞凋亡,促進腫瘤細胞增殖[13]。survivin基因還參與細胞的有絲分裂,在G1期轉錄明顯增加,導致細胞分裂缺陷,易形成多倍體細胞;而且,過表達的survivin基因能夠逃避有絲分裂的檢查,破壞宿主細胞的吞噬功能,導致細胞異常增殖,進而導致腫瘤的發生[13]。Kamran等[14]研究認為,survivin基因在胃癌細胞的有絲分裂期間發揮重要作用。本研究顯示,survivin蛋白在胃腺癌組織中的陽性表達率高于正常胃黏膜組織,提示survivin蛋白在胃癌的發生、發展中具有重要作用;同時,survivin蛋白陽性表達在胃癌組織分化程度、浸潤深度、腫瘤大小及淋巴結轉移方面均有差異,說明survivin蛋白可參與胃癌的發生、侵襲及轉移。Dizdar等[15]指出,survivin基因在胃癌的早期階段發揮重要作用,且與胃癌的淋巴結轉移明確相關。Guo等[16]同樣指出,survivin基因在胃癌的發生、發展中具有重要作用,可作為胃癌早期診斷的腫瘤標志物。本研究顯示,胃腺癌組織p-STAT3蛋白陽性表達與survivin蛋白陽性表達呈正相關關系。提示p-STAT3可能調控其下游基因survivin的表達,共同作用導致胃癌的發生、發展。但survivin基因在胃癌發生、發展中的具體機制仍需進一步研究。
Mcl-1的結構與Bcl-2具有高度同源性,是Bcl-2家族抗凋亡分子成員之一。Mcl-1的半衰期非常短,主要是通過穩定線粒體膜,阻止細胞色素C從線粒體釋放入細胞質,延緩細胞凋亡進程。Mcl-1在多種腫瘤組織中高表達[17,18],尤其在胃癌及結直腸癌組織。Mcl-1主要通過影響細胞分裂周期及降低腫瘤細胞對化療藥物的敏感性,參與調節細胞的抗凋亡途徑。Akagi等[19]研究顯示,Mcl-1可能降低胃癌細胞對5-FU及鉑類化合物的敏感性,其作用機制與阻斷細胞內線粒體自身凋亡途徑,抑制胃癌細胞凋亡過程有關。Shuang等[20]指出,上調Mcl-1表達可降低紫杉醇對胃癌細胞的化療敏感性,其機制可能與激活PI3K/Akt信號通路有關;上調Mcl-1表達可抑制細胞外線粒體酶的通透性,阻礙紫杉醇誘導的細胞凋亡途徑。近年來,抗凋亡蛋白抑制劑不斷被發現,很多小分子蛋白質通過結合到Bcl-2家族抗凋亡蛋白上發揮抑制凋亡的作用。這些小分子抑制劑對細胞膜有高度通透性,更易通過細胞膜進入細胞質,有利于細胞毒性藥物的吸收,在抑制細胞凋亡的同時發揮抗腫瘤作用。最近研究顯示,抑制FoxM1/Mcl-1信號通路能明顯破壞細胞活性,增加鉑類化合物對胃癌細胞的化療敏感性[21]。Yu等[22]研究顯示,過表達Mcl-1能明顯抑制JAK/STAT信號通路激活,導致胃癌細胞無限增殖和凋亡受阻。本研究結果顯示,Mcl-1蛋白表達在腫瘤浸潤侵及漿膜者高于未侵及漿膜者,組織分化程度低未分化者高于中高分化者,臨床分期Ⅲ、Ⅳ期者高于Ⅰ、Ⅱ期者,腫瘤直徑≥5 cm者高于<5 cm者,有淋巴結轉移者高于無淋巴結轉移者。結果充分說明,Mcl-1蛋白與胃癌的發生、發展密切相關。Likui等[23]研究結果顯示,Mcl-1蛋白在胃癌組織中的表達高于正常胃黏膜組織,且與胃癌的T分期、淋巴結轉移、血管和脈管浸潤以及5年生存率密切相關。本研究結果與該研究結論高度一致,提示Mcl-1高表達在胃癌的發生、發展中具有重要作用。
本研究還顯示,胃腺癌組織p-STAT3蛋白陽性表達與survivin、Mcl-1蛋白陽性表達呈正相關關系,提示p-STAT3可上調survivin、Mcl-1蛋白表達,而過表達survivin和Mcl-1蛋白可促進胃癌的發生、發展,并可導致患者不良預后。
綜上所述,STAT3信號通路可參與胃癌的發生、發展,其活化狀態能促進胃癌細胞的增殖和侵襲,并調節其下游基因survivin、Mcl-1蛋白轉錄,增強胃癌細胞的侵襲和遷移能力。檢測胃腺癌組織STAT3及其下游基因survivin和Mcl-1蛋白表達可能有助于判斷胃癌的進展及患者預后。

