以混培法離體誘導油茶多倍體細胞的初步研究
盧夢琪,蔡耀通,吳旭平,何超銀,曾艷玲
(中南林業科技大學 a.經濟林培育與保護教育部重點實驗室;b.經濟林育種與栽培國家林業局重點實驗室;c.經濟林培育與利用湖南省協同創新中心,湖南 長沙 410004)
油茶Camellia oleifera屬山茶科山茶屬常綠小喬木,在我國已有2 300多年的栽培歷史,是我國南方重要的木本油料樹種,與油橄欖、椰子、油棕合稱為世界四大木本植物油料樹種。茶油富含不飽和脂肪酸,具有預防和治療高血壓、心血管系統疾病等功效,是國際糧農組織重點推薦的保健植物食用油,也是我國政府提倡的純天然木本食用油,有“東方橄欖油”之稱[1-3]。據報道,全國油茶林面積約400多萬hm2,茶油產量約51.8萬t。但是,油茶種植生產中還存在優質品種少、產量不穩定且低產等問題[4]。我國食用油對外依存度較高,研發和培育高產、高抗、高質油茶新品種,不僅可以有效緩解國內植物油缺乏的局面,而且可以帶動其相關產業的發展,充分發揮油茶的生產潛力。
自然界中多倍體植株普遍存在。自從1937年Blakeslee等發現并證實秋水仙素可誘導植物多倍體之后,世界便掀起了一股多倍體研究熱潮。秋水仙素能抑制紡錘體的形成,使細胞在分裂前期或者后期染色體不能移向兩極而使染色體加倍[5]。現已在獼猴桃[6]、蘋果[7]、三色堇[8]、矮牽牛[9]、番茄[10]、西瓜[11]、滇楊[12-13]和杜仲[14]多種林木、花卉、農作物多倍體育種中獲得了成功。多倍體植株染色體成倍增加,基因也成倍增加,新陳代謝活躍,蛋白質、碳水化合物、維生素、植物堿等物質的合成速率加快,含量增多,其莖、葉、花、果實等變大[15]。目前,關于油茶多倍體育種的研究報道很少,國外的尚未見到,國內也只有極少數。譬如,李鐵柱等[16]用秋水仙素處理油茶種子,獲得了多株普通油茶變異體,有的表現出葉、花、果實增大,有的則表現出早花早果。但是,種子本身異質性強,所以本研究選取性狀差異小的同株系嫩葉為材料,采用組織培養與秋水仙素誘導相結合的方法(簡稱為“混培法”)誘導多倍體細胞,以期為后期篩選培育油茶多倍體優良種質,提高油茶產量提供科學依據。
1 材料與方法
1.1 供試材料
供試材料為油茶國家審定品種‘華碩’[17]當年春季新抽嫩葉,采集地為中南林業科技大學生命科學樓頂樓油茶資源圃。
1.2 材料的處理
春季4月選取當年生完全展開的嫩葉,用超純水沖洗2~3次,放入滅菌的燒杯中。在超凈工作臺上,用75%的酒精浸洗30~40 s,無菌水沖洗3~5次;用0.1%升汞溶液浸洗8 min,無菌水沖洗5~6次。用無菌濾紙吸干葉面水分后,將葉片切成0.5 cm×0.5 cm大小的葉盤,接種在附加了不同濃度秋水仙素的愈傷組織誘導培養基上。
1.3 愈傷組織的誘導和再分化
愈傷組織誘導培養基參照畢方鋮等[18]的油茶子葉愈傷組織最佳誘導配方,即為MS+2.0 mg·L-12,4-D+1.0 mg·L-1KT。秋水仙素的濃度梯度和處理時間參照陳杰等[19]誘導滇楊多倍體的秋水仙素濃度和時間設計,共組成30個處理,詳見表1。將消毒好的葉盤接種在附加了不同濃度秋水仙素的愈傷組織誘導培養基上,暗培養7 d后轉入光照條件下培養,培養溫度為(29±2)℃,光強約為6 000 lx,光照時間為16 h。每個處理接種 10瓶,每瓶3枚葉盤,每隔3 d觀察1次,記錄葉盤的死亡情況、愈傷組織形成情況及愈傷組織的生長狀態、顏色等性狀。2個月后,統計愈傷率、死亡率等指標。采用SPSS Statistics v19.0軟件進行數據統計與分析。
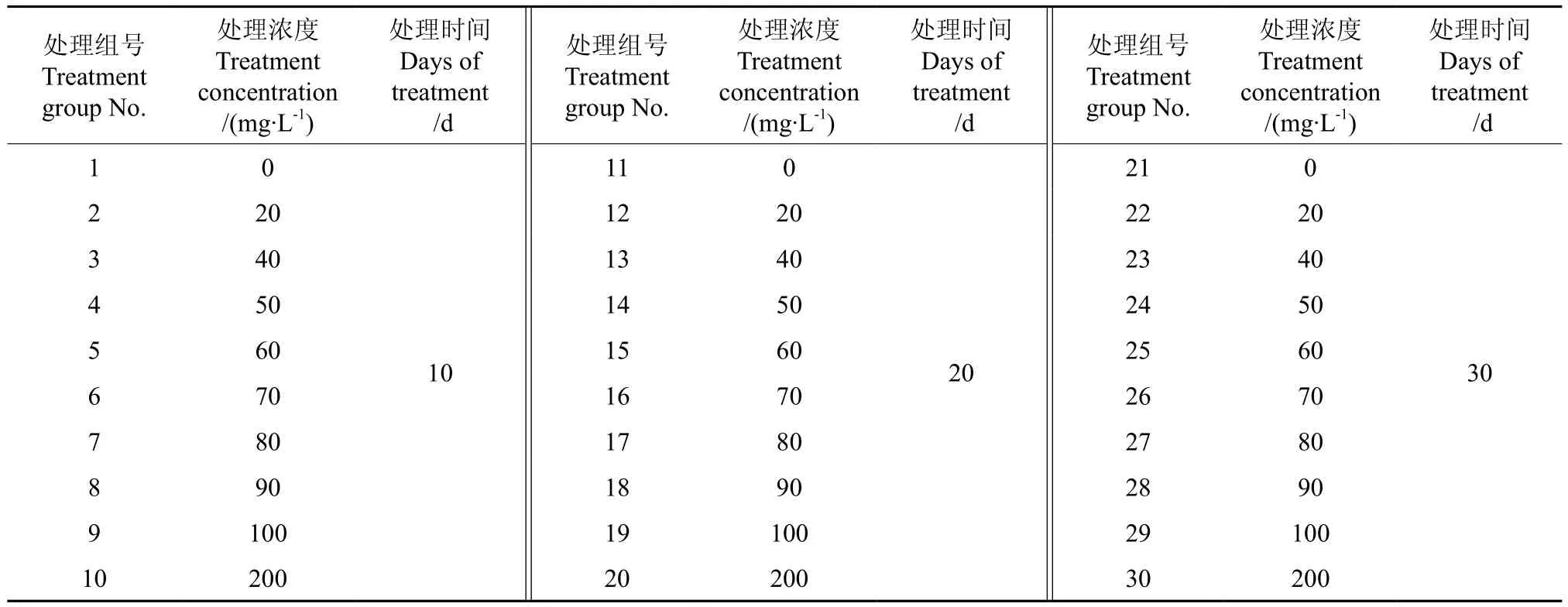
表1 秋水仙素濃度梯度設計Table1 Design of colchicine concentration gradient
愈傷率=(誘導愈傷組織數/接種葉片總數)×100%;
死亡率=(褐化材料數/接種葉片總數)×100%。
1.4 愈傷組織倍性的測定
以二倍體博白大果油茶[20]作為參照,用Sysmex流式細胞儀檢測愈傷組織相對DNA含量,電壓設為422 V。在超凈工作臺上取少量長勢良好、沒有褐化的愈傷組織放入培養皿中,加入400 mL的細胞解離液,用刀片將愈傷組織切碎,用400目的尼龍網篩過濾至離心管中制成單細胞懸浮液。在黑暗條件下,加入800 mL的DNA染色液,立即檢測。每次檢驗至少收集4 000個顆粒。
1.5 細胞核大小的觀察
參照趙云等[21]石蠟切片制作方法,調整固定到復水等步驟的處理時間。使用蘇木精-伊紅對染法染色,用2%的愛式蘇木精避光浸泡14 h,洗去浮色后用1%的水溶性伊紅染色20 s左右。用中性樹膠封片,用Olympus BX-51光學顯微鏡觀察細胞及細胞核的大小,進行顯微照相。
將細胞和細胞核均看作球形進行核質比的計算,其計算公式為:
NP=VN/(Vc-VN)。
式中,NP為核質比,VN為核的體積,Vc為細胞的體積。
2 結果與分析
2.1 秋水仙素對葉盤的存活及愈傷組織誘導的影響
接 種 第 2天, 3、6、8、13、16、18、23、26、29號處理組的葉盤均出現了輕微的褐化(圖1A);接種14 d后,各處理組的葉盤均出現褐化,褐化比較嚴重的處理組號分別為8、9、10、18、19、20、28、29、30。培養14d 后,2、12、15、17號處理組的葉盤開始變厚,邊緣泛黃,長出少量愈傷組織(圖1B);培養20 d后,11、12、13、15、17、27號等處理組開始長愈傷組織。培養30 d后,每個處理組均誘導出愈傷組織;“混培法”對油茶多倍體細胞誘導的影響情況如表2所示。整體而言,愈傷組織的生長狀況均一般,生長速度快的卻褐化嚴重,生長速度慢的而其愈傷組織量低。以秋水仙素處理30 d的愈傷組織其生長狀況比處理10與20 d的明顯差一些。從顏色上來說,當秋水仙素的濃度為20~80 mg·L-1時,處理20 d后誘導出來的愈傷組織長勢最好,顏色呈現綠色或者黃綠色,長速較快(圖1C)。從愈傷組織生長的量來說,以秋水仙素處理20 d的處理組要多于處理時間分別為10、30 d的處理組。

圖1 愈傷組織誘導情況Fig.1 Callus induction status
一般認為,秋水仙素對外植體有毒害作用,會使外植體存活率隨著秋水仙素濃度的增高而降低。從表2中可以看出, 1、2、3、11、12、21、22號處理組的死亡率均相對較低,且組間無顯著差異; 1、2、3、4、11、12、21號處理組的愈傷率均相對較高,且組間無顯著差異。這一結果說明,在較低濃度的秋水仙素處理下,處理時間的長短對葉盤的死亡率、愈傷率的影響均不大;而較高濃度秋水仙素處理組的數據顯示,雖然處理時間長短不同,死亡率無顯著差異,但是愈傷率存在差異。當秋水仙素濃度達到200 mg·L-1時,無論處理時間長或短,葉盤的死亡率均較高,而愈傷率均較低,當處理天數為30 d時,愈傷率約為0。低濃度處理組和高濃度處理組之間,無論死亡率還是愈傷率均存在顯著差異,且均呈現出隨著處理濃度增高,死亡率逐漸增加,愈傷率逐漸減少的規律。
對表2數據進行相關性分析,結果如表3所示。由表3可知,死亡率與處理時間長度、秋水仙素濃度間均呈極顯著正相關,其相關系數分別為0.445和0.598;愈傷率與處理時間長度、秋水仙素濃度間均呈極顯著負相關,其相關系數分別為-0.379和-0.666;其中,處理濃度與愈傷率的相關性最高。
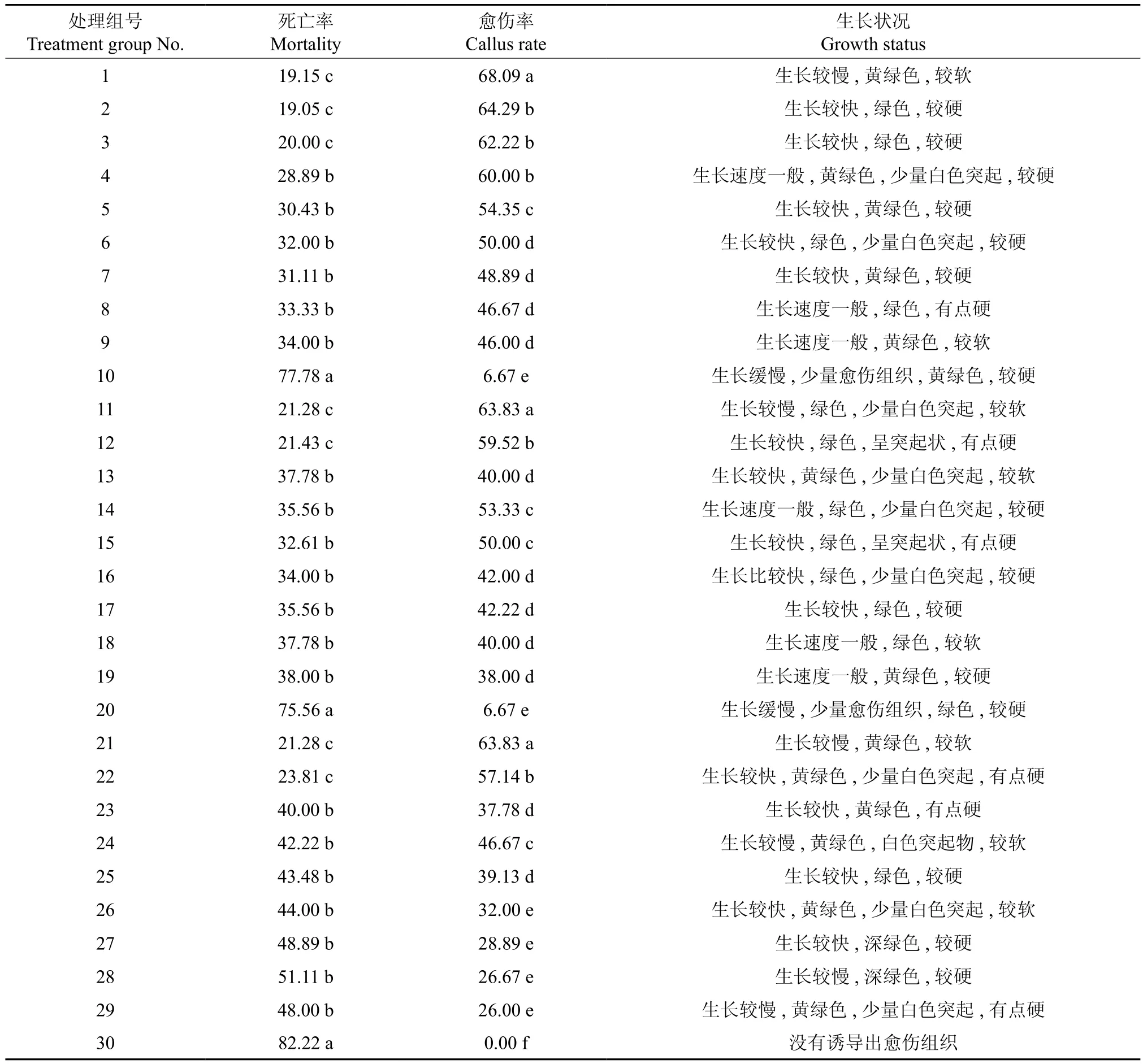
表2 “混培法”對油茶多倍體細胞誘導的影響?Table2 Influence of mixed tissue culture on inducing polyploid cells in C. oleifera %

表3 不同處理下葉盤培養結果的相關性分析結果?Table3 Correlation analysis of different treatments on leaf disc culture
2.2 秋水仙素處理對愈傷組織相對DNA含量及其細胞核大小的影響
參比二倍體油茶‘博白大果’的相對DNA含量,根據未添加秋水仙素的1、11、21號對照組的愈傷組織相對DNA含量,計算出的‘華碩’愈傷組織相對DNA含量均值是348.92。以此為參照,求出各處理組愈傷組織相對DNA含量與對照組相對DNA含量之間的比值,即為倍數,計算結果如表4所示。從表4中可以看出,各處理組的倍數都大于1.0,愈傷組織相對DNA含量均有所增加,說明各處理組都有多倍體細胞產生。倍數在2.0左右的處理組包括4、8、9、13、14、15、16、25號。

表4 愈傷組織細胞相對DNA含量及核質比?Table4 Relative DNA contents and nuclear-cytoplasmic ratios in callus cells
根據愈傷組織切片分析不同處理組的細胞核質比(見表4),在此基礎上統計了不同倍數的核質比均值,結果如表5所示。倍數為1.0的愈傷組織細胞核質比為(0.098±0.036),其相對DNA含量為348.05(如圖2 A1和B1所示);倍數為2.0的愈傷組織細胞核質比為(0.130±0.023),其相對DNA含量為677.33(如圖2 A2和B2所示),比倍數為1.0的要大,細胞相對DNA含量增多,其相應的核質比也會增大。Pearson相關性分析結果顯示,倍數與核質比之間的相關系數為0.441,表示兩者在P<0.05水平上呈顯著正相關,即核質比隨著相對DNA含量的增多而增大。
培養相同天數后,只有13與22號處理組的愈傷組織有分生細胞團(分別如圖3A和B所示)出現。根據袁德義[22]油茶葉片組織培養試驗結果可知:不是所有形態的愈傷組織都能分化成芽,而是一定形態、一定結構的愈傷組織在適宜的培養條件下才能分化成芽。處理組13與22號的愈傷組織生長速度相對來說較快些,均呈黃綠色,有少量白色突起。

表5 不同倍數的核質比均值Table5 Mean values of nuclear-cytoplasmic ratios of different multiples


圖2 愈傷組織的石蠟切片及相對DNA含量Fig.2 Paraff i n sections and relative DNA contents of calluses

圖3 處理組13與22號的愈傷組織分生區和分生細胞團Fig.3 Callus meristematic zones and meristematic cells of the treatment group No.13 and No.22
3 結論與討論
油茶是我國重要的木本食用油料樹種,通過倍性育種可快速創新種質資源,培育高產優質品種。秋水仙素誘導是目前最常用的方法,可采用以其溶液浸泡種子、點滴處理生長點或者結合組織培養等方法[23]。本研究采用添加秋水仙素的植物組織培養混培法進行培養,研究結果表明,低濃度秋水仙素處理對油茶葉片離體培養的副作用相對較小,致死率低,同時能獲得相當數量的多倍體細胞;但是,高濃度的秋水仙素處理會嚴重影響外植體的活性,導致葉盤或愈傷組織褐化死亡,隨著秋水仙素濃度的升高和處理時間的延長,葉盤的死亡率逐漸升高,愈傷率逐漸降低。這與張靜靜[24]和劉麗[25]的研究結果一致。
本研究結果表明,以不同濃度秋水仙素處理油茶葉盤,均能誘導多倍體細胞的產生,其中以40 mg·L-1的秋水仙素處理 20 d 和以 20 mg·L-1的秋水仙素處理30 d培養獲得的油茶愈傷組織細胞相對DNA含量的倍數均在2.0以上,而且在顯微鏡下均能觀察到細胞分生團,但后期是否能分化出多倍體植株還有待進一步觀察。此外,本研究結果產生了多種倍數的相對DNA含量的愈傷組織,說明愈傷組織的倍性是不穩定的。其原因可能是,在愈傷組織的誘導和增殖過程中,不同倍性的細胞相互融合;在愈傷組織的生長過程中,染色體發生變異等。其原因也有可能是,切取的材料正好是分裂旺盛的部位,導致倍數偏高等。
目前,關于油茶多倍體育種僅見于李鐵柱[16,26]和包梅榮[27]的相關報道,他們采用的材料分別是種子和實生苗,以浸泡法和點滴處理生長點的方法誘導多倍體植株,雖然獲得了幾株變異株,但是種子和實生苗個體之間本身存在較大差異,這就影響了研究結果的科學性。本研究采用同株系當年生嫩葉為材料,保證了材料基因型的一致,但是,油茶葉片離體快繁技術瓶頸尚未攻克,迄今尚未見有培育出完整植株并且存活的報道[22,28]。本研究中有2個處理組的愈傷組織可觀察到分生細胞團,但是,培養了90 d左右仍未見有芽分化出。后續研究將在此基礎上繼續探索油茶葉片愈傷組織多倍體分生團出芽成苗的培養體系,從而為后期快速得到多倍體油茶奠定基礎。
[1] 莊瑞琳.中國油茶[M].第2版.北京:中國林業出版社,2008.
[2] 董占能,邢思敏.從茶籽中提取茶油、茶皂素的研究[J].昆明理工大學學報,1998,23(2):83-88.
[3] 馬 力,陳永忠.茶油的功能特性分析[J].中國農學通報,2009, 25(8):82-84.
[4] 王 瑞,陳永忠.我國油茶產業的發展現狀及提升思路[J].林業科技開發,2015,29(4):6-10.
[5] 周慧文,馮 斗,嚴華兵.秋水仙素離體誘導多倍體研究進展[J].核農學報,2015,29(7):1307-1315.
[6] 李升星,劉 崢,賀 笑,等.獼猴桃多倍體育種研究進展[J].現代農業科技,2015(17):112-114.
[7] 馬 躍,宣景宏,張志宏.蘋果多倍體育種研究進展[J].北方果樹,2015(6):1-3.
[8] 鄭思鄉,胡 秀,雷小云,等.離體培養條件下三色堇多倍體誘導研究[J].云南農業大學學報,2003,18(4):397-400.
[9] 陳 一,李春楠.矮牽牛多倍體誘導試驗與快速鑒定[J].浙江農業科學,2016,57(3):361-363.
[10] 陳圣棟,楊建平,曹德航,等.秋水仙堿誘導番茄多倍體的研究[J].山東農業科學,2007(3):22-24.
[11] 王友平,朱金英,徐光東,等.西瓜多倍體研究應用進展[J].長江蔬菜,2010(20):8-12.
[12] 辛培堯,陳 杰,唐軍榮,等.滇楊多倍體的誘導研究[J].中南林業科技大學學報,2014,34(3):24-28,57.
[13] 邱 芬,辛亞龍,唐軍榮,等.不同倍性滇楊葉片解剖結構差異分析[J].中南林業科技大學學報,2017,37(6):56-59,69.
[14] 張海鳳,郭寶林,張成合,等.杜仲四倍體的誘導與鑒定[J].園藝學報,2008,35(7):1047-1052.
[15] 程金水.園林植物遺傳育種學[M].北京:中國林業出版社,2006.
[16] 李鐵柱,田大倫,烏云塔娜,等.四倍體油茶的鑒定及變異[J].林業科學,2009,45(3):150-154.
[17] 譚曉風,袁德義,袁 軍,等.大果油茶良種‘華碩’[J].林業科學,2011,47(12):184,209.
[18] 畢方鋮,譚曉風,張智俊,等.油茶離體培養誘導再生植株的研究[J].經濟林研究,2004,22(2):5-9.
[19] 陳 杰,周 軍,孫正海,等.組織培養結合秋水仙素誘導滇楊多倍體的研究[J].云南農業大學學報,2013,28(2):251-256.
[20] 莊瑞林,董汝湘.我國油茶主要物種花粉大小、變異性及染色體數的初步觀察[J].林業科技通訊,1984(3):15-17.
[21] 趙 云,李 濤,陳增潔.含羞草石蠟切片的制作[J].寧夏農林科技,2011,52(4):45-46.
[22] 袁德義,范曉明,譚曉風,等.油茶帶芽莖段及葉片離體培養再生體系的建立[J].南京林業大學學報(自然科學版),2013,37(5): 35-39.
[23] 彭盡暉,張良波,彭曉英.秋水仙素在植物倍性育種中的應用[J].湖南林業科技,2004,31(5):22-25.
[24] 張靜靜.鐵皮石斛多倍體的誘導及其鑒定[D].杭州:浙江農林大學,2013.
[25] 劉 麗,林苗苗,方金豹,等.秋水仙素對‘瓊露’獼猴桃多倍體誘導的影響[J].經濟林研究,2017,35(3):147-151.
[26] 李鐵柱,包梅榮,烏云塔娜.油茶秋水仙素誘導苗光合作用變異研究[J].內蒙古農業大學學報,2008,29(4):155-160.
[27] 包梅榮,李鐵柱,烏云塔娜,等.秋水仙素處理油茶種子和幼苗變異的初步研究[J].內蒙古農業大學學報,2009,30(2):46-51.
[28] 蔡冬元.油茶葉片初始誘導培養技術研究[J].湖南農業科學,2014(20):5-7.

