海南白花油茶花藥再生體系的初步建立
周廣振 ,欒林莉 ,宋玉鳳 ,吳友根 ,胡新文 ,何朝族 ,陳健妙
(海南大學a.熱帶農林學院;b.海南省熱帶生物資源可持續利用重點實驗室海南,海南 海口 570228)
油茶Camellia oleifera Abel.又名茶子樹、油茶樹,為常綠小喬木或灌木,分布于我國海南、福建、湖南、江西、廣西等省區,與油橄欖、油棕、椰子并稱為世界四大木本油料植物,是我國得天獨厚的植物資源,茶油具有“東方橄欖油”之美稱[1]。油茶也是海南省傳統的油料經濟作物,充分利用海南油茶資源和生態優勢,發展具有地方特色的茶籽油及其副產品,將進一步促進海南省農業產業結構調整和農民增收,還可以改善油茶適種市縣的生態環境,為海南省打造國際旅游島而錦上添花[2-3]。近年來,我國食用油供需矛盾突出,而油茶作為我國特有的木本油料作物其產業經濟效益差、產量低等問題明顯[4-5]。將其他省區的油茶良種引種到海南地區種植,普遍存在生長適應性差、生長慢、難開花或坐果率低等問題。因此,生產、種植適合海南本地土壤和氣候條件的良種壯苗是促進海南油茶產業健康可持續發展的關鍵。
各油茶適種省區的生產實踐經驗證明,油茶雜交難度大,成功率低,品種改良難度極大[6]。芽苗砧嫁接是已經被生產實踐證明了的成熟度非常高的無性繁殖技術,而目前適合海南土壤、氣候條件的本地芽苗砧嫁接油茶良種壯苗,因為接穗有限,導致芽苗砧嫁接苗極其匱乏[5]。組織培養作為植物無性繁殖的方式之一,被廣泛應用于各種經濟作物的良種繁育之中。油茶通過以不同器官、組織和細胞培養,經器官發生途徑產生的叢芽可作為嫁接接穗用苗,而通過體細胞胚發生途徑形成的再生植株,具有主根,可直接用作栽培用苗[7-8]。以本地優良品系為外植體母株,通過兩種途徑繁育組培苗,是解決海南省油茶良種苗匱乏的有效途徑。目前,國內外陸續有不同產區油茶組織培養的研究報道,但因地區土壤氣候不同,所用油茶基本培養基也相差甚遠;已有成功形成再生植株的油茶再生體系多數以成熟和未成熟子葉作為外植體[9]的研究報道,而以油茶花藥作為外植體,僅限于愈傷組織的誘導,鮮見有再生植株成功培育的報道,而海南白花油茶組培方面的報道更為鮮見。為了拓展海南白花油茶的再生體系和完善國內外油茶花藥誘導再生體系,本實驗以海南白花油茶未開放花蕾為外植體,建立了油茶花藥體細胞胚植株再生體系,探討了影響油茶花藥再生體系的關鍵因子,旨在加快海南省油茶品種改良進程、生產優質組培苗供應當下緊缺的油茶良種壯苗以及建立高效穩定的油茶再生體系,為今后有關油茶功能基因等方面的研究奠定基礎。
1 材料與方法
1.1 供試材料
花藥外植體材料于2015年1月采自海南大學與瓊海市市校合作項目“瓊海油茶高產優質配套栽培關鍵技術研究與示范”的油茶高產栽培技術實驗基地(海南省瓊海市陽江鎮盧家村)所選育的油茶高產單株。
1.2 實驗方法
1.2.1 花粉發育時期與花蕾外部形態的對應觀測
于晴天上午8:00—9:00時,選摘未開放的海南白花油茶花蕾,及時放進冰盒帶回實驗室。根據橫徑大小將花蕾分為4組(i、ii、iii和iv),觀察并記錄4組花蕾的外觀形態特征,用游標卡尺測量花蕾的縱徑(cm)和橫徑(cm),計算縱橫徑的比值(縱橫徑之比=縱徑長度/橫徑長度),然后撕開花瓣,觀察花蕾中花藥的生長發育狀態,記錄花藥、花絲的形態和顏色等生物學特征。每處理3次重復,取平均值。
將4組油茶花蕾分別用卡諾固定液(純酒精∶冰醋酸∶氯仿=6∶1∶3)固定24 h,然后剝取不同花蕾的花藥,將花粉輕輕擠壓在載玻片上,滴1滴改良苯酚品紅染色液,去除雜質,蓋上蓋玻片,2~3 min后,用體視顯微鏡觀察,數取視野中處于單核早期、單核靠邊期、雙核期等不同發育階段的花粉數目。結合花蕾外觀形態特征及其縱徑、橫徑和縱橫徑之比,對比分析以確定海南白花油茶花蕾的外部形態與花粉發育時期的對應關系,作為日后花藥外植體選材的外觀依據。
1.2.2 接種方法、培養方式和培養基種類
取出花蕾,先用低濃度的洗潔精浸泡20 min,然后用自來水沖洗干凈,并用吸水紙吸干水分。在超凈工作臺上,將花蕾置于無菌燒杯中,用70%的酒精浸泡45 s,用無菌水沖洗1次,然后用0.1%的HgCl2表面消毒14 min,以無菌水沖洗6次。表面消毒完畢后,用解剖刀和鑷子剝去外層花萼,取下花藥(切除花絲),平鋪接種在胚性愈傷組織誘導培養基上。每皿接種不少于25粒花藥,每處理3次重復。然后置于培養室內進行暗培養,培養溫度為(27±2)℃。每隔15 d轉接1次,待愈傷組織誘導出來后,統計愈傷組織誘導率(%),繼續按時進行繼代培養,并統計愈傷組織生長速率(g·d-1),培養50 d后,根據愈傷組織的生長形態,篩選出類胚性愈傷組織。將類胚性愈傷組織繼續轉接到體細胞胚分化誘導培養基上,誘導出體細胞胚,再轉接至體細胞胚成熟和萌發培養基上,形成花藥體細胞胚再生植株。
初代愈傷組織誘導培養基用如下2種:I號為改良MS(大量元素減至2/3)+NAA1mg·L-1+Kt1mg·L-1+ 5% 椰汁+蔗糖 30 g·L-1+瓊脂7g·L-1,其pH值為5.5;II號為改良MS(大量元素減至2/3)+ 2,4-D2mg·L-1+ Kt 0.5 mg·L-1+ 5% 椰汁+蔗糖 30 g·L-1+瓊脂7g·L-1,其 pH 值亦為 5.5。
胚性愈傷組織增殖與再分化的培養基為:改良MS(大量元素減至1/2)+NAA 0.5 mg·L-1+6-BA2mg·L-1+ Zt1mg·L-1+ 10% 椰汁 +蔗糖30 g·L-1+瓊脂7g·L-1,其 pH 值為 5.5。
體細胞胚成熟和植株再生的培養基為:改良MS(大量元素減至1/2)+NAA 0.1 mg·L-1+6-BA 0.5 mg·L-1+ 0.1% 活性炭+蔗糖 30 g·L-1+瓊脂7g·L-1,其 pH 值為 5.5。
1.2.3 愈傷組織誘導率的統計
培養30 d后統計愈傷組織誘導率,每個處理3次重復,取平均值。
愈傷組織誘導率(%)=(誘導出愈傷組織的花藥數目/接種總花藥數目)×100%。
1.2.4 愈傷組織增殖生長和再分化狀態的觀測
稱取一定重量的新鮮愈傷組織接種到新鮮培養基上,繼代培養20 d后,稱取總愈傷組織鮮質量,計算其生長速率,每個處理3次重復,取平均值。
生長速率(g·d-1)=(培養第20天的胚性愈傷組織質量-原接種愈傷組織的質量)/20。
觀測誘導分化過程中胚性愈傷組織的形態學參數,即清晰可見的原胚組織(calli bearing clearly visible proembryos,EC)、褐色或壞死性愈傷組織(brown or necrotic calli,BC)和松碎的愈傷組織(friable calli,FC),以百分比統計,每個處理3次重復,取平均值。
1.2.5 體細胞胚的成熟和植株的再生
挑取暗培養條件下肉眼可見的已分化出球形胚狀體的胚性愈傷組織,將之接種到體胚成熟誘導培養基上,光照培養,等誘導出胚根和胚芽時,再轉接到植株再生培養基(與體細胞胚成熟基本培養相同,未添加激素)上,光照強度約2 000 lx,每天光照培養12 h。
1.2.6 花藥再生植株的移栽
待再生植株長出2片真葉時,即可移栽到裝有基質(腐殖土∶蛭石=1∶1)的育苗杯中,培養20 d后統計移栽成活率。
2 結果與分析
2.1 海南白花油茶花蕾的外部形態及其與花粉發育時期的對應關系
對于多數植物而言,花粉發育處于單核靠邊期時的花藥最容易誘導胚性愈傷組織,且有利于后期體細胞胚狀體的分化。因此,選擇花蕾作為花藥離體培養的外植體時,應嚴格掌握花粉粒的發育時期,從而提高花藥愈傷組織植株再生的效率。海南白花油茶花蕾的外部形態及其與花粉發育時期的對應關系如表1所示。由表1 可知,與i組花蕾的橫徑相比,ii、iii和iv組的橫徑分別顯著增加了28.3%、39.8%和62.4%,其中,ii與iii組間無顯著差異;與i組的花蕾縱徑相比,ii、iii和iv組花蕾的縱徑分別顯著增加了10.2%、24.4%和36.9%,組間差異顯著;與i組花蕾的縱、橫徑之比值相比,隨著縱、橫徑的增加,ii、iii和iv組花蕾的縱橫徑之比與i組的均無顯著差異,其相互間也無顯著差異。

表1 海南白花油茶花蕾的外部形態及其與花粉發育時期的對應關系?Table1 Corresponding relationship between external morphology of flower buds and pollen development phases of C. oleifera in Hainan
花粉不同發育時期的花蕾外觀形態分別如表1和圖1所示。由表1和圖1可知,i組花蕾全萼包被著花瓣,淡黃色的花藥中,花粉發育以單核居中期為主;ii和iii組的花蕾也是全萼包被著花瓣,花藥發育變成橘黃色,花粉發育以單核靠邊期為主;而iv組的花蕾花瓣已露白,花粉發育以雙核期為主。
2.2 不同初代誘導培養基對海南白花油茶花藥愈傷組織誘導的影響
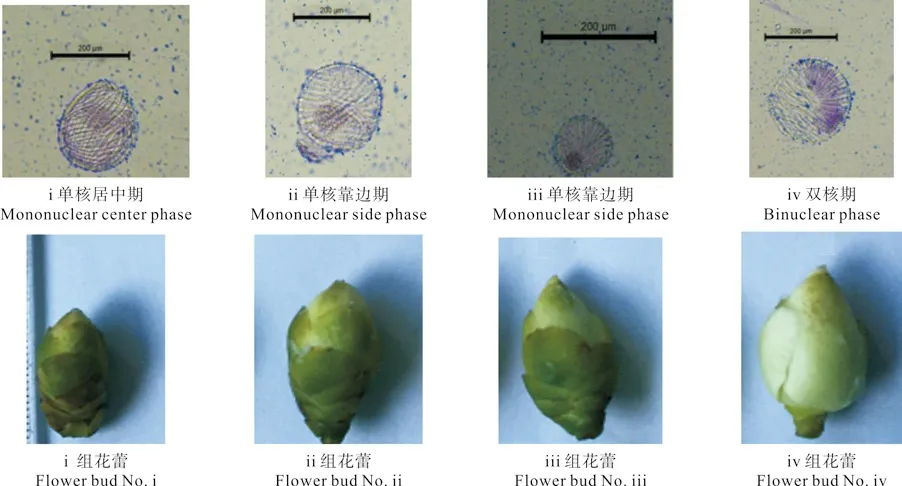
圖1 花粉不同發育時期不同處理組別花蕾的外觀形態Fig.1 External appearances of fl ower buds at different development phases of pollens in different treatments
適宜的初代愈傷組織誘導培養基是確保植物花藥誘導出胚性愈傷組織的前提。以海南白花油茶花粉不同發育時期的花蕾為外植體,經表面消毒后,剝取花藥分別接種到I和II號兩種不同初代愈傷組織誘導培養基上,暗培養第10天時觀察外植體生長情況,第40天時觀察愈傷組織誘導情況,以篩選合適的花藥外植體和初代愈傷組織誘導培養基,觀測結果如圖2所示。在兩種初代愈傷組織誘導培養基上暗培養第10天時,iii和ii組花蕾的花藥生長均較好,其花藥基本保持鮮黃色,褐變較少,花藥均有明顯的脫分化誘導,在I號培養基上的尤其明顯;而i和iv組花蕾的花藥褐變均較明顯,卻均未見明顯的花藥脫分化誘導。由表2和圖2可知,在I號初代愈傷組織誘導培養基上培養第40天時,i組花蕾的花藥愈傷組織誘導率低于10%,與i組花蕾的花藥愈傷組織誘導率相比,iii和ii組花蕾的分別顯著增加約5與7倍,而iv與i組花蕾的花藥愈傷組織誘導率間卻無顯著差異;愈傷組織多呈緊實、規則凸球狀的類原胚性愈傷組織。在II號初代愈傷組織誘導培養基上培養第40天時,i組花蕾的花藥愈傷組織誘導率約為5.38%,iii和ii組花蕾的花藥愈傷組織誘導率比i組花蕾的分別顯著增加約5與10倍,而iv與i組花蕾的花藥愈傷組織誘導率間卻無顯著差異;但愈傷組織松軟不規則,呈水漬狀的多,多數呈現出非胚性愈傷組織。
2.3 不同培養方式對花藥胚性愈傷組織增殖和再分化的影響
挑取I號培養基上生長質地緊實、呈規則小凸球狀的類原胚性愈傷組織接種至胚性愈傷組織的增殖與再分化培養基上,采取光照與暗培養兩種方式進行繼代培養。培養15 d后,觀測愈傷組織的生長速率和生長狀態,結果分別如圖3A與B所示。從圖3A中可以看出,暗培養能明顯維持胚性愈傷組織的胚性特性(EC),組織質地堅實、松碎(FC)而略帶透明,呈現出明顯的體細胞胚再分化球形胚狀態,褐色組織(BC)相對少。從圖3B中可以看出,光照培養條件下,愈傷組織雖也能生長,但只有少部分能維持胚性愈傷組織的胚性特性(EC),而大多數變褐,部分甚至壞死(BC)。經測定,兩種愈傷組織生長速率間的差異不顯著,其生長速率分別為0.078和0.056 g·d-1。
2.4 花藥體細胞胚的萌發和植株再生狀況
將肉眼可見的具球形體細胞胚的胚性愈傷組織轉接至體細胞胚成熟誘導培養基上,繼續暗培養30 d左右,陸續看到有球形的體細胞胚逐漸再分化形成子葉形體細胞胚(如圖4A所示),隨著時間的延長,胚芽萌發,胚根伸長,形成具有主根的花藥體細胞胚再生植株(如圖4B所示),但體細胞胚誘導率極低,僅約有8%。把已具主根的體細胞胚再生植株轉接到沒有激素的植株再生培養基上,培養20 d即可長成具主根和胚芽的花藥胚性愈傷再生植株(如圖4C所示)。

表2 不同發育時期的花藥在不同初代誘導培養基上的生長情況Table2 Growth status of anthers at different development phases in different primary induction media

圖2 花粉不同發育時期的花藥在不同初代誘導培養基上的誘導生長情況Fig.2 Growth status of anthers at different development phases in different primary induction media
2.5 花藥再生植株的移栽情況
待油茶花藥體細胞胚再生植株在培養瓶里長出展開的新葉后取出再生植株,在慢速流水下沖洗粘在根部的培養基,洗干凈后用吸水紙吸干多余的水分,即時移栽到裝有腐殖土和蛭石的比例為6∶4的混合基質的育苗杯中,澆足定根水,遮陰處理2周后即可看到新芽長出(如圖4D所示)。本次實驗誘導出一小批花藥再生植株,以蛭石和椰糠(1∶1)的混合物為基質,全部移栽成活。
3 討論與結論
3.1 花藥胚性愈傷組織誘導的合適花蕾外植體的篩選

圖3 不同培養方式對海南白花油茶花藥愈傷組織增殖和分化的影響Fig.3 Effects of different culture modes on proliferation and differentiation of anther calli of white fl ower C. oleifera in Hainan

圖4 海南白花油茶花藥誘導體細胞胚形成再生植株Fig.4 Somatic embryogenesis regenerated plants of white fl ower C. oleifera anthers in Hainan
花粉粒所處的發育時期對花藥胚性愈傷組織的誘導起關鍵作用,很多研究結果都表明,大多數植物處于單核期的花粉粒其誘導成功率更高[10-11],我們的實驗結果與此相符,ii和iii組花蕾的花粉粒發育大多處于單核靠邊期,花萼全包裹花瓣,花藥橘黃色,誘導胚性愈傷組織的效果均明顯優于i和iv組花蕾的。綜合花蕾的縱徑長、橫徑長及縱橫徑之比來看,對于海南白花油茶而言,其橫徑的長度(1.19~1.30 cm)與花粉發育單核靠邊期的對應關系最近。處此發育階段的花蕾其花萼全包被花瓣,花粉粒大多數處于單核靠邊期,小孢子活力大,最利于誘導花藥胚性愈傷組織。聞麗等[12]的研究結果也表明,在盛花初期所采樣品的愈傷組織誘導率高于盛花末期所采樣品的誘導率。另外,整個花蕾被花萼包裹得很緊實,外界環境中的微生物、昆蟲等也不易進入,接種外植體污染率低,這是海南白花油茶適合花藥誘導愈傷組織的合適外植體,可作為外植體采摘的外觀評價指標。而縱徑間差異顯著、縱橫徑比值間的差別微小,與花粉發育單核靠邊期的對應關系不密切,不宜作為外植體采摘的外觀評價指標。本實驗研究第1次采摘花蕾分析花粉發育時期,經驗尚不足,下一步的優化實驗可采摘橫徑為0.93~1.19 cm的花蕾,再適當細化其橫徑梯度,以便更加精準地篩選出海南白花油茶花粉粒處于單核靠邊期的花蕾,從而提高今后實驗研究和栽培生產的效率。
3.2 花藥胚性愈傷組織誘導的合適初代誘導培養基的篩選
胚性愈傷組織是植物體細胞胚狀體間接發生的前提。一般胚性愈傷組織質地較堅實,顏色為乳白色或黃色,表面具小球形顆粒,細胞內容豐富;而分化能力差的非胚性愈傷組織則與之相反,其組織結構疏松,細胞相對巨大,內含一大液泡,幾乎無細胞器,多呈水浸或褐化狀。實驗結果表明,I號培養基(改良MS+NAA+Kt組合)上的愈傷組織誘導率(%)比II號培養基(改良MS+2,4-D+Kt組合)上的略低,但I號培養基誘導出的愈傷組織呈白色略顯透明發亮,松碎,具小凸球狀,原胚性愈傷組織特征明顯,容易誘導出體細胞胚;而II號培養基誘導出的愈傷組織呈白色略顯暗沉或水漬狀,松軟,不規則塊狀,不適合誘導體細胞胚。故選用I號培養基作為海南白花油茶花藥胚性愈傷的初代誘導培養基較為合適,下一步可通過調整NAA和Kt的濃度配比來優化胚性愈傷組織的誘導培養基,以提高胚性愈傷組織誘導率。丁植磊等的研究結果表明,以MS或N6培養基為基本培養基,添加激素配比如NAA 0.5 mg·L-1+2,4-D 0.6 mg·L-1或 6-BA 0.2 mg·L-1+ 2,4-D 0.5 mg·L-1,以適用于白花油茶與紅花油茶等不同物種愈傷組織的誘導[10],而本研究中以改良MS為基本培養基,添加了NAA+Kt的組合培養基,誘導出的愈傷組織質量更適于體細胞胚的分化,說明2,4-D并不是油茶花藥愈傷組織誘導所必需的培養基,比較而言,同樣在添加細胞分裂素類的生長調節劑Kt的基礎上,輔以添加生長素類的生長調節劑,而添加NAA比添加2,4-D更適用于海南白花油茶愈傷組織的誘導,在后期的增殖培養階段也顯示出了同樣的效果。丁植磊等的研究結果也表明,油茶花藥愈傷組織增殖過程中,在同樣添加生長素類生長調節劑物質NAA的基礎上,輔以添加如玉米素Zt、6-BA和Kt等細胞分裂素,均能獲得較好的愈傷組織增殖效果[10],綜合成本和愈傷組織后期體細胞胚分化的態勢來考慮,NAA+Kt的組合培養基較有利于體細胞胚后期的分化和節約成本。
3.3 花藥胚性愈傷組織體細胞胚狀體的再分化
胚狀體的誘導與外植體所處的生理狀況、培養方式和內源激素的變化及遺傳性、倍性等都有密切關系。在海南白花油茶花藥愈傷組織增殖和再分化過程中,對比分析暗培養和光照培養結果得知,暗培養和光照培養的生長量相差不大,但暗培養能使原胚性愈傷組織有效增殖且能再分化出體細胞胚(再分化率極低,尚待進一步優化篩選培養基和培養條件),而光照培養條件下,花藥愈傷組織早期有綠色芽點突顯,但后期原胚性組織逐漸老化褐死,再生植株分化難。丁植磊等的研究結果表明,油茶花藥愈傷組織暗培養5~10 d即可改善愈傷組織繼代增殖的生長狀況,以葉片作為外植體誘導出的愈傷組織,在光照條件下,前期嫩綠、致密的愈傷組織能正常增殖,但隨著繼代培養時間的延長,愈傷組織會褐死,也不能分化出體細胞胚狀體[10],故油茶花藥愈傷組織的增殖與再分化宜在暗培養條件下誘導。因此,下一步的研究可以采用暗培養的培養方式,對I號培養基中所含激素的種類和配比進行調整,以篩選與優化添加輔助有機物的種類,以提高原胚組織的增殖和再分化效率,促進油茶花藥再生植株的生長。
據相關文獻報道,在大多數植物的花藥培養中,給予一定溫度和時間的低溫預處理是必要的,低溫處理對于雄核發育的影響涉及到花藥內部一系列復雜結構及生理生化的變化[13-14]。低溫可以改變紡錘絲的軸向,破壞紡錘絲的微管蛋白,從而阻止紡錘絲的形成,使有絲分裂的正常過程被打破,從而導致分化過程的發生[15]。雖然本次研究設置的各處理都能誘導出海南白花油茶的花藥愈傷組織,但誘導率都還不夠高,尤其是再分化率太低。據有關油茶花藥再生體系的研究報道,國內油茶以花藥為外植體,目前以花藥愈傷組織的誘導和增殖為主[10,12],鮮有形成植株的報道,油茶再生植株形成,目前多數仍以嫩莖段、葉片和子葉為外植體[9],其中,以嫩莖段為外植體形成的再生植株,可以很好地保持外植體母株的優良性狀,屬自根植株,但誘導生根屬于不定根,所育種苗類似于扦插苗。國家林業局在油茶種苗培育規定中明確規定,禁止使用不定根苗造林,故此類植株更適合作為油茶采穗圃種植供苗,比較而言,其優于遺傳相對不穩定的葉片誘導再生植株。以子葉作為外植體的體細胞胚植株或不定芽植株,雖然相對容易誘導出體細胞胚植株,但由于子葉已屬有性繁殖產物,即使能生產出再生植株,種苗性質也類似于以種子繁育的實生苗,外植體母株的優良性狀因性狀分離會造成遺傳不穩定,故以葉片、子葉為外植體形成的再生體系,更適合作為油茶遺傳轉化技術體系。而以未授粉花藥為外植體,通過誘導花藥胚性愈傷組織體細胞胚胎發生途徑所形成的再生植株,是由體細胞誘導出的具有胚芽和強壯主根的體細胞胚再生植株,可以穩定遺傳外植體母株的優良性狀,又具有強壯主根,省略了當前油茶良種壯苗為了擁有強壯的主根而采取的嫁接環節,可以節省更多的人力、物力和財力。故下一步的研究應對海南白花油茶花藥再生體系進行優化改良,以期早日建立高效、穩定的油花花藥再生體系,為今后利用花藥體細胞胚再生體系生產良種壯苗,建立高效、穩定的海南白花油茶遺傳轉化體系,從而為后期的油茶功能基因研究和利用基因工程技術加速油茶抗病、高產育種而奠定基礎。
[1] 莊瑞林.中國油茶[M].第2版.北京:中國林業出版社,2008.
[2] 黃明智,王 鋒. 油茶發展的有利條件及對策[J].現代農業科技,2009(17):62.
[3] 楊枝林,曾祥全,陳飛飛,等.海南島油茶資源現狀[J].經濟林研究,2015,33(3):138-144.
[4] 符澤華,段偉華,渠心靜.不同品種接穗對油茶高接換冠后產量及經濟性狀的影響[J].中南林業科技大學學報,2017,37(10): 75-79.
[5] 朱叢飛,羅漢東,胡冬南,等.油茶林土壤生化性對磷素水平的響應研究[J].中南林業科技大學學報,2017,37(2):57-62.
[6] 摹先勝.我國油茶資源的開發利用研究[J].湖南科技學院學報,2005,26(11):127-129.
[7] 韓寧林.油茶豐產栽培技術研究進展[J].林業科技開發,2000,14(1):10-13.
[8] Wang R, Chen Y Z. Camellia tissue culture and plant regeneration research[J]. Hunan Forestry Science and Technology, 2006,33(5):63-66.
[9] 張智俊,羅淑萍,李亞玲,等.油茶優良無性系子葉體細胞胚植株再生[J].植物學通報,2005,22 (S1):43-49.
[10] 丁植磊.油茶花藥愈傷組織誘導及繼代培養研究[D].長沙:中南林業科技大學,2007.
[11] 范曉明,袁德義,譚曉風,等.油茶花藥離體培養影響因子研究[J].南京林業大學學報(自然科學版),2011,35(5):125-128.
[12] 聞 麗,張日清,劉友全,等.不同培養條件對油茶花藥愈傷組織形成的影響[J].經濟林研究,2007,25(2):9-14.
[13] 劉國民.花藥離體培養中若干問題的研究進展[J].海南大學學報,1994,12(3):53-59.
[14] 張日清,聞 麗,劉友全,等.低溫預處理對油茶花藥愈傷組織誘導的影響[J].中南林學院學報,2005,25(6):24-28.
[15] Sato S, Katoh N, Iwai S, et al. Effect of low temperature pretreatment of buds on inf l orescence on isolated microspore culture in Brassica rapa (syn B campestris) [J]. Breeding Science, 2002,52(1): 23-26.

