淹水脅迫對湖北海棠生長和生理特性的影響
劉 雪 ,彭 冶,范俊俊 ,張往祥 ,李 鑫 ,鄒 旭
(1. 南方現代林業協同創新中心,江蘇 南京 210037;2. 南京林業大學a.生物與環境學院;b.林學院,江蘇 南京 210037)
湖北海棠Malus hupehensis (Pamp.) Rehd.又名野海棠、茶海棠,隸屬于薔薇科Rosaceae 蘋果屬Malus,廣泛分布于我國黃河流域以南大部分省區,由于其生長健壯、具有無融合生殖特性、種子易繁殖且不帶病毒等優良性狀,常被作為蘋果屬的優良砧木,是一種十分重要的蘋果種質資源[1],湖北海棠還是一種傳統的藥食兩用植物,不僅含有有大量的蛋白質和茶多酚,還含有豐富的黃酮類物質、根皮苷及多種微量元素[2],具有抗氧化、降低血糖和保肝等藥理活性,在飲料、藥品和保健食品的開發利用方面具有廣闊的應用前景。目前,針對湖北海棠的研究多集中在其黃酮類物質、多酚、根皮苷的提取工藝方面[1-5],而有關耐澇性的研究卻鮮有報道。
受全球氣候變暖的影響[6-7],我國洪澇災害頻發,這給我國農林業以及環境造成了巨大的經濟損失[8-9]。因此,在洪澇多發地區(如沿江、沿海等)培育耐受洪澇災害的觀賞樹種,對其景觀的營造和恢復具有重要意義。
湖北海棠樹姿優美,花色艷麗,是我國南方地區園林綠化的傳統樹種。本試驗通過人工模擬淹水脅迫,對淹水脅迫下湖北海棠幼苗形態、生長和葉片生理生化指標進行了研究。探討湖北海棠的抗澇性機制和適應機制,以期為今后培育出觀賞價值高且抗逆境能力強的湖北海棠提供理論依據,也為湖北海棠在洪澇多發地區的推廣應用提供理論依據。
1 材料與方法
1.1 試材及取樣
試驗材料為3年生湖北海棠實生苗。試驗在江蘇省揚州市江都區仙女鎮(119°55′E,32°42′N)實驗基地展開。試驗共設淹水和對照2種處理:對照為田間持水量的75%,淹水為水面高于土壤表面5cm。每個處理選取長勢和大小基本一致苗木100株。每個處理單元種植面積為8m2(長8 m、寬1 m) ,土壤厚度30 cm。每個處理單元在底部和側面分別鋪 2層塑料膜,分別在土層表面下的30、0 cm 和高出土層5cm處設有排水孔。2015年11月15日種植湖北海棠幼苗,2017年4月6日開始淹水處理,5月25日結束淹水。淹水期間,每天觀察土壤水面變化,進行水分排灌。分別在淹水處理后的7、14、21、35、49 d的13:00采集湖北海棠葉片,樣品采集后立即采用干冰速凍,當天放入超低溫冰柜中,用于各生理指標的測定。
1.2 指標測定及方法
超氧化物歧化酶(SOD)活性的測定采用氮藍四唑光還原測定法[10];可溶性糖和丙二醛(MDA)含量的測定參考孔祥生的方法[11];葉綠素和類胡蘿卜素含量的測定采用 95%乙醇浸提法[12]。
1.3 數據統計分析
采用 Excel 2013、Word2003 和SPSS 22. 0對數據進行處理和統計分析,用 Duncan 法進行差異顯著性檢驗。所有數據采用平均值 ± 標準差。
2 結果與分析
2.1 淹水脅迫對湖北海棠形態的影響
2.1.1 葉色的變化
湖北海棠的葉色伴隨淹水過程發生了顯著變化,見圖1。由圖1可知,淹水0~21 d,湖北海棠葉片顏色逐漸由綠色變為紫紅色。其中,在21 d時葉片呈深紫紅色。隨后,其葉片顏色由紫紅色向黃綠色轉變,至淹水49 d葉片顏色均變為黃綠色。
2.1.2 皮孔和不定根的變化
本試驗觀察到淹水28 d時,湖北海棠莖基部皮孔變得肥大;淹水35 d,莖基部皮孔持續變大;淹水42 d莖基部皮孔不僅變得肥大,其數量也顯著增加。在淹水49 d時,較多數量的不定根從莖基部皮孔伸出(見圖2)。
2.2 淹水脅迫對湖北海棠生長的影響
2.2.1 淹水脅迫對湖北海棠存活率的影響
存活率可以最直觀地反映苗木的耐水能力。本試驗淹水49 d,湖北海棠苗木的存活率為100%,說明湖北海棠的耐澇能力極強。
2.2.2 淹水脅迫對湖北海棠苗高的影響

圖1 淹水脅迫對湖北海棠葉片顏色的影響Fig.1 Effects of waterlogging stress on leaf color in M. hupehensis seeding

圖2 淹水脅迫對湖北海棠莖部的影響Fig.2 Effects of waterlogging stress on stem in M. hupehensis seeding
淹水脅迫對湖北海棠苗高的影響情況見圖3。由圖3可知,在整個淹水過程中,對照和處理的湖北海棠的苗高均呈增長的趨勢,對照的苗高的相對增長率為53.25%,處理組的苗高相對增長率為27.04%。此外,淹水的各個時期(0~49 d),湖北海棠苗木的苗高均高于對照,其中,0~42 d,對照與淹水間差異不顯著(P>0.05);淹水49 d時,湖北海棠苗木的苗高顯著低于對照(P<0.05)。這說明短期淹水(0~42 d)對湖北海棠苗木的苗高生長沒有顯著影響,當淹水時間達到49 d時,會顯著抑制其苗高生長。
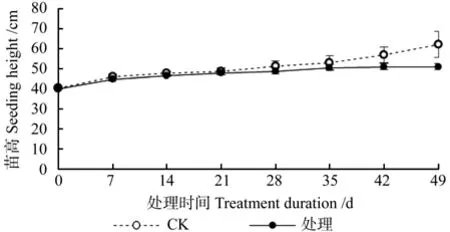
圖3 淹水脅迫對湖北海棠苗高的影響Fig.3 Effects of waterlogging stress on height of M. hupehensis seeding
2.2.3 淹水脅迫對湖北海棠地徑的影響
淹水脅迫對湖北海棠地徑的影響情況見圖4。由圖4可知,在整個淹水過程中,對照和處理的湖北海棠的地徑均呈增長的趨勢,對照的苗高的相對增長率為88.26%,處理組的苗高相對增長率為54.86%。淹水0~35 d,地徑高于對照,其中,只有在淹水至21 d時,地徑顯著高于對照(P<0.05)。淹水35 d后,對照組幼苗的地徑顯著高于處理(P<0.05)。這說明短期淹水對湖北海棠苗木的地徑的增長有一定的促進作用,當淹水時間超過35 d后,會顯著抑制其增長。

圖4 淹水脅迫對湖北海棠地徑的影響Fig.4 Effects of waterlogging stress on ground diameter of M.hupehensis seeding
2.3 淹水脅迫對湖北海棠可溶性糖含量的影響
可溶性糖是植物體內一種重要的滲透調節物質[13-14],植物為了適應逆境條件會主動積累一些可溶性糖以維持細胞膨壓[19]。如圖5,淹水脅迫下(0~49 d),湖北海棠葉片可溶性糖的含量總體呈上升趨勢,且其含量均顯著高于對照(P<0.01),其中,淹水42 d時,葉片可溶性糖含量達到了峰值287.47 mg·g-1,為對照的1.47倍。

圖5 淹水脅迫對湖北海棠可溶性糖含量的影響Fig.5 Effects of waterlogging stress on soluble sugar content in M. hupehensis seeding
2.4 淹水脅迫對湖北海棠SOD酶活性的影響
淹水脅迫對湖北海棠SOD活性的影響情況見圖6。由圖6可知,在整個淹水期間,湖北海棠葉片的SOD酶活性總體呈現出先升高后下降的趨勢。淹水前期(0~7 d),處理與對照間差異不顯著(P>0.05),淹水7 d后,湖北海棠葉片的SOD酶活性上升,淹水21 d時SOD酶活性達到最大值1501.28 U·mg·g-1,為對照的 1.82 倍。淹水處理21 d后,SOD酶活性急劇下降,到淹水結束時,SOD酶活性降為968.51 U·mg·g-1,淹水處理14~49 d,葉片SOD酶活性均顯著高于對照(P<0.05),且始終保持在一個較高的水平。

圖6 淹水脅迫對湖北海棠SOD活性的影響Fig.6 Effects of waterlogging stress on SOD activity in M. hupehensis seeding
2.5 淹水脅迫對湖北海棠MDA的影響
淹水脅迫對湖北海棠MDA的影響情況見圖7。由圖7可知,在整個淹水期間,葉片的MDA的含量呈現出先上升后下降的趨勢。其中,淹水前期(0~7 d),MDA的含量較低,與對照間差異不顯著(P>0.05),淹水7~42 d,MDA的含量急劇上升,顯著高于對照(P<0.05),且在淹水42 d 時達到最大值130.70 umol·g-1,為對照的2.87倍。淹水42 d后MDA含量顯著下降(P<0.01),到淹水結束時,MDA含量為93.02 umol·g-1,仍顯著高于對照(P<0.01)。這說明長期淹水對湖北海棠葉片細胞膜造成了一定程度的傷害。

圖7 淹水脅迫對湖北海棠MDA的影響Fig.7 Effects of waterlogging stress on MDA content in M. hupehensis seeding
2.6 淹水脅迫對湖北海棠光合色素的影響
淹水脅迫對湖北海棠葉片光合色素含量的影響情況見表1。由表1可知,淹水結束時,湖北海棠葉片的葉綠素a 、葉綠素b、 葉綠素a/葉綠素b、葉綠素(a + b)、類胡蘿卜素含量均顯著下降。而類胡蘿卜素/ 總葉綠素的比值顯著升高。

表1 淹水脅迫對湖北海棠葉片光合色素含量的影響?Table1 Effects of waterlogging stress on photosynthetic pigments contents in M. hupehensis seeding leaf
3 討論與結論
3.1 淹水脅迫對湖北海棠形態的影響
3.1.1 淹水脅迫對湖北海棠葉色變化的影響
植物依靠葉片進行光合作用積累的有機物質來維持植株的生長。植物葉片的顏色主要由葉綠素、類胡蘿卜素和花青素等決定。當葉片葉綠素的含量占的比值較大時(>60%),葉片呈現綠色;當葉片中花色素苷占的比值較大時( 60%~80%),葉片呈現紅色;當葉片中葉綠素和花色素苷比例減少到一定程度時(< 60%),葉片呈現出類胡蘿卜素的黃色[15]。本試驗淹水期間,湖北海棠葉色變化與大多數不耐水澇植物如銀杏Ginkgo biloba、黃連木Pistacia chinensis和東北山櫻Cerasus sachalinensis等幼苗[16],在淹水初期就出現水漬斑,在后期葉片卷曲、枯萎等現象不同。由圖1可看出,湖北海棠的葉色伴隨淹水過程發生了顯著變化。淹水0~21 d,湖北海棠葉片顏色逐漸由綠色變為紫紅色,其中,在21 d時葉片變為深紫紅色,這可能是淹水使湖北海棠葉片細胞的膜系統受到傷害,間接影響了葉綠體的功能;隨后,其葉片顏色由紫紅色向黃綠色轉變,至淹水49 d葉片顏色均變為黃綠色,這可能是因為在此期間湖北海棠皮孔肥大、數量增多以及形成不定根,緩解了淹水對細胞膜系統造成的傷害。
3.1.2 淹水脅迫對湖北海棠皮孔和不定根變化的影響
大量研究表明,耐澇樹種對淹水的形態響應是莖部形成大量的不定根和皮孔變得肥大[17-18]。
皮孔肥大而顯著的現象是耐淹木本植物對淹水脅迫的重要響應之一[19-21]。皮孔肥大可能是細胞間隙增大,使細胞分散以及細胞體積增大延伸使莖基部組織的膨脹造成的[19-20],這可能與乙烯的產生有關。本試驗觀察到淹水28 d時,湖北海棠莖基部皮孔變得肥大;淹水35 d,莖基部皮孔持續變大;淹水42 d莖基部皮孔不僅變得肥大,其數量也顯著增加。這與汪貴斌等人[21]對喜樹Camptotheca acuminata在淹水脅迫下的研究結果一致,其結果表明在澇漬脅迫下,喜樹的莖在水面以下部位出現許多皮孔,并隨處理時間的延長皮孔不斷增大、增多。此外,Phukan[17]等人報道,裸子植物如大葉南洋杉Araucaria bidwellii、落葉松屬Larix laricina、紅豆杉屬Taxus sp、云杉屬Picea sp和被子植物如中華蚊母樹Distylium chinense、橡膠樹Hevea brasiliensis、梨屬Pyrus sp、美洲榆Ulmus americana,在淹水環境下莖部也會出現皮孔變得肥大的現象。這種結構不僅有利于O2的向下擴散,還有利于根部厭氧代謝產生的副產物如乙醇、CH4、CO2的從莖中排到大氣中[19]。
不定根的形成是耐淹木本植物適應淹水環境的重要特征之一[17,19,22]。有研究表明,植物淹水脅迫后,其組織中高水平的乙烯會增加對IAA的敏感[17],一定濃度的IAA會誘導NO的暫時積累,激活了一個MAPK級聯,最終導致不定根的生成[19]。如喜樹在長期淹水下初生根大量死亡,不定根大量形成[21];美洲榆在淹水環境中產生兩種類型的不定根,一種是密而多分枝且深入土壤,另一種是疏而無分枝并漂浮在水面[22];樸樹Celtis sinensis幼苗在淹水環境下,原有根系大量發黑死亡,并在莖基部產生大量較為發達的不定根,而在原有根系粗大主根的上部也發出大量的新生根[22]。這些新生的根常常呈膨大狀,其中可能存在較為發達的通氣組織,從而使樸樹幼苗在一定程度上適應了淹水環境。本試驗淹水49 d,較多數量的不定根從湖北海棠莖基部皮孔伸出(見圖2)。這與樸樹、喜樹、美洲榆等樹種在淹水下形成不定根的情況類似。不定根細胞間的隙腔較大,它減小了氧氣傳輸的距離,降低了O2的徑向損失,從而提高了氧氣擴散能力[23],也可代替受損的主根系吸收水和營養物質,這對于植物在淹水脅迫環境中的生存具有重要意義。
大量研究表明[17,23],不定根和皮孔彼此聯系創造了一個氣體運輸體系,它使根能進行呼吸作用,水和營養物質也能向上運輸到植物各器官。因此,在淹水逆境下,湖北海棠能通過形成較多數量的肥大皮孔、不定根適應逆境。
3.2 淹水脅迫對湖北海棠生長的影響
苗木的存活狀況直觀地反映了植物耐澇性的強弱。本試驗淹水過程中,湖北海棠苗木的存活率為100%,說明湖北海棠的耐澇能力極強。
眾多研究結果表明植物在淹水脅迫下,其高生長會受到抑制。如烏桕Sapium sebiferum、麻櫟Quercus acutissima、美洲黒楊無性系Populus deltoides clones、黃山欒樹Koelreuteria Integrifoliola、無患子Sapindus saponaria幼苗的高生長會因淹水脅迫而降低[1,22,24,25]。本試驗淹水0~42 d,湖北海棠的苗高與對照間差異不顯著(P>0.05),淹水49 d時,湖北海棠的苗高顯著低于對照(P >0.05)。說明短期淹水對湖北海棠的苗高沒有影響,淹水時間過長會顯著抑制其苗高生長。曹福亮等人[26]認為,淹水造成苗高生長降低的直接原因是阻礙了節間的生長,間接原因是阻止葉原基分化、葉片生長,誘導葉衰老、脫落等。
地徑是反映苗木質量的指標之一,且與苗木生長量及其抗逆性密切相關[27],一般情況下逆境脅迫越強,耐澇林木的地徑增粗越明顯,這可能是由于形成了肥大的皮孔以及在莖基部形成了通氣組織導致,但因樹種不同,地徑生長存在差異[28]。本試驗結果表明,短期淹水對湖北海棠苗木地徑的增長有一定的促進作用,當淹水時間超過35 d后,會顯著抑制其地徑增長。
3.3 淹水脅迫對湖北海棠光合色素的影響
植物葉片中的光合色素參與光合作用中光能的吸收、傳遞和轉換,其含量能影響植物光合作用的能力[29]。Ge等人[30]研究表明,水分脅迫不僅使植物的葉綠素含量降低[7],類胡蘿卜素的含量也會降低。本試驗淹水結束時,湖北海棠葉片的葉綠素a 、葉綠素b、 葉綠素a/葉綠素b、葉綠素(a + b)、類胡蘿卜素含量均顯著下降,類胡蘿卜素/總葉綠素的比值顯著增大。這可能是淹水引起活性氧(Reactive oxygen species, ROS)增多,引起葉片細胞膜脂過氧化,導致了光合色素的合成能力下降。
3.4 淹水脅迫對湖北海棠可溶性糖含量的影響
土壤淹水使植物根系暴露在低氧或缺氧的條件下,這會導致能量和糖類的不足,會使根內產生乙醇、乙醛等有害物質[31],會對植株的生長發育造成嚴重的危害。為了確保滲透調節,植物體內會積累高水平的可溶性溶質,如可溶性糖、脯氨酸、蛋白質[32]等。Pociecha認為植物可以通過積累額外的碳水化合物儲備,提高其淹水耐受性及在淹水脅迫下的存活能力[33]。Kreuzwieser等人[20]認為一些敏感植物在淹水一段時間后會消耗可溶性糖,而一些耐澇性較強的植物在淹水過程中可以保持穩定和充足的碳水化合物的供應,以調高糖酵解,這是樹木在低氧脅迫下生存的關鍵。在本試驗淹水的各個時期,湖北海棠葉片的可溶性糖含量始終保持在一個較高的水平,說明湖北海棠在淹水逆境中,通過積累可溶糖來緩解淹水逆境對其造成的傷害。
3.5 淹水脅迫對湖北海棠細胞膜和SOD酶活性的影響
活性氧(ROS)的產生是淹水脅迫下的一種次生效應[34]。淹水逆境下,植物ROS代謝易失衡,導致超氧陰離子自由基(O2-·) 、羥自由基(·OH)、過氧化氫(H2O2)等的過度積累[36],會引起膜系統損傷及細胞氧化,發生膜脂過氧化作用[35-37]。丙二醛是膜脂過氧化的最終產物,其積累量通常被作為細胞膜傷害程度的指標[35,38]。Li等人[39]研究顯示,低氧脅迫下,湖北海棠和變葉海棠Malus toringoides根內的O2-·和H2O2顯著上升,葉片MDA含量顯著增高。廖德志等人[40]研究表明,水澇逆境下3個種源青岡櫟Cyclobalanopsis glance的MAD含量均呈顯著上升的趨勢,且在淹水條件下 MDA 含量均顯著高于濕害處理。本試驗淹水前期(0~7 d),MDA的含量較低,與對照差異不顯著(P>0.05);淹水7~42 d,MDA的含量急劇上升,顯著高于對照(P<0.05),且在淹水42 d 時達到最大值130.70 umol·g-1,為對照的2.87倍。這說明在此期間,淹水對湖北海棠葉片細胞膜造成了一定程度的傷害;淹水42 d后MDA含量顯著下降(P<0.01),可能是在淹水后期莖基部形成肥大皮孔、不定根,這2種結構不僅有利于O2的向下擴散,還有利于根部厭氧代謝產生的副產物如乙醇、CH4、CO2的從莖中排到大氣中,從而緩解了淹水對葉片細胞膜的傷害。
植物在淹水下受到的傷害不是因為水分過多造成的,而是植物處于缺氧環境,產生過多的活性氧,導致細胞受到氧化損傷[41]。SOD作為一種O2-·的清除劑,能將O2-·轉化成 H2O2和O2[30,42],最終由POD酶清除[35,43]。在本試驗淹水的前21 d,SOD酶活性呈上升趨勢,且在21 d,酶活性達到最大為1501.28 U·mg·g-1,是對照的1.82倍,說明在淹水的前21 d,湖北海棠可以通過調節SOD酶活性以增大自身的抗氧化能力及清除活性氧的能力;處理21 d后,SOD酶活性急劇下降,但仍顯著高于對照(P<0.05)。這說明此時湖北海棠的活性氧清除能力仍較強。
由于植物固著的特性,不能逃避淹水脅迫,在此環境下,耐澇性木本植物可以通過形態適應和生理調節適應淹水逆境[18,20,44]。本試驗中,湖北海棠在淹水后期可以通過形成較多數量的肥大皮孔、不定根以及保持較高的碳水化合物水平和較高的SOD酶活性來緩解淹水逆境對其造成的傷害。因此,湖北海棠屬于耐水澇的觀賞樹種,可在洪澇多發區(如沿江、沿海等)推廣種植。
植物的抗澇性是一種復合性狀,包含形態、生長、解剖構造、生理生化和分子表達等方面[45]。本試驗設置淹水和對照2種處理,以苗木的形態特征、生長狀況、生理生化指標等的變化為研究對象,對湖北海棠的抗澇性進行初步探索。有關淹水脅迫下苗木莖結構的變化,以及淹水過程中內源激素的變化,本試驗未能深入探究。若想更深入地了解湖北海棠在淹水脅迫的響應機理,可增加淹水脅迫后恢復性試驗,并結合解剖結構、內源激素變化等指標對湖北海棠抗澇能力進行全面評價。
[1] 陳琳琳, 吳瑞姣, 劉連芬, 等. 湖北海棠的研究進展及應用前景[J]. 北方園藝, 2013,37, (16):217-221.
[2] 李 艷, 黎開燕. 湖北海棠的化學成分和藥理活性研究進展[J].中國實驗方劑學雜志, 2016,22 (2):226-229.
[3] 張宏岐, 汪鋆植, 鄒 坤,等. 湖北海棠提取物的體外抗氧化活性研究[J]. 食品科技, 2008, 33(11):183-186.
[4] 方 榮, 楊 茜, 李 莉,等. 湖北海棠中根皮苷含量測定[J].食品科技, 2008,33 (6): 247-249.
[5] 王耀峰, 宮智勇, 方 敏. 湖北海棠葉黃酮類物質提取工藝的研究. 武漢工業學院學報, 2008,27(2): 12-15.
[6] Bansal R, Srivastava J P. Antioxidative responses to short term waterlogging stress in pigeon pea[J]. Indian Journal of Plant Physiology, 2015, 20(2):182-185.
[7] Zhou C, Bai T, Wang Y, et al. Morpholoical and enzymatic responses to waterlogging in three Prunus, species[J]. Scientia Horticulturae, 2017, 221:62-67.
[8] Zhang Y, Chen Y, Lu H, et al. Growth, lint yield and changes in physiological attributes of cotton under temporal waterlogging[J].Field Crops Research, 2016, 194:83-93.
[9] 曹福亮, 蔡金峰, 汪貴斌, 等. 淹水脅迫對烏桕生長及光合作用的影響[J]. 林業科學, 2010,46 (10):57-61.
[10] Mustroph A, Albrecht G. Tolerance of crop plants to oxygen deficiency stress: fermentative activity and photosynthetic capacity of entire seedlings under hypoxia and anoxia[J].Physiologia Plantarum, 2003,117(4):508-520.
[11] 孔祥生. 植物生理學實驗技術[M]. 北京:中國農業出版社,2008: 257-259.
[12] Wellburn A R, Lichtenthaler H. Formulae and program to determine total carotenoids and chlorophylls A and B of leaf extracts in different solvents[M]. Springer Netherlands, 1984:9-12.
[13] 梁文斌, 聶東伶, 吳思政,等. 水分脅迫對短梗大參生理生化特征的影響[J]. 經濟林研究, 2016, 34(3):99-104.
[14] 張富瑋, 張東亞, 李建貴. 低溫脅迫對藍靛果忍冬滲透調節物質的影響[J]. 經濟林研究, 2017,35(2):127-131.
[15] 楚愛香, 張要戰, 王萌萌. 四種槭樹屬(Acer)植物秋色葉變化與色素含量和可溶性糖的關系[J]. 江西農業大學學報,2013, 35(1):108-111.
[16] 秦嗣軍, 呂德國, 李志霞, 等. 水分脅迫對東北山櫻幼苗呼吸等生理代謝的影響[J]. 中國農業科學, 2011,44(1):201-209.
[17] Phukan U J, Mishra S, Shukla R K. Waterlogging and submergence stress: affects and acclimation[J]. Crit Rev Biotechnol, 2016,36(5):956-966.
[18] Argus R E, Colmer T D, Grierson P F. Early physiological fl ood tolerance is followed by slow post-f l ooding root recovery in the dryland riparian tree Eucalyptus camaldulensis subsp refulgens[J]. Plant Cell & Environment,2015,38(6):1189.
[19] Kreuzwieser J, Rennenberg H. Molecular and physiological responses of trees to waterlogging stress[J]. Plant Cell &Environment, 2015, 37(10):2245-2259.
[20] Shimamura S, Yamamoto R, Nakamura T, et al. Stem hypertrophic lenticels and secondary aerenchyma enable oxygen transport to roots of soybean in fl ooded soil[J]. Annals of Botany,2010, 106(2):277-284.
[21] 汪貴斌, 蔡金峰, 何肖華. 澇漬脅迫對喜樹幼苗形態和生理的影響[J]. 植物生態學報, 2009,33(1):134-140.
[22] 劉春風. 淹水對15個樹種苗木生長和形態特征的影響[D].南京:南京林業大學, 2009.
[23] Sauter M. Root responses to flooding[J]. Current Opinion in Plant Biology, 2013, 16(3):282.
[24] Yang F, Wang Y, Wang J, et al. Different eco-physiological responses between male and female Populus deltoides clones to waterlogging stress[J]. Forest Ecology and Management, 2011,262(11): 1963-1971.
[25] 張曉磊, 馬風云, 陳益泰, 等. 水澇脅迫下不同種源麻櫟生長與生理特性變化[J]. 西南林學院學報, 2010,30 (3):16-19.
[26] 曹福亮, 羅伯特·法門. 人工淹水逆境處理對美洲黑楊苗生理特性的影響[J]. 南京林業大學學報(自然科學版), 1993,17(2): 18-24.
[27] 劉 勇. 我國苗木培育理論與技術進展[J]. 世界林業研究,2000,13(5):43-49.
[28] 王哲宇. 九種木本植物幼苗的淹水脅迫生理特征研究[D]. 南京:南京林業大學, 2014.
[29] 吳麗君, 李志輝, 戴 玲,等. 土壤水分脅迫下不同赤皮青岡種源生理特性的研究[J]. 中南林業科技大學學報, 2014,34(2):12-15.
[30] Ge Y, He X, Wang J, et al. Physiological and biochemical responses of Phoebe bournei seedlings to water stress and recovery[J]. Acta Physiologiae Plantarum,2014,36(5):1241-1250.
[31] 吳 麟,張偉偉,葛曉敏,等.植物對淹水脅迫的響應機制研究進展[J].世界林業研究,2012, 25(6):27-33.
[32] Yin D, Chen S, Chen F, et al. Morphological and physiological responses of two chrysanthemum cultivars differing in their tolerance to waterlogging[J]. Environmental and Experimental Botany, 2009, 67(1):87-93.
[33] Pociecha E. Different physiological reactions at vegetative and generative stage of development of fi eld bean plants exposed to flooding and undergoing recovery[J]. Journal of Agronomy &Crop Science, 2013, 199(3):195-199.
[34] Porto B N, Alves J D, Magalh?es P C, et al. Calcium-dependent tolerant response of cell wall in maize mesocotyl under fl ooding stress[J]. Journal of Agronomy & Crop Science, 2013, 199(2):134-143
[35] Bor M, ?zdemir F, Türkan I. The effect of salt stress on lipid peroxidation and antioxidants in leaves of sugar beet Beta vulgaris L and wild beet Beta maritima L[J]. Plant Science, 2003,164(1):77-84.
[36] Mittal R, Dubey R S. Behaviour of peroxidase in rice: Changes in enzyme activity and isoforms in relation to salt tolerance[J].Plant Physiology & Biochemistry, 1991, 29:31-40.
[37] Foyer C H, Lopez-Delgado H, Dat J F, et al. Hydrogen peroxideand glutathione-associated mechanisms of acclimatory stress tolerance and signalling[J]. Physiologia Plantarum, 1997, 100(2):241-254.
[38] Xu L, Pan Y, Yu F. Effects of water-stress on growth and physiological changes in Pterocarya stenoptera seedlings[J].Scientia Horticulturae, 2015,190:11-23.
[39] Li C, Bai T, Ma F. Hypoxia tolerance and adaptation of anaerobic respiration to hypoxia stress in two Malus species[J]. Scientia Ho rticulturae,2010,124(2):274-279.
[40] 廖德志,陳家法,劉 球,等 . 水澇脅迫對不同種源青岡櫟幼苗葉綠素含量和抗氧化酶活性的影響 [J]. 中南林業科技大學學報,2017, 37(9): 1-6.
[41] Mittler R, Vanderauwera S, Gollery, et al. Abiotic stress series reactive oxygen gene network of plants[J]. Trends Plant Sci,2004, 9(2):490-498.
[42] Blokhina O, Virolainen E, Fagerstedt K V. Antioxidants,oxidative damage and oxygen deprivation stress: a review[J].Annals of Botany, 2003,91(2):179.
[43] Saha R R, Ahmed F, Mokarroma N, et al. Physiological and biochemical changes in waterlog tolerant sesame genotypes[J].Agri, 2016,14 (2):31.
[44] Loreti E, H Van V H, Perata P. Plant responses to flooding stress[J]. Plant Biology, 2016 ,33: 64-71.
[45] 武燕奇,郭素娟 .5個板栗品種(系)對持續干旱脅迫和復水的生理響應 [J]. 中南林業科技大學學報,2017, 37(10):67-74.

