老年ARDS患者硝酸甘油聯合亞低溫治療的臨床效果觀察
譚九根 歸淑華 謝建平 項美玲 齊宏宇
急性呼吸窘迫綜合征(ARDS)是由非心源性致病因素引起、以呼吸困難和頑固性低氧血癥為臨床表現的綜合征,是ICU中的常見重癥,嚴重威脅患者的生命[1]。老年ARDS患者由于呼吸功能和其它各項身體功能退化,免疫功能下降,并常伴有高血壓、糖尿病等慢性疾病,病死率更是居高不下[2]。國內外學者對該病的發生、發展機制尚有爭議,但肺毛細血管內皮細胞和肺泡上皮細胞凋亡,以及肺內促炎-抗炎介質的失衡所致肺泡-肺毛細血管通透性增加,是目前公認的ARDS患者肺組織間接損傷因素[3]。有研究發現,亞低溫狀態在降低機體代謝的同時,還能減輕炎癥反應[4]。而硝酸甘油可改善肺組織微循環[5]。筆者對近年來本院收治的老年ARDS患者采用硝酸甘油聯合亞低溫治療,并與僅采用常規治療的患者作了比較發現,該方法可以改善患者肺毛細血管通透性及短期療效,現報道如下。
1 對象和方法
1.1 對象 選取2014年2月至2016年10月我院ICU收治因肺部感染導致的老年ARDS患者73例,男53例,女 20 例,年齡 60~75(67.4±5.3)歲。納入標準:(1)符合2012年ARDS柏林診斷標準[6],且診斷ARDS<24h;(2)年齡≥60 歲;(3)接受機械通氣治療。排除標準:(1)慢性阻塞性肺疾病(COPD)、間質性肺疾病、肺栓塞患者;(2)其它重要臟器嚴重器質性病變;(3)腫瘤、燒傷或血液系統疾病。按隨機數字表法分為觀察組37例與對照組36例。兩組患者性別、年齡、APACHEⅡ評分以及氧合指數等一般資料差異均無統計學意義(均P>0.05),詳見表1。本研究經醫院倫理委員會審核同意,患者及家屬簽署知情同意書。

表1 兩組患者一般資料的比較
1.2 方法 對照組患者根據《實用重癥醫學》中的治療原則接受常規對癥處理以及原發病治療,包括器官功能支持、呼吸支持以及綜合處理[7]。機械通氣采取肺保護性通氣策略,為同步間歇指令通氣模式(SIMV),將氣道平臺壓維持≤30cmH2O。觀察組患者在常規治療基礎上,進行硝酸甘油治療聯合全身降溫式(亞低溫)治療。具體方法:靜脈泵入硝酸甘油0.5mg/h,同時使用BlandetrolⅡ-Model 223R型水毯式醫用控溫儀(購于美國Sub Zero公司)對患者進行降溫,確保患者鼻咽溫度(中心體溫)在1h內降為34~35℃,并維持連續72h,之后進行緩慢復溫,復溫速率控制在1℃/d。
1.3 觀察指標 分別于治療前和治療后(觀察組患者為體溫穩定后)第1、24、48、72h進行APACHEⅡ評分,并進行動脈血氣分析。抽取5ml靜脈血,經抗凝、離心、分離和鑒定操作計數循環內皮細胞(CEC)。使用床旁纖維支氣管鏡進行肺泡灌洗,取灌洗液,ELISA法檢測TNF-α、肺泡表面活性蛋白A(SP-A)、血管內皮生長因子(VEGF)水平,操作嚴格根據試劑盒說明書進行。床旁脈波指示劑心排血量監測對患者血管外肺水指數(EVLWI)和肺血管通透性指數(PVPI)進行監測。同時記錄兩組患者機械通氣治療與7d、28d存活率。
1.4 統計學處理 應用SPSS 18.0統計軟件。計量資料用表示,兩組間比較采用t檢驗,不同時間點的比較采用重復測量方差分析;計數資料組間比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者不同時點APACHEⅡ評分與氧合指數的比較 兩組患者治療前APACHEⅡ評分與氧合指數差異均無統計學意義(均P>0.05)。治療后,兩組患者APACHEⅡ評分均有所升高,對照組治療后48、72h APACHEⅡ評分高于治療前(P<0.05),觀察組治療后72h APACHEⅡ評分高于治療前(P<0.05),而對照組氧合指數較治療前降低(P<0.05)。進一步進行組間比較顯示,觀察組治療后24、48、72h的APACHEⅡ評分均低于對照組(均P<0.05),氧合指數高于對照組患者(P<0.05)。詳見表2。

表2 兩組患者不同時點APACHEⅡ評分與氧合指數的比較
2.2 兩組患者不同時點TNF-α、SP-A水平與肺毛細血管通透性的比較 兩組患者治療前TNF-α、SP-A水平與肺毛細血管通透性差異均無統計學意義(均P>0.05)。治療后,兩組患者 EVLWI、PVPI、VEGF、CEC 和 TNF-α水平均較治療前升高,而SP-A水平較治療前降低(均P<0.05)。進一步組間比較顯示,治療后第72h觀察組患者 EVLWI、PVPI、VEGF、CEC 和 TNF-α 水平較對照組患者低,SP-A水平則較對照組患者高(均P<0.05)。詳見表3。
2.3 兩組患者通氣時間與7d、28d存活率的比較 治療后,觀察組患者機械通氣時間顯著短于對照組患者(P<0.01),7d和28d存活率高于對照組患者(均P<0.05),詳見表4。
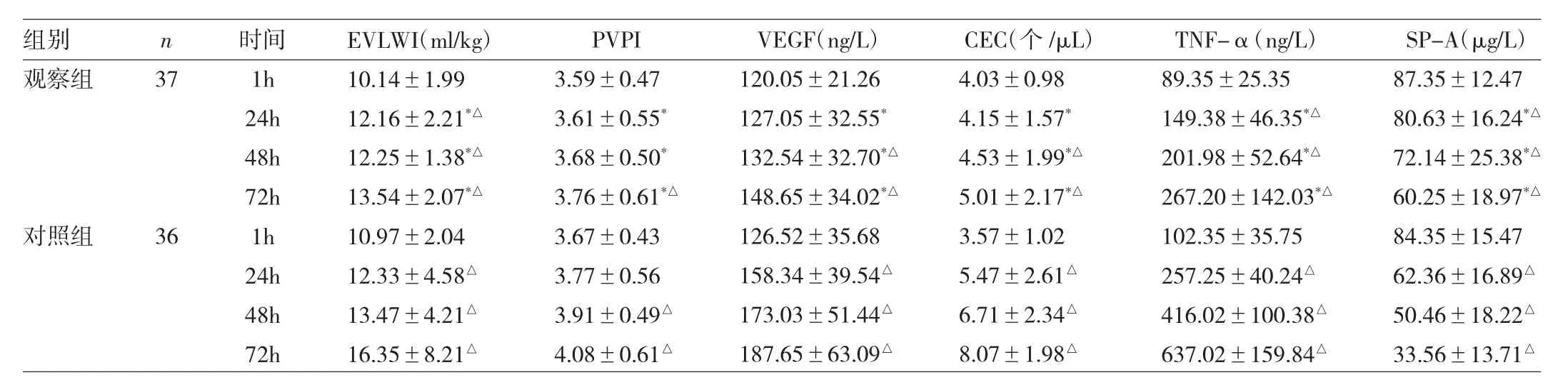
表3 兩組患者不同時點TNF-α、SP-A水平與肺毛細血管通透性的比較

表4 兩組患者通氣時間與7d、28d存活率的比較
3 討論
ARDS是ICU患者死亡的重要原因之一[8],可由重癥肺炎、膿毒癥、創傷等引起,并迅速進展為以低氧血癥為特征的呼吸困難。老年ARDS患者各項身體功能退化,免疫功能下降,并常伴有高血壓、糖尿病等慢性疾病,顯著增加救治難度。國內外相關研究普遍認為,患者肺內促炎-抗炎介質的失衡是發生肺泡-肺毛細血管通透性增加的關鍵環節,最終導致ARDS的發生、發展[9]。通過降低患者肺泡-肺毛細血管通透性達到改善ARDS早期頑固性低氧血癥的目的,是ARDS治療的研究熱點[10]。
使用PiCCO技術對患者EVLWI與PVPI水平進行監測,是目前臨床上用于評價ARDS非心源性肺水腫程度的常用手段。有學者研究認為,EVLWI水平在ARDS患者診斷和預測預后中有指導價值,PVPI水平可對肺水腫的類型與程度進行鑒別[11]。本研究中觀察組患者接受亞低溫治療后,雖然EVLWI與PVPI水平較治療后第1h有所升高,但從第24h開始,兩項指標均低于未進行治療的對照組患者,提示硝酸甘油聯合亞低溫治療能夠減輕ARDS患者的肺水腫程度,可能與抑制肺泡-肺毛細血管通透性的增加有關。
有報道發現血漿VEGF水平在多種因素所致的急性肺損傷模型中均有上升,且與損傷程度呈正相關性[12]。還有學者研究證實肺泡上皮細胞襯液中VEGF水平在急性肺損傷(ALI)患者早期顯著下降,程度與肺損傷評分呈負相關,并在疾病恢復期緩慢上升[13],這可能與ALI患者早期肺泡-肺毛細血管通透性增加,肺泡上皮細胞襯液中VEGF通過其進行外周血液循環有關。而在本研究中,兩組患者VEGF水平均隨病情發展逐漸升高,且與EVLWI、PVPI水平的變化趨勢一致,提示外周血VEGF水平升高與肺泡-肺毛細血管通透性增加相關。而觀察組患者進行硝酸甘油聯合亞低溫治療后,EVLWI、PVPI、VEGF水平均低于對照組患者,與硝酸甘油降低肺泡-肺毛細血管通透性有關。作為毛細血管通透性評價指標的CEC在觀察組患者中更少[14],也與上述觀點相符。分析其具體機制,可能有以下幾點:(1)硝酸甘油通過合成一氧化氮松弛血管平滑肌,減少白細胞與血小板黏附,減輕組織水腫并降低微循環通透性[15];(2)亞低溫環境直接對VEGF的表達產生抑制作用[16];(3)亞低溫環境能夠抑制VEGF與血管內皮細胞上的受體結合;(4)VEGF功能在亞低溫環境中被抑制,減少中性粒細胞的聚集和其它炎性介質(TNF-α等)的釋放,進一步抑制VEGF的表達,產生良性循環并最終對血管內皮細胞起保護作用。
由細支氣管非纖毛上皮細胞和Ⅱ型肺泡上皮細胞分泌的SP-A的生理功能主要是維持上皮細胞和肺泡的完整性形態[17],此外,其還在調節炎癥反應和免疫功能中發揮生物學作用[18],因此,測定SP-A水平的變化在ARDS的發展過程中有重要臨床意義。本研究顯示,SPA水平隨ARDS的發展而降低,提示Ⅱ型肺泡上皮細胞在ARDS的發生、發展過程中損傷加重。國外有研究發現,ARDS患者的Ⅱ型肺泡上皮細胞受損程度與TNF-α水平呈負相關[19],這與本研究結果相符。
大量研究表明,APACHEⅡ評分和氧合指數可作為評價ARDS患者預后的重要指標[20],在此不做贅述。而本研究中兩組患者TNF-α、SP-A水平與肺毛細血管通透性的變化與APACHEⅡ評分和氧合指數的變化趨勢一致,再次證實肺泡-肺毛細血管通透性增加是ARDS發展的重要病理生理環節,也提示全身性亞低溫狀態能夠通過減少毛細血管通透性而縮短患者的機械通氣時間,降低7d病死率,這可能與亞低溫狀態在降低老年ARDS患者機體氧耗的同時,還能減少中性粒細胞的浸潤、細胞因子和氧自由基的釋放,抑制細胞凋亡有關[21]。
綜上所述,老年ARDS患者接受常規對癥和支持治療的基礎上,應用亞低溫治療作為輔助治療手段,可改善患者早期肺氧合功能,降低肺血管通透性,減少炎癥因子釋放,縮短患者機械通氣時間,并降低短期病死率。
[1] Repessé X,Charron C,Vieillard-Baron A.Acute Cor Pulmonale in ARDS:Rationale for Protecting the Right Ventricle[J] .Chest,2015,147(1):259-265.doi:org/10.1378/chest.14-0877.
[2] 田瑞兆,張麗.PiCCO指導下液體復蘇在ARDS合并感染性休克老年患者EGDT中的意義[J] .甘肅醫藥,2015,3(8):561-563.
[3] Forel JM,Guervilly C,Hraiech S,et al.Type III procollagen is a reliable marker of ARDS-associated lung fibroproliferation[J] .Intensive Care Medicine,2015,41(1):1-11.doi:org/10.1007/s00134-014-3524-0.
[4] 申美榮.亞低溫對油酸型ARDS大鼠Clara細胞分泌蛋白16、肺表面活性蛋白A含量的影響[D] .桂林醫學院,2015:5-6.
[5] Liu LP,Li B,Zhu L,et al.Clinical efficacy of nitroglycerin in patients with septic shock with ARDS[J] .Medical Journal of Chinese Peoples Liberation Army,2015,40(8):647-651.doi:10.11855/j.issn.0577-7402.2015.08.09.
[6] The ARDS Definition Task Force.Acute respiratory distress syndrome:theBerlinDefinition[J] .JAMA,2012,307(23):2526-2533.doi:org/10.1001/jama.2012.5669
[7] 劉大為.實用重癥醫學[M] .北京:人民衛生出版社,2010:496-509.
[8] Geboers DGPJ,Beer FMD,Boer TD,et al.Plasma suPAR as a prognostic biological marker for ICU mortality in ARDS patients[J] .Intensive Care Medicine,2015,41(7):1281-1290.doi:org/10.1007/s00134-015-3924-9.
[9] Calfee CS,Janz DR,Bernard GR,et al.Distinct Molecular Phenotypes of Direct Versus Indirect ARDS in Single and Multi-Center Studies[J] .Chest,2015,147(6):1539-1548.doi:org/10.1378/chest.14-2454.
[10] Dancer RC,Parekh D,Lax S,et al.Vitamin D deficiency contributes directly to the acute respiratory distress syndrome(ARDS)[J] .Thorax,2015,70(7):617-624.doi:10.1136/thoraxjnl-2014-206680.
[11] Saito N,Yagi T,Hara Y,et al.Implementation of an optimal fluid management protocol using the PiCCO system delays development of ARDS secondary to severe sepsis[J] .Critical Care,2012,16(1):1-189.
[12] Wen J,Wang X,Pei H,et al.Anti-psoriatic effects of Honokiol through the inhibition of NF-κB and VEGFR-2 in animal model of K14-VEGF transgenic mouse[J] .Journal of Pharmacological Sciences,2015,128(3):116.doi:10.1016/j.jphs.2015.05.008.
[13] Birgani S A,Mailander M,Wasle I,et al.Efficient therapy of ischaemic lesions with VEGF121-fibrin in an animal model of systemic sclerosis[J] .Annals of the Rheumatic Diseases,2016,75(7):1399-1406.doi:10.1136/annrheumdis-2015-207548.
[14] 瞿長春,賴添順.肺內型與肺外型急性呼吸窘迫綜合征患者血管內皮細胞損傷的比較研究[J] .實用醫學雜志,2009,25(16):2668-2670.10.3969/j.issn.1006-5725.2009.16.024.
[15] Papazian L,Calfee CS,Chiumello D,et al.Diagnostic workup for ARDS patients[J] .Intensive Care Medicine,2016,42(5):674.doi:10.1007/s00134-016-4324-5.
[16] 胡軍濤,潘熠平,陳顯峰,等.亞低溫對急性呼吸窘迫綜合征患者肺血管通透性的影響[J] .中華危重病急救醫學,2016,28(9):775-779.doi:10.3760/cma.j.issn.2095-4352.2016.09.002.
[17] 王杰,牟界,張文斌,等.利拉魯肽對LPS誘導的小鼠肺泡上皮細胞SP-A表達的調控機制研究[J] .西部醫學,2015,27(7):981-985.doi:10.3969/j.issn.1672-3511.2015.07.007
[18] Minutti CM,García-Fojeda B,Sáenz A,et al.Surfactant Protein A Prevents IFN-γ/IFN-γ Receptor Interaction and Attenuates Classical Activation of Human Alveolar Macrophages[J] .Journal of Immunology,2016,197(2):32-42.doi:10.4049/jimmunol.1501032.
[19] Stromps JP,Fuchs P,Demir E,et al.Intraalveolar TNF-β in combined burn and inhalation injury compared with intraalveolar interleukin-6[J] .Journalof Burn Care&Research OfficialPublication of the American Burn Association,2015,36(2):55.10.1097/BCR.0000000000000108.
[20] HajimahmoodiM,Mojtahedzadeh M,GhaffarnatanziN,et al.Effects of vitamin E administration on APACHE II score in ARDS patients[J] .Daru Journal of Pharmaceutical Sciences,2009,17(1):24-28.
[21] Duan M,Berra L,Kumar A,et al.Use of Hypothermia to Allow Low-Tidal-Volume Ventilation in a Patient With ARDS[J] .Respiratory Care,2011,56(12):1956-1958.doi:10.4187/respcare.01211.

