TGF-β1、VEGF在哮喘小鼠的表達及細辛腦的干預作用
鄧鵬輝 黃傳君 趙方正 宮曉丹 李春曉 張才擎
支氣管哮喘(哮喘)是以反復發作的呼氣性呼吸困難和可逆性氣流受限為特點的慢性炎癥性疾病,其病理特征為氣道慢性炎癥、氣道高反應和氣道重塑。有報道,氣道重塑在哮喘早期就已出現并呈現進行性發展,致使患者肺功能降低,嚴重影響患者日常生活,同時氣道重塑降低了哮喘患者對腎上腺皮質激素(激素)的敏感性,這也是哮喘遷延難愈的原因之一[1]。目前能夠對抗和緩解哮喘氣道重塑的藥物較少。迄今為止,多項研究表明轉化生長因子-β1(TGF-β1)、血管內皮生長因子(VEGF)參與哮喘早期氣道重塑過程,同時兩者也參與炎癥反應的調節并且相互促進,更進一步地刺激氣道重塑的形成[2-3]。細辛腦是從傳統中藥石菖蒲中提取的有效成分,目前在臨床的哮喘治療方面應用比較廣泛[4]。細辛腦具有緩解患者臨床癥狀,改善肺部通氣功能,促進痰液排出,減輕氣道黏膜充血水腫并保護氣道黏膜等作用,但是其具體作用途徑的探索國內外均少有涉及。所以,本研究目的在于通過制備哮喘模型小鼠,并給予細辛腦干預以探討細辛腦是否能夠影響TGF-β1和VEGF的水平而起到治療哮喘作用,為臨床用藥提供基礎理論依據。
材料與方法
一、實驗動物
BALB/C雌性小鼠30只,6~8周齡,體質量15~20 g,購于山東大學動物實驗中心,于室溫20~22℃條件下飼養,自由進食及飲水。
二、主要試劑
細辛腦霧化液由遼寧玉皇藥業有限公司提供,規格為10 ml∶24 mg、雞清卵蛋白(OVA),購于美國Sigma公司; 980超聲霧化儀由上海新天緣醫療設備有限公司提供;TGF-β1、VEGF ELISA試劑盒均購自上海心語生物科技有限公司;TGF-β1抗體、VEGF抗體購自美國Abcam公司。
三、方 法
1.動物分組及哮喘模型的制備
將上述30只小鼠按照隨機數字表法分為3組:哮喘組、細辛腦組和對照組,每組各10只小鼠。哮喘組和細辛腦組每只小鼠分別在第1、8日腹腔注射OVA致敏混懸液(0.1 mg OVA加1 mg氫氧化鋁溶于2 ml生理鹽水)0.5 ml,對照組每只小鼠給予注射含有氫氧化鋁凝膠的生理鹽水0.5 ml。第15日起,將哮喘組和細辛腦組的小鼠置于自制箱中(30 cm×25 cm×30 cm)霧化吸入2 ml 25%OVA溶液,每日1次,連續1周,對照組給予等量(2 ml)生理鹽水代替。細辛腦組分別在霧化OVA溶液2 h前霧化吸入50%細辛腦霧化液10 ml[5],霧化40 min。對照組在此同時給予等量生理鹽水霧化吸入[6]。
2.標本的采集
第21日最后1次完成致敏后,用10%水合氯醛麻醉小鼠后,將小鼠固定在解剖臺上,解剖胸頸部組織,暴露氣管并連接留置針,緩慢地將生理鹽水注入兩肺,回收灌洗液,置于冰上保存,隨后以4 ℃、1 500 轉/分離心5 min,收集上清液。取出支氣管和肺組織,置于4%多聚甲醛中固定,用于制片后蘇木素-伊紅(HE)染色和圖像采集。
3.細胞計數
肺泡灌洗液(BALF)離心后,取上清液并存于-80℃冰箱,ELISA檢測備用;將沉淀物制作涂片染色,在顯微鏡下觀察細胞形態并進行細胞計數和分類,排除上皮細胞及紅細胞,記錄細胞總數和中性粒細胞、嗜酸性粒細胞(EOS)、巨噬細胞和淋巴細胞分類情況。
4.肺臟組織HE染色和圖像的采集
取各組小鼠4%多聚甲醛固定的肺組織,常規脫水、包埋及石蠟切片,經染色、脫水、中性樹膠封片,然后于顯微鏡下觀察各組小鼠氣道管壁損傷程度、炎癥細胞的浸潤情況和基底膜厚度。
5.肺泡灌洗液中TGF-β1和VEGF的測定
使用ELISA測定肺泡灌洗液中TGF-β1和VEGF的含量,嚴格按各試劑盒說明書操作,測出各個樣本指標的OD值,再根據所測的OD值換算各自水平。
四、統計學處理
結 果
一、 制模結果
激發致敏后,哮喘組小鼠毛發干枯無澤,煩躁不安,有氣促、憋喘癥狀,飲食差,體質量下降;細辛腦組小鼠生命體征平穩,毛發欠光澤,活動輕度受限,未見明顯氣促、憋喘癥狀,飲食一般,體質量無明顯變化;對照組上述指標無明顯變化。
二、 3組小鼠的肺組織病理檢查結果
對照組小鼠支氣管黏膜下及管腔周圍無炎性細胞浸潤,管腔規則完整,肺泡結構完整清晰,基底膜無增厚、斷裂情況,無新生血管形成。哮喘組小鼠支氣管管腔狹窄,管壁增厚,黏膜充血、水腫,伴有炎癥細胞浸潤,基底膜增厚不規則,有新生血管形成。細辛腦組小鼠也有前述哮喘組的病理特點,但程度輕于較哮喘組,見圖1。
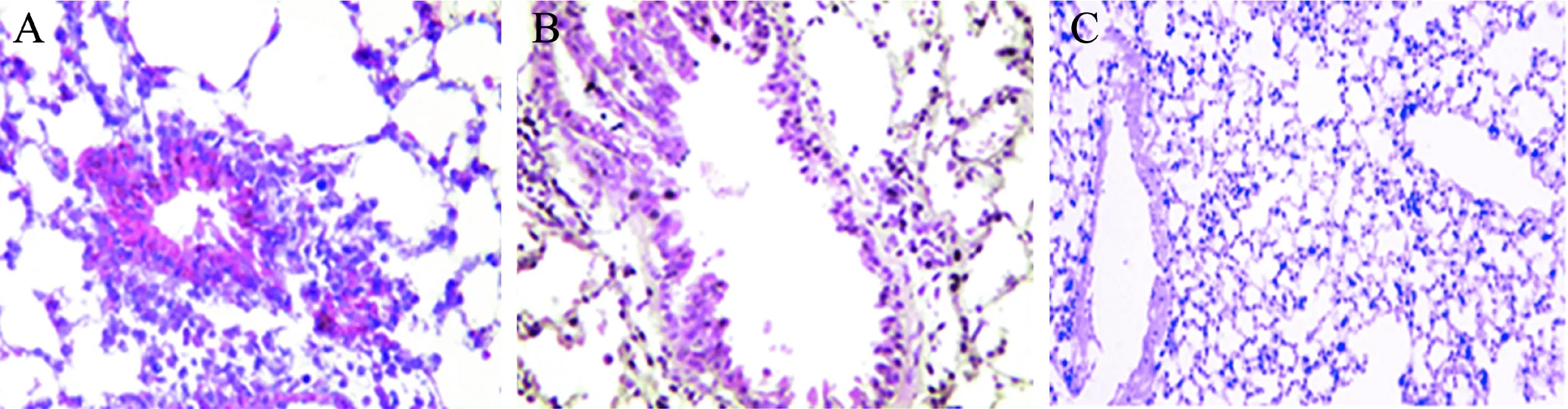
圖1 3組小鼠的肺組織病理檢查結果(HE染色,×200)
A:哮喘組;B:細辛腦組;C:對照組
三、3組小鼠BALF中TGF-β1和VEGF水平比較
哮喘組小鼠BALF中TGF-β1和VEGF水平均高于對照組(P均<0.01),細辛腦組小鼠BALF中TGF-β1和VEGF水平均低于哮喘組(P均<0.01),見表1。
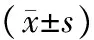
表1 3組小鼠BALF中TGF-β1和VEGF水平比較 ng/L
注:與對照組比較,aP<0.01;與哮喘組比較,bP<0.01
四、3組小鼠BALF中細胞總數及分類情況比較
哮喘組的細胞總數及各類細胞計數均多于細辛腦組和對照組(P均<0.01),細辛腦組的中性粒細胞、EOS計數均多于對照組(P均<0.01),見表2。
討 論
哮喘是一種可逆性氣流受限的慢性炎癥性疾病,由多種炎癥細胞及細胞組分參與并分泌異常炎性因子。在哮喘發生、發展過程中,其病理特征除了表現為氣道慢性炎癥、氣道高反應之外,同時伴隨有氣道管壁結構的變化,即氣道重塑。氣道重塑是哮喘病理發展的典型特征之一[7]。哮喘的反復發作以及伴隨的反復慢性炎癥刺激,逐步使氣道管壁發生病理學改變,如上皮細胞增生、膠原沉積、基底膜增厚、氣道平滑肌細胞以及血管增生等氣道重塑性改變[8]。既往研究認為,細胞網絡因子失衡是哮喘發生的重要節點[9-11]。有研究顯示,TGF-β1及VEGF在氣道重塑方面占據重要地位,對炎癥反應的調節也有相應的影響[2-3]。本研究也得到類似的結論。
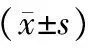
表2 3組小鼠BALF中細胞總數及分類情況 ×104/L
注:與對照組比較,aP<0.01;與哮喘組比較,bP<0.01
TGF-β1是輔助性T細胞2型(Th2)細胞分泌的細胞因子,具有很強的致纖維化、抗炎及促炎的三重作用,還可調節細胞的生長和分化,其在肝、肺、腎等臟器的纖維化病理過程中扮演著重要角色[12]。在哮喘發病過程中,TGF-β1可一定程度地抑制炎性細胞的活化及氣道高反應,但是隨著其水平的升高,可引起管壁的纖維化,刺激平滑肌細胞分裂和增殖,氣道平滑肌增生肥厚,最終導致氣道炎癥反應加重和氣道重塑[13]。另外,TGF-β1使Th2型細胞壽命延長,刺激VEGF等相關炎癥因子釋放過多,進一步加重炎癥反應,進而促進氣道重塑的發生[14]。VEGF又稱血管滲透因子,能夠刺激血管增生,增加肺部血管的通透性,致使血漿蛋白滲出,進一步導致基底膜變厚和上皮下組織纖維化,并且促進氣道平滑肌增殖肥大,加重氣道重塑[15-16]。此外,VEGF對哮喘的炎癥反應亦有影響。Feistritzer等(2004年)研究發現,VEGF能夠刺激EOS的活化、趨化而增加氣道炎癥反應,VEGF亦可自身分泌VEGF而加重炎癥反應。Lopoz-Guisa 等[17]研究發現,TGF-β和VEGF 在哮喘兒童氣道上皮細胞中增高明顯,體外實驗中TGF-β可誘導VEGF mRNA表達,而又有文獻報道VEGF能夠活化Th2型細胞,介導其釋放TGF-β1,從而使哮喘病情進一步加重[3]。可見TGF-β1、VEGF兩者在功能上相互促進,使炎癥反應和氣道重塑不斷地強化,這可能是哮喘反復發作、持久不愈的原因。 細辛腦是中藥石菖蒲中提煉出來的有效成分之一,在臨床上用于神經系統疾病的治療,也多與其他藥物聯合運用治療哮喘,但其作用機制還不清楚。TGF-β1、VEGF在哮喘發病和氣道重塑中起著重要作用,因此,我們推測細辛腦可能通過干預兩者的表達而影響哮喘的氣道重塑,達到臨床治療的目的。
多數學者的研究已表明,TGF-β1 和VEGF參與了哮喘氣道重塑。本研究中,哮喘組小鼠肺泡灌洗液TGF-β1和VEGF的水平均高于對照組,這與Lopoz-Guisa等[17]研究結果類似,同時HE 染色顯示哮喘組小鼠有明顯的氣道結構改變,細辛腦組氣道結構的變化較對照組有明顯好轉,TGF-β1和VEGF水平均低于哮喘組,表明細辛腦干預可下調TGF-β1、VEGF水平和抑制炎性細胞浸潤,進而可能在一定程度上抑制了氣道重塑,緩解了哮喘病情進展,為臨床用藥和其治療作用機制的研究提供了理論依據。
綜上所述,細辛腦干預能夠降低哮喘小鼠TGF-β1和VEGF的表達,并可能通過降低兩者的表達間接影響哮喘的氣道重塑,從而達到治療哮喘的效果。但是鑒于研究條件的局限性,本研究還存在很多不足之處,如TGF-β1、VEGF的表達對氣道重塑情況的影響以及細辛腦干預后氣道重塑的具體病理改變在本研究尚未涉及和探索,研究結果尚待進一步的研究和驗證。
[1] da Silva AL, Martini SV, Abreu SC, Samary Cdos S, Diaz BL, Fernezlian S, de Sá VK, Capelozzi VL, Boylan NJ, Goya RG, Suk JS, Rocco PR, Hanes J, Morales MM. DNA nanoparticle-mediated thymulin gene therapy prevents airway remodeling in experimental allergic asthma.J Control Release,2014,180:125-133.
[2] Itoigawa Y, Harada N, Harada S, Katsura Y, Makino F, Ito J, Nurwidya F, Kato M, Takahashi F, Atsuta R, Takahashi K. TWEAK enhances TGF-β-induced epithelial-mesenchymal transition in human bronchial epithelial cells. Respir Res,2015,16:48.
[3] Shifren A, Witt C, Christie C, Castro M. Mechanisms of remodeling in asthmatic airways.J Allergy (Cairo),2012,2012:316049.
[4] 劉硯韜,張伶俐,黃亮,曾力楠. 細辛腦注射液治療兒童呼吸系統疾病的有效性及安全性的系統評價.中華婦幼臨床醫學雜志,2015,11(6):689-697.
[5] 黃傳君,張永蓮,丁雁啟, 鄧鵬輝,趙方正,李文文,張才擎.細辛腦聯合布地奈德干預哮喘小鼠氣道重塑以及炎癥因子的表達.中華臨床醫師雜志,2017,11(9):1540-1544.
[6] 李鴻佳,張才擎,于翠香,劉粉,蓋慶玲,吳金香,趙繼平,董亮.Th17淋巴細胞及相關細胞因子加重哮喘小鼠氣道炎癥.細胞與分子免疫學雜志, 2012, 28(11):1126-1128.
[7] Jang AS, Kwon HS, Cho YS, Bae YJ, Kim TB, Park JS, Park SW, Uh ST, Choi JS, Kim YH, Hwang HK, Moon HB, Park CS.Identification of subtypes of refractory asthma in Korean patients by cluster analysis.Lung,2013,191(1):87-93.
[8] 蔡亮鳴,王昭妮,陳壯桂.間充質干細胞對重癥支氣管哮喘治療作用的研究進展.新醫學,2017, 48 (5),285-292.
[9] Asher MI.Recent perspectives on global epidemiology of asthma in childhood.Allergol Immunopathol (Madr),2010,38(2):83-87.
[10] Meyer N, Akdis CA.Vascular endothelial growth factor as a key inducer of angiogenesis in the asthmatic airways.Curr Allergy Asthma Rep,2013,13(1):1-9.
[11] Gao YD, Cao J, Li P, Huang G, Yang J.Th2 cytokine-primed airway smooth muscle cells induce mast cell chemotaxis via secretion of ATP.J Asthma,2014,51(10):997-1003.
[12] Koczy-Baron E, Kasperska-Zaj?c A. The role of vascular endothelial growth factor in inflammatory processes.Postepy Hig Med Dosw (Online),2014,68:57-65.
[13] Yamada Y, Mashima H, Sakai T, Matsuhashi T, Jin M, Ohnishi H.Functional roles of TGF-β1 in intestinal epithelial cells through Smad-dependent and non-Smad pathways.Dig Dis Sci,2013,58(5):1207-1217.
[14] Yang YC, Zhang N, Van Crombruggen K, Hu GH, Hong SL, Bachert C. Transforming growth factor-beta1 in inflammatory airway disease: a key for understanding inflammation and remodeling. Allergy,2012,67(10):1193-1202.
[16] Smith R.Is VEGF a potential therapeutic target in asthma? Pneumologia,2014,63(4):194, 197-199.
[17] Lopez-Guisa JM, Powers C, File D, Cochrane E, Jimenez N, Debley JS.Airway epithelial cells from asthmatic children differentially express proremodeling factors.J Allergy Clin Immunol,2012,129(4):990-997.

