基于磁共振成像的膀胱腫瘤自動檢測系統的開發*
邵 希 石宇強△ 劉 巖 徐肖攀 劉 洋 張 曦*
膀胱腫瘤是泌尿系統最常見的腫瘤之一,根據美國癌癥協會發布的“Cancer Facts and Figures 2016”[1]數據顯示,美國男性中膀胱腫瘤的發病率位居第4位,致死率居第8位;而中國男性中,膀胱腫瘤的發病率居惡性腫瘤第7位,且近年來呈逐年上升趨勢[2]。
膀胱腫瘤多發于老年男性且極易復發,對于非肌層浸潤性膀胱腫瘤,其5年生存率可達到96%,但約有50%~70%的患者在術后18個月內會復發[3-4];對于肌層浸潤性腫瘤,其5年生存率更低,且復發率更高[5]。隨著社會人口老齡化加劇,膀胱腫瘤患者將逐年增多而需要定期篩查或復查,但費用巨大且嚴重影響患者的生存質量。
目前,光學膀胱鏡(optical cystoscopy,OCy)與經尿道切除(transurethral resection,TUR)術相結合是膀胱癌檢測和診斷的金標準[5]。然而,OCy檢查不僅無法直接獲得腫瘤的浸潤深度(腫瘤分期),存在視野盲區且該手段為有創,可能引起患者不適,并伴有機械損傷風險[6]。因此,臨床上迫切需要一種無創及高效的檢測手段,對膀胱腫瘤進行檢測和診斷。
近年來,基于磁共振(magnetic resonance,MR)的影像學檢查是膀胱腫瘤的重要篩查手段,而且是一種非侵入式的檢查方式,避免了CT成像中X射線輻射的缺陷,能提供清晰的人體軟組織結構信息和豐富的人體功能信息。與醫生通過OCy主觀判斷有無膀胱腫瘤相比,MR影像客觀性較強,可挖掘各類定量的影像信息用于膀胱腫瘤檢測。因此,本研究擬基于磁共振成像(magnetic resonance imaging,MRI),用自適應形狀先驗約束的水平集(adaptive shape prior constrained level sets,ASPCLS)方法,拉普拉斯偏微分方程(Laplace partial differential equation)計算三維(three dimensional,3D)膀胱壁厚度,基于空域信息的模糊C均值(fuzzy C-means with spatial information,sFCM)算法提取腫瘤疑似區等,初步建立基于MRI的膀胱腫瘤自動檢測系統,從而實現膀胱腫瘤的自動提取,為膀胱腫瘤的進一步診斷和治療提供依據。
1 材料與方法
1.1 影像數據采集
本研究采用MRI T2加權成像序列進行膀胱腫瘤患者的影像數據采集。
(1)T2加權序列中,尿液作為天然的內源性對比劑,使其與膀胱壁以及周邊組織有更好的對比度,從而使膀胱內外壁分割得更為準確。
(2)腫瘤的信號強度通常比膀胱壁略高,這使得腫瘤區域在影像中對比顯著[7]。采用虛擬膀胱鏡檢測時,為了準確判斷病灶,膀胱需處于充盈狀態。①在核磁共振掃描前,受試者需飲用>600 ml的水,在有尿感后10~15 min內,進行掃描;②為了盡量減少腸道蠕動造成的偽影和對膀胱壁的擠壓而引起的形變,要求所有被試者提前做好腸道準備;③為了減少掃描中因人體呼吸而產生呼吸偽影,掃描時需在腹部捆綁腹帶。整個掃描過程持續約6~8 min,所有MRI數據經GE Discorvery750 3.0T掃描儀采集完成,掃描參數見表1。
1.2 膀胱內外壁的分割
獲取膀胱內外壁信息是提取膀胱腫瘤疑似區域的先決條件,對于擬建立的檢測系統的功能實現至關重要。目前,醫學影像領域常用的分割算法可分為基于區域和基于輪廓兩類:基于區域的分割算法在分割MRI圖像時,因較強的噪聲,部分容積效應和灰度非均勻性等影響,分割效果往往不能滿足要求;而基于輪廓的水平集方法[8-10]結果較為理想,目前已被廣泛地使用。2014年Qin等[9]提出了一種基于T2WI序列的ASPCLS。為了增強模型的分割準確性和魯棒性,該方法將初始約束,如梯度信息、區域性信息、最小壁厚等引入到模型中(該方法被用作本研究的分割方法)。
1.3 膀胱壁3D厚度的計算
膀胱壁厚度是區分膀胱壁是否存在病變的重要指標,因此在獲取了膀胱內外壁信息后,需要計算膀胱壁3D厚度[11]。拉普拉斯方程以勢函數的形式描述了電場、引力場和流場等物理對象的性質。拉普拉斯方程是一種二階偏微分方程,其計算為公式1:
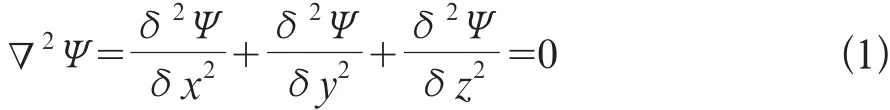
在等勢面、場線與厚度關系中,中間的虛線表示由拉普拉斯場所形成的等勢線,與虛線垂直的曲線表示場線。內壁上任意一點在外壁上必存在唯一點與之對應,而且對于內外邊界間的任意一點,其對應的厚度值為所在場線的長度(如圖1所示)。

圖1 等勢面、場線與厚度關系示意圖

表1 T2加權影像序列具體掃描參數
1.4 疑似腫瘤區的提取
模糊C均值(fzuuy C-mrans,FCM)算法是一種無監督聚類算法,也是圖像領域一種常用的分割算法,其具有計算簡便,無需過多人工干預的優點,但對噪聲較為敏感。而MRI圖像常受圖像噪聲、部分容積效應、灰度非均勻性等的影響,導致傳統的FCM算法無法有效地提取腫瘤區域。因此,本研究采用sFCM算法對疑似腫瘤區域進行分割,從而更準確地提取腫瘤區域。該方法基于傳統的FCM算法,將鄰域的統計信息作為權重項引入到隸屬度函數中,使分割時體素的隸屬度受周邊體素的影響,從而令分割結果更為平滑,對噪聲和灰度非均勻性更為魯棒。
1.5 系統功能步驟與硬件環境
MRI膀胱腫瘤自動檢測系統分為4個主要操作步驟:①讀取T2W1的MRI影像;②進行膀胱內外壁的分割;③使用拉普拉斯偏微分方程進行膀胱壁3D厚度的計算;④利用改進的模糊C均值算法,提取整個疑似腫瘤區域。上述步驟的所有程序使用Matlab2012b編寫,采用的計算機為八核CPU,主頻為2.60 GHz,內存為4.00 GB。
1.6 系統準確性評價
本研究使用Dice重合比率(Dice’ similarity coefficient,DSC)作為指標來評價系統的準確性,其計算為公式2:

式中DSC表示重合比率,ΩAuto表示系統自動分割提取出的腫瘤區域,ΩMannually表示手動分割提取出的腫瘤區域。
2 結果
(1)利用已采集到的膀胱腫瘤患者T2加權影像數據,對已建立的疑似區域自動提取系統進行流程與性能測試。在讀取T2序列的MRI影像后的界面顯示效果中,內壁上的凸起部分為膀胱腫瘤(如圖2所示)。

圖2 讀取T2序列MRI影像后的界面圖
(2)在正確讀取圖像數據后,系統需完成內外壁的分割任務。進行內外壁手動和自動分割后的軟件界面如圖3和圖4所示,其中圖3顯示了系統對中間層進行手動分割的效果圖,圖4則是對其余層進行自動分割的效果圖,最終實現膀胱軸位像自頂向下的內外壁分割。

圖3 對中間層進行手動分割的界面圖

圖4 對其余層進行自動分割的界面圖
(3)系統自動分割出每例膀胱腫瘤患者的膀胱內外壁之后,還需對膀胱壁厚度進行自動計算。拉普拉斯方程計算某1例數據的膀胱壁厚度的結果,從中可以看到在腫瘤疑似區域像素對應的厚度明顯變厚。由于壁內每一體素都對應于所在場線的厚度值,為通過厚度的聚類來獲取腫瘤區域提供了依據(如圖5所示)。

圖5 3D膀胱壁厚度計算的界面圖
在1例膀胱腫瘤患者的數據中,基于分割后的圖像,使用sFCM算法進一步提取出腫瘤疑似區,如圖6所示。

圖6 膀胱腫瘤患者腫瘤疑似區提取結果影像
(4)通過sFCM方法提取出腫瘤疑似區之后的軟件界面顯示圖,從右下角的圖片中可以看出,白色區域即腫瘤疑似區(如圖7所示)。
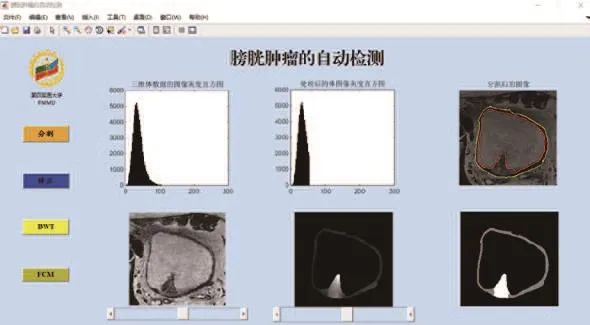
圖7 提取腫瘤疑似區后的界面圖
(5)根據建立的膀胱腫瘤自動檢測方法,利用10套膀胱癌患者T2加權影像序列數據進行初步驗證。將系統自動提取出的10套數據的膀胱腫瘤疑似區域與醫生手工勾畫的膀胱腫瘤疑似區域進行DSC系數比較,得到10套數據的平均DSC為86.7%,因而該系統對膀胱腫瘤疑似檢測和提取的準確性較高。
3 討論
為了克服OCy的有創性和無法判斷浸潤深度等缺點,以及更好對膀胱腫瘤進行無創篩查,本研究提出了一個基于MRI影像的膀胱腫瘤自動檢測系統,該軟件系統包含MRI數據的讀取、膀胱內外壁的分割、3D膀胱壁厚度計算和腫瘤區域的進一步提取4個步驟,自動實現了膀胱腫瘤疑似區域檢測,為疑似區和腫瘤性質的進一步分析和診斷提供了依據。本研究通過對多例膀胱腫瘤患者數據的測試與評估,保證了系統功能的可行性,且得到了較高的平均DSC,證實了該系統檢測膀胱腫瘤和提取腫瘤疑似區的準確性。
目前,該系統是基于影像的膀胱腫瘤檢測與分析研究領域的首個自動提取與檢測系統,為課題組下一步更好的開展基于多模態MRI虛擬膀胱鏡系統的研發奠定了良好的研究基礎與軟件基礎。然而,本系統也存在一定的局限性,僅著眼于提取出腫瘤疑似區,并未進一步判斷疑似區的性質、浸潤深度以及分期等特點。今后,可以基于本系統進一步判斷腫瘤疑似區的性質,判斷腫瘤分級和分期等性質[12]。此外,本系統僅使用了單模態的T2加權影像序列數據,未使用各類能夠提供更多反映病理生理及細胞層面信息的磁共振功能影像序列。
隨著醫學影像技術的不斷發展,未來課題組將獲得質量更好、模態更多的MR影像,通過自動檢測系統可以更為準確的分割出膀胱的內外壁,從而更為準確地提取出腫瘤疑似區,為臨床診斷和治療提供一種新型的無創且可靠的膀胱腫瘤檢測方法。
4 結語
本研究提出的基于T2加權MRI的膀胱腫瘤自動檢測系統,能夠初步實現膀胱腫瘤的檢測和疑似腫瘤區的提取,與真實膀胱腫瘤區域相比達到了較高的準確性,為膀胱腫瘤的早期檢測及術前診斷提供了無創新手段。
[1]American Cancer Society.Cancer Facts and Figures 2016[A].Atlanta:American Cancer Society,2016.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3]American Cancer Society.Cancer Facts & Figures 2014[A].Atlanta:American Cancer Society,2014.
[4]Grasso M.Bladder cancer:a major public health issue[J].European urology,2008,7(7):510-515.
[5]那彥群,葉章群,孫穎浩,等.中國泌尿外科疾病診斷治療指南(2014版)[M].北京:人民衛生出版社,2014.
[6]楊金玲,劉照旭.膀胱鏡檢查疼痛控制的研究現狀[J].解放軍護理雜志,2008,25(1):34-36.
[7]Hafeez S,Huddart R.Advances in bladder cancer imaging[J].BMC medicine,2013,11(1):104.
[8]Duan C,Liang Z,Bao S,et al.A coupled level set framework for bladder wall segmentation with application to MR cystography[J].IEEE Trans Med Imaging,2010,29(3):903-915.
[9]Qin X,Li X,Liu Y,et al.Adaptive shape prior constrained level sets for bladder MR image segmentation[J].Biomedical Health Informatics,2014,18(5):1707-1716.
[10]Han H,Li L,Duan C,et al.A unified EM approach to bladder wall segmentation with coupled level-set constraints[J].Medical Image Analysis,2013,17(8):1192-1205.
[11]Zhang X,Liu Y,Yang Z,et al.Quantitative Analysis of Bladder Wall Thickness for Magnetic Resonance Cystoscopy[J].IEEE Trans Biomed Eng,2015,62(10):2402-2409.
[12]Zhang X,Xu X,Tian Q,et al.Radiomics assessment of bladder cancer grade using texture features from diffusion-weighted imaging[J].Journal of Magnetic Resonance Imaging,2017,46(5):1281-1288.

