抗原致敏的DC-CTL細胞對肝癌干細胞殺傷作用的實驗研究
賈 碩,孫 艷,張穎宏,王宏竹,盛春華*
(1.解放軍第208醫院細胞治療中心,吉林 長春130062;2.中南大學湘雅二醫院,湖南 長沙410011;3.吉林大學第二醫院 腫瘤血液科,吉林 長春130000)
原發性肝癌是我國常見惡性腫瘤之一,發病率位居惡性腫瘤第四位,病死率居第二位,號稱“癌中之王”,具有發病隱匿、易轉移復發及預后差等特征[1]。研究證實,腫瘤的發生、發展、治療耐藥和容易復發轉移的根本原因在于患者體內存在腫瘤干細胞(Cancer stem cells,CSCs)[2]。腫瘤干細胞雖然數量很少,但很難殺滅,常規放化療只能去除腫瘤組織中大多數增殖細胞,不能去除腫瘤干細胞[3]。在殺滅大部分普通腫瘤細胞后(手術、放療、化療后),再予以腫瘤干細胞的靶向治療,將可能是腫瘤治療的新方案。肝癌手術后,殘存在血液、淋巴循環及組織中的肝癌干細胞是復發和轉移的根源[4]。CD133是目前比較明確的肝癌干細胞的表面標志[5],本研究篩選CD133+肝癌干細胞,以肝癌干細胞為靶點,體外誘導擴增DC和CTL細胞,研究肝癌干細胞抗原致敏的DC-CTL細胞對肝癌干細胞的殺傷作用,為肝癌干細胞的臨床靶向治療奠定實驗基礎。
1 材料與方法
1.1材料
GTT-551、DMEM細胞培養基、人AB血清(Gibco公司);細胞因子IL-2、IFN-γ、IL-1α、IL-4、GM-CSF、TNF-α(美國Peprotech公司);抗人CD3單克隆抗體、CD8單克隆抗體、小鼠抗人單克隆抗體CD133-PE(美國BD公司);ClinicMacs流式細胞儀(美國Beckman Coulter公司),酶標儀、全自動磁性細胞分選儀(德國Miltenyi公司)。
1.2肝癌干細胞的分選
明確診斷肝細胞性肝癌患者手術后取肝癌組織,用生理鹽水加入慶大霉素(100 u/ml)清洗,剪切組織塊,加入胰蛋白酶液置于37℃孵箱中消化,并間斷用攪拌棒攪拌,消化4小時,用200目濾篩過濾,重新制備成單細胞懸液,加生理鹽水離心800 rpm 10分鐘,2次,應用高糖DMEM培養基加8%人AB血清接種于6孔板中,密度2×106/ml。嚴格應用磁珠分選系統說明書進行細胞分選操作。制備肝癌單細胞懸液,與CD133抗體磁珠進行交聯后過分離柱進行分選,收集CD133+細胞,制備成肝癌干細胞單細胞懸液備用。
1.3流式細胞技術測定肝癌干細胞
取分選前的肝癌細胞懸液和分選后的CD133+細胞懸液,分別加入2 ml圓底離心管中,離心1 500 rpm,5 min,棄上清液。加入PBS 1 ml離心洗滌1次,棄上清。調整細胞濃度,加入Fc受體封閉劑,4℃避光反應10 min。離心,棄上清液。用PBS 1 ml洗滌1次,離心。分別加入CD133-PE抗體,將上述2份細胞放在冰盒里避光孵育30 min,用1 ml含體積分數10%胎牛血清PBS洗滌2次,應用流式細胞儀分析測定CD133+細胞。
1.4肝癌干細胞和肝癌細胞抗原的獲得
分別收集肝癌干細胞和肝癌細胞,用PBS調整密度為5×106/ml,細胞被反復凍融(-196℃度至37℃),循環4次。細胞裂解物經12 000 rpm離心5分鐘,取上清經濾器除菌后按Bradford蛋白濃度測定試劑盒說明書所示方法測量、計算抗原的蛋白濃度,分別分裝后-70℃凍存備用。
1.5分別培養肝癌干細胞和肝癌細胞抗原致敏的DC-CTL細胞
1.5.1外周血單個核細胞分別誘導擴增DC和CIK細胞:肝癌患者(與上文獲得肝癌干細胞為同一患者)手術1個月后,應用血液成分分離機進行單個核細胞單采,經Ficoll淋巴細胞分離液從單個核細胞分離淋巴細胞。用GTT-551培養基洗滌2次,用GTT-551培養基加入6%人AB血清混懸于培養瓶中,置37℃、5%CO2孵育箱中,2 h后將懸浮細胞移出進行CIK培養,貼壁細胞進行DC培養。
1.5.2肝癌干細胞和肝癌細胞抗原致敏的DC細胞培養:貼壁細胞加入IL-4(500 U/ml),GM-CSF(1 000 U/ml)培養,每隔2-3天換液1次,第6天分別加入肝癌干細胞和肝癌細胞抗原100 μg/ml,第7天加入TNF-α(500 U/ml)誘導DC成熟,第9天分別收獲成熟DC細胞。
1.5.3CIK細胞培養:懸浮淋巴細胞加入重組人IFN-r(1 000 U/ml)和10%AB型人血清的GTT-551培養液,24 h后更換成含100 ng/ml小鼠抗人CD3單克隆抗體、IL-1α(1 000 U/ml)和 IL-2(500 U/ml)的完全培養液繼續培養,2天后換含IL-2(500 U/ml)的完全培養液隔日換液維持培養9天。
1.5.4分選CTL細胞 參照ClincMacs使用說明,加入CD3、CD8抗體磁珠,應用CliniMacs流式細胞儀從誘導擴增的CIK細胞中分選出CD3+CD8+T淋巴細胞。
1.5.5抗原致敏后的DC與CTL細胞共培養,獲得DC-CTL細胞:細胞培養第9天,分別取肝癌干細胞和肝癌細胞抗原致敏后的DC細胞,經活細胞計數后,按1∶5比例分別與CD3+CD8+T細胞混合培養,每2天加入IL-2(500 U/ml)半量換液,5天后收集,獲得分別CTL細胞。細胞質量控制標準:細胞存活率≥95%,不含細菌、病毒和內毒素等微生物。
1.6MTT法檢測不同抗原致敏的DC-CTL對肝癌干細胞的殺傷作用
取狀態良好的肝癌干細胞,調整細胞密度分別為5 ×104/mL,接種于96 孔板,100 μL/孔,置于37℃、5% CO2孵育箱中培養過夜至靶細胞貼壁。分別取肝癌干細胞抗原致敏的DC-CTL細胞(實驗組)、肝癌細胞抗原致敏的DC-CTL細胞(陽性對照組)和無抗原致敏的DC-CTL細胞(空白對照組),按照效靶比5∶1、10∶1 和20∶1 的細胞比例接種于鋪有靶細胞的96 孔板,100 μL/孔,每組設10 個平行復孔,培養24 h。然后每孔加入MTT( 5 mg /mL) 10 μL,繼續培養4 h,離心去上清,每孔加入200 μL DMSO,震蕩10 min,用酶標儀在檢測波長490 nm 測定吸光度( A) 值,每組取5 個平行復孔計算平均A值,按公式計算殺傷率。殺傷率= [1-(A實驗組-A效應細胞對照組) /( A靶細胞對照組-A空白組) ]× 100%。
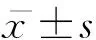
2 結果
2.1流式細胞技術測定肝癌干細胞
CD133表達達到98.4%,說明分選成功,得到的細胞基本為具有CD133+標志的肝癌干細胞,結果見圖1。
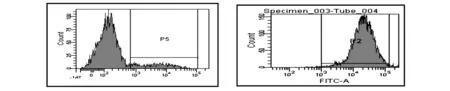
注:左圖顯示分選前,CD133表達率為3.8%;右圖顯示分選后,CD133表達率為98.4%。
2.2抗原致敏DC細胞培養
DC細胞培養至第9天在顯微鏡下觀察,DC細胞呈圓形,貼壁生長,表面有樹突狀突起。應用流式細胞技術測定DC細胞表面標志,說明為成熟DC,見圖2。

注:成熟DC細胞表面標志HLA-DR+表達率為85%,CD80+表達率為72%, CD83+表達率為45.2%,CD86+表達率為95.1%。
2.3CIK(cytokine-inducedkillercells)細胞培養
流式細胞術測定細胞誘導擴增前CD3+CD8+細胞含量約為48%,見圖3;細胞誘導擴增9天,CIK細胞中CD3+CD8+含量約達90%,見圖4。并且細胞總數量隨誘導時間大幅擴增,第9天擴增100余倍,見表1。

注:輔助性T細胞(CD3+CD4+,Th)表達率為39%,殺傷性T細胞(CD3+CD8+,CTL)表達率為48%。

注:輔助性T細胞(CD3+CD4+,Th)表達率為7%,殺傷性T細胞(CD3+CD8+,CTL)表達率為90%,自然殺傷性T細胞(CD3+CD56+,NKT)表達率為30%。

圖4 細胞誘導擴增后
2.4MTT實驗結果
實驗組(肝癌干細胞抗原致敏組)與陽性對照組(肝癌細胞抗原致敏組)及空白對照組(無抗原致敏組)相比,效應細胞對肝癌干細胞的殺傷作用均具有極顯著性差異;且隨不同效靶比效應細胞的增加,其殺傷作用顯著增強(見表2)。說明肝癌干細胞抗原致敏的DC-CTL細胞對肝癌干細胞具有極強的殺傷作用,且此殺傷作用隨效應細胞數量的增加而增強。

表2 抗原致敏的DC-CTL殺傷肝癌干細胞作用效應
3 討論
我國是肝癌高發區,肝癌患者生存期短,死亡率高,即使預后較好的小肝癌,術后也有超過70%的患者在2年內發生腫瘤復發或遠處轉移,而高達90%以上的肝癌術后死亡因素與轉移復發有關。原發性肝癌術后復發轉移是患者最終死亡的主要原因,而肝癌干細胞的殘存和逃脫免疫系統監視清除是復發轉移的根源。人體抗腫瘤免疫主要為細胞免疫,主要是T淋巴細胞介導的細胞免疫中CD3+CD8+T細胞即細胞毒性T細胞(CTL)發揮識別和殺傷腫瘤細胞的作用。而DC是人體內功能最強大的抗原呈遞細胞,能有效激活初始T細胞,誘導出抗原特異性CTL,使機體產生抗腫瘤免疫反應。抗原致敏后DC細胞的增殖活性和對抗原的識別作用均增強[6],與CTL共培養后,細胞間的相互作用能促進二者的成熟和增殖,使CTL的抗瘤效應增強[7],增加DC和共刺激分子遞呈抗原的特異性,促進DC分泌IL-2[8]。
本研究根據肝癌干細胞特異性表面標志CD133分子,從肝癌組織中篩選出肝癌干細胞,制備抗原。同時從病人外周血中分離單個核細胞,體外分別誘導、擴增人肝癌干細胞抗原致敏的樹突狀細胞(DC)和細胞因子誘導的殺傷細胞(CIK),并進一步從CIK細胞中分選出CTL細胞。CIK細胞是人體外周血單個核細胞在體外用多種細胞因子誘導而獲得的一種多克隆性T細胞[9],增殖能力強,短期培養后即可達到抗腫瘤效應細胞的數量。CIK細胞對腫瘤細胞的毒性是非MHC限制的,并且對腫瘤干細胞也具有細胞毒性[10]。CIK細胞中富含大量的毒性T淋巴細胞(CTL)。本課題組通過臨床應用級別的ClinicMacs流式細胞儀從CIK細胞中分選出CD3+CD8+的CTL細胞;將肝癌干細胞抗原致敏后的DC細胞與CTL細胞共培養,產生大量具有抗原特異性殺傷功能的CTL細胞。肝癌患者由于免疫耐受等原因,腫瘤免疫原性差,不能有效提呈給DC細胞,導致機體難以產生針對性的CD3+CD8+T細胞。本課題組采取體外誘導擴增DC和CTL的方式,流式細胞術測定結果顯示細胞分類和增殖情況均可以滿足實驗和治療需要。
本研究結果顯示,肝癌干細胞抗原致敏后的DC-CTL細胞對肝癌干細胞具有很強的殺傷作用,且隨效應細胞數量的增加殺傷作用亦增強,為進一步開展臨床實驗研究提供理論依據。
[1]馬俊明,雷鵬,王琦.人肝癌組織中肝癌干細胞的分離培養與初步鑒定[J].寧夏醫科大學學報,2015,37(8):917.
[2]張文鋒,馮 凱.腫瘤異質性:肝癌干細胞有序的分化潛能[J].檢驗醫學與臨床,2014,11(21):3067.
[3]李廣權,陳偉強.肝癌干細胞的研究現狀[J].醫學綜述,2013,19(3):457.
[4]職曉松,訾曉淵,胡以平.基于肝癌干細胞的肝癌生物學研究進展[J].遵義醫學院學報,2015,38(3):209.
[5]Suetsugu A,Nagaki M,Aoki H,et al.Characterization of CD133+hepatocellular carcinoma cells as cancer stem/progenitor cells[J].Biochem Biophys Res Commun,2006,351(4):820.
[6]劉 暢,王士勇,焦 雪,等.抗原致敏的DC-CIK對前列腺癌細胞DC145殺傷作用[J].解剖科學進展,2012,18(3):222.
[7]韓秀蕊,楊娣娣,趙 園,等.樹突狀細胞介導CIK細胞抗惡性腫瘤效應的實驗研究[J].現代檢驗醫學雜質,2014,29(3):44.
[8]王 鳳,田復明,竇長武.DC-CIK細胞抗腫瘤的研究進展[J].內蒙古醫學雜質,2013,45(4):435.
[9]祁秋干,紀 娜,王遠東.CIK細胞連用樹突狀細胞治療惡性腫瘤的進展[J].中國現代藥物應用,2015,9(12):265.
[10]陳 娟,盧光琇.CIK細胞的生物特性和應用研究新進展[J].腫瘤藥學,2014,4(3):166.

