銪螯合劑對甲胎蛋白單克隆抗體標記的研究
孫延文,謝文兵,劉秀霞,常 宇,潘利華,于 庭*
(1.吉林大學第二醫院,吉林 長春130041;2.中國科學院長春應用化學研究所,吉林 長春130022)
標記免疫分析是將高度靈敏的標記示蹤技術與高度特異性的抗原抗體反應相結合的分析技術。其中時間分辨熒光免疫分析結合能量共振轉移理論構成了均相時間分辨熒光免疫分析(HTRF)。與異相免疫分析相比,均相免疫分析不需要繁瑣的分離步驟,更符合現代自動化快速檢測的要求。該技術廣泛應用于基礎研究、臨床診斷、藥物篩查等領域[1,2]。
為了建立HTRF,通過一系列反應合成銪螯合劑(Eu3+?2,6-{N,N’,N,N’-[二(2,2’-聯吡啶-6,6’-二甲基)]二(氨甲基)}-吡啶-二羧酸),標記甲胎蛋白單克隆抗體(AFP-McAb),并對標記抗體的標記效果進行研究。
1 實驗部分
1.1儀器與試劑
高效HTRF分析儀(BMG RUBYstar)、MK3型酶標儀(Thermo)、超微量分光光度計(Thermo)、1-(3-二甲氨基丙基)-3-乙基碳二亞胺(EDC)和N-羥基丁二酰亞胺(NHS)(Thermo)、AFP-McAb M0110(南京京達生物公司)、HRP標記羊抗鼠抗體(Jackson)。
1.2抗體標記過程
1.2.1配制溶液 稱取銪螯合劑、EDC和NHS,配制成濃度分別為0.5、25、7.5 mg/ml的水溶液。
1.2.2銪螯合劑的活化 將99 μl EDC溶液加入到99 μl NHS溶液中混勻,再加入到238 μl的銪螯合劑溶液中,間隔混勻數次,室溫反應24 h。
1.2.3偶聯抗體 加入PH7.4 10 mM PBS,調節PH為7,將400 μg AFP-McAb分三次加入到活化的銪螯合劑中,間隔混勻數次,4℃反應24 h。
1.2.4透析 將標記的AFP-McAb在PH7.4 10 mM PBS中進行透析,每隔4 h換液一次,次日將透析后的標記抗體移取至EP管中,經超微量分光光度計測定抗體濃度并保存。
1.3熒光強度的測定
銪螯合劑溶液濃度調至5×10-4mg/ml,進行2倍系列稀釋,標記抗體按照1∶10、100、1 000進行稀釋,50 μl/孔,加入到96孔全白酶標板中,設定復孔,在高效HTRF分析儀上測定620 nm處熒光強度。
1.4免疫活性的測定
用PH9.6 50mM碳酸鹽緩沖溶液分別配制濃度為1.5、1.0、0.5 μg /ml的AFP溶液,加入到96孔酶標板中,100 μl/孔包被,4℃過夜。次日,用0.01 M PBST溶液,250 μl/孔,沖洗3次,拍干;加入封閉液200 μl/孔,37℃封閉2 h ;棄掉孔內液體,拍干備用。
標記抗體與未標記抗體的起始濃度調整一致,分別1∶1 000稀釋,再依次3倍梯度稀釋;分別加入到包被板中,100 μl/孔,設定對照,37℃孵育0.5 h;棄掉孔內液體,加0.01 M PBST溶液250 μl/孔,沖洗3次,拍干;加入酶標二抗100 μl /孔,37℃孵育0.5 h;棄掉孔內液體,用0.01M PBST溶液250 μl/孔,沖洗5次,拍干;加顯色液100 μl/孔,37℃孵育10 min;加入終止液50 μl/孔;在酶標儀上進行檢測,讀取OD值。
2 結果
2.1銪螯合劑的特點
銪螯合劑的結構式如圖1所示,它是雙功能穴狀螯合劑。該銪螯合劑含有吡啶-2,2-聯吡啶結構,通過共價形式將銪離子包繞在內,當受到激發時,該結構可俘獲能量,通過分子結構內能量轉移將部分能量轉移給銪離子,使其發出相應的熒光。該銪螯合劑的激發光譜是250-340 nm,發射光譜是620±10 nm,斯托克斯位移達290 nm,熒光壽命達900 μs。它帶有兩個羧基基團,在偶聯劑的作用下偶聯抗體上的氨基,標記在相應的抗體上。
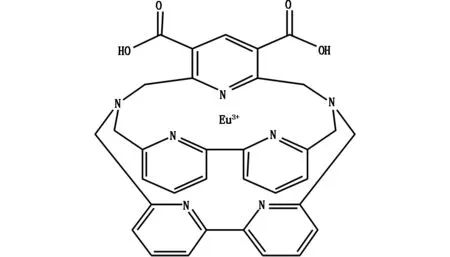
圖1 銪螯合劑結構式
2.2銪螯合劑的熒光強度
銪螯合劑溶液系列稀釋測定熒光強度,并對數據進行線性擬合,如表1和圖2所示,隨著銪螯合劑濃度的減小,熒光強度也隨之減小,線性方程為Y=5.05×108X-475(R2=0.999 3)。
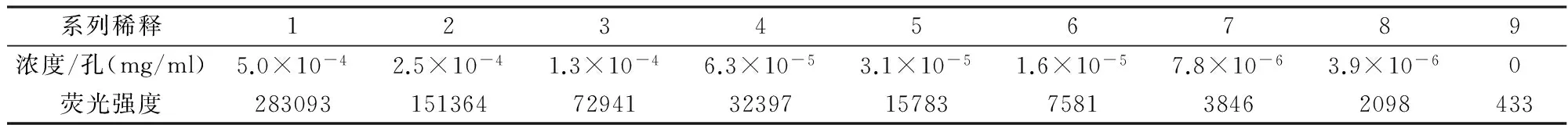
表1 銪螯合劑系列稀釋溶液的熒光強度
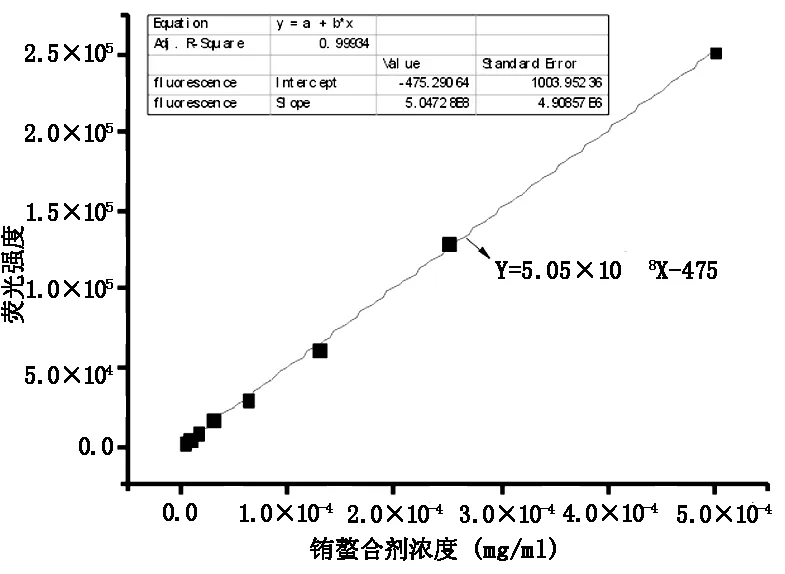
圖2 銪螯合劑溶液濃度與其熒光強度的關系
2.3標記抗體的熒光強度
標記前后AFP-McAb的濃度,如表2所示。根據標記抗體的熒光強度計算回收率和標記率,如表3所示。回收率=標記抗體(mg/ml)×標記后體積(ml)÷抗體投入量(mg) 。標記率=標記抗體上銪螯合劑的摩爾濃度÷標記抗體的摩爾濃度。AFP-McAb的回收率為94%,標記率為15。
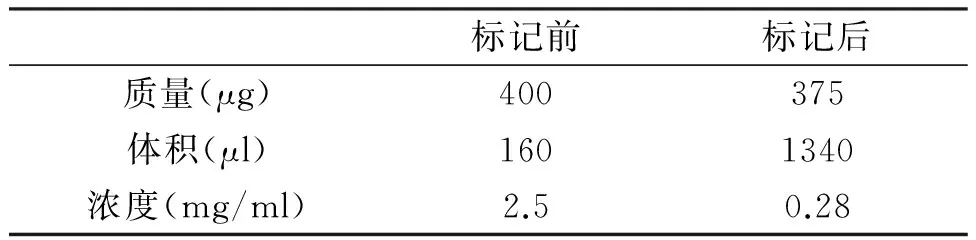
表2 標記前后抗體的量

表3 標記抗體的熒光強度
2.4標記抗體免疫活性
探究銪螯合劑標記對AFP-McAb免疫活性的影響,首先確定最佳包被濃度。如圖3所示,不同濃度的AFP溶液分別進行包被,隨著抗體濃度的增加,OD值逐漸增大,當抗體濃度大于6.9×10-6mg/ml時,OD值逐漸達最大值;同濃度抗體反應時,隨著包被抗原濃度的增加,OD值也相應增大。結果表明最小包被濃度0.5 μg /ml可滿足抗體免疫活性的檢測。
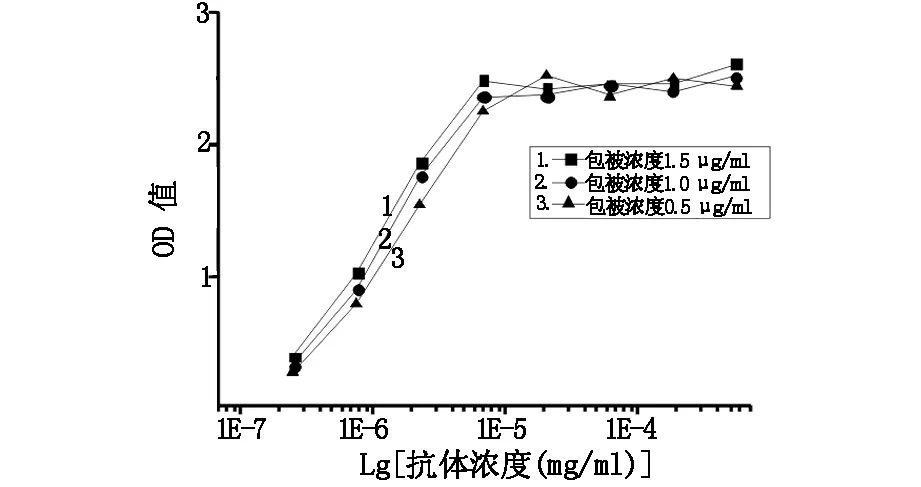
圖3 甲胎蛋白最佳包被濃度的確定

圖4 標記抗體與未標記抗體免疫活性的比較
結合以上數據,調整AFP包被濃度和稀釋比例重新測定并作圖。如圖4所示,隨著抗體濃度的減小,OD值逐漸減小;同濃度的標記抗體與未標記抗體相比,OD值未見明顯變化。
3 討論
稀土螯合劑的標記是建立HTRF方法的關鍵部分。與傳統的熒光標記物質相比,稀土螯合劑的激發光譜寬,發射光譜窄而尖銳,斯托克斯位移大,而且其熒光壽命長,是傳統熒光的1000多倍,利用時間分辨技術可有效地消除激發光及本底自發熒光的干擾,提高了檢測的靈敏度。
稀土螯合劑作為重要的標記示蹤物質,廣泛應用于HTRF中。在細胞凋亡領域,利用鋱螯合劑標記組氨酸抗體作為能量供體,熒光素標記Smac蛋白作為能量受體,研究X連鎖凋亡抑制蛋白的作用機制[3]。在疾病感染方面,利用銪螯合劑和Alexa Fluor647熒光染料,結合protein L的特點建立HTRF的方法,用于急性漢坦病毒感染[4]和布氏桿菌感染的血清學檢測。還有研究利用銪螯合劑檢測絲氨酸/蘇氨酸在蛋白質磷酸化過程中的作用機制[5]。
甲胎蛋白是一種分子量約為70 kD的糖蛋白,主要在胎兒的卵黃囊和肝臟細胞內合成。在一些惡性腫瘤患者的血清中,AFP含量升高,尤其在原發性肝癌患者血清中,其含量升高更為顯著。目前,AFP已成為早期輔助診斷原發性肝癌的重要血清標志物,對疾病的監測以及治療具有指導作用。
臨床檢測AFP的方法有放射免疫分析、酶聯免疫分析、膠體金法、化學發光免疫分析等。傳統的熒光、放射以及酶聯免疫分析并未達到靈敏度高、試劑穩定、線性范圍寬等要求,化學發光免疫分析雖具有以上優點,但其發光時間短、受反應環境的影響,而HTRF由于結合了時間分辨和能量共振轉移理論,除具有以上優點外,還具有操作簡便、可重復檢測、不受環境影響等特點。
該銪螯合劑對AFP-McAb標記的過程中,根據銪螯合劑溶液濃度與其熒光強度之間的線性關系(R2=0.9993),作出標準曲線計算標記抗體中銪螯合劑的摩爾濃度,再依公式計算出標記率。標記率的高低會影響檢測的靈敏度。通常抗體的標記率Eu3+/IgG在5-15個較為理想[6]。標記過程中,偶聯反應的比例、時間、酸堿度等都可能會影響抗體的標記率。但是,抗體的標記率并不是越高越好,其值越高,熒光強度越高,會造成本底的升高,降低檢測的靈敏度,也會影響抗體的免疫活性。低標記率抗體可能更有利于HTRF的建立,這還需進一步的研究。
AFP-McAb是免疫球蛋白,作為有機分子的稀土螯合劑標記在抗體上會改變抗體的結構,造成抗體之間的交聯,從而影響抗體的免疫學活性。而該銪螯合劑的分子量為738,其分子量遠遠小于AFP-McAb的分子量(150 kD),所以在一定標記率的情況下,該銪螯合劑對抗體的空間結構影響是有限的,其標記反應條件也較為溫和,進而對免疫活性影響較小。
因此,通過對標記過程中標記率、熒光強度以及免疫活性的研究,該自合成的銪螯合劑對甲胎蛋白單克隆抗體的標記效果較為理想,可以進一步用于均相時間分辨熒光免疫分析的建立。
[1]Blanc E,Wagner P,Plaisier F,et al.Design and validation of a homogeneous time-resolved fluorescence cell-based assay targeting the ligand-gated ion channel 5-HT3A[J].Analytical Biochemistry,2015,484:105.
[2]Farino ZJ,Morgenstern TJ,Vallaghe J,et al.Development of a rapid lnsulin assay by homogenous time-resolved fluorescence[J].Plos One,2016,11(2):e0148684.
[3]Chaudhry C,Davis J,Zhang Y,et al.Building homogeneous time-resolved fluorescence resonance energy transfer assays for characterization of bivalent inhibitors of an inhibitor of apoptosis protein target[J].Analytical Biochemistry,2016,497:8.
[4]Hepojoki S,Hepojoki J,Hedman K,et al.Rapid homogeneous lmmunoassay based on time-resolved F?rster resonance energy transfer for serodiagnosis of acute hantavirus lnfection[J].Journal of Clinical Microbiology,2015,53(2):636.
[5]Alpha-Bazin B,Quéméneur E,Chem A.Antibody-free detection of phosphoserine/threonine containing peptides by homogeneous time-resolved fluorescence[J].Analytical Chemistry,2012,84(22):9963.
[6]吳英松,李 明,編.時間分辨熒光免疫技術[M].北京:軍事醫學科學出版社,2008:24-25.

