Nogo-B通過Rac1 GTPase激活途徑調控巨噬細胞的胞葬功能
張 英,周 莉,姜春玲*,蔣小娟,肖乾慧,毛永巧
(1.北京大學深圳醫院,廣東 深圳518036;2 .四川大學華西醫院,四川 成都610041)
細胞凋亡是機體清除感染或受損細胞,維持內穩態的重要機制。但凋亡細胞內含有大量自身抗原與警報素,若未被及時清除,會導致繼發性壞死,引起組織損傷甚至自身免疫性疾病[1]。巨噬細胞密切參與凋亡細胞的清除,其將凋亡細胞吞噬、移除的過程,稱為胞葬功能(Efferocytosis)[2]。胞葬功能對維持機體生長發育、內環境穩定等至關重要[3]。
Nogo-B是一類主要定位于真核細胞內質網及細胞膜的跨膜蛋白,其高表達于單核/巨噬細胞中,對巨噬細胞功能具有一定調節作用[4]。研究表明Nogo-B 基因缺陷可導致單核/巨噬細胞的遷移、延展能力降低以及肌動蛋白細胞骨架重組功能障礙[4]。
肌動蛋白細胞骨架重組是巨噬細胞完成吞噬的必經步驟[5]。Rho/Rac GTPase是介導胞葬功能時肌動蛋白細胞骨架重組與凋亡細胞吞入的重要蛋白酶。激活Rac1可促進肌動蛋白細胞骨架重組,完成凋亡細胞吞入[6]。Schanda等研究發現,在單核/巨噬細胞系統中,Nogo-B與RhoA/Rac1存在共定位關系[7],因此二者可能存在功能上相互關聯。
基于以上認識,本實驗中我們采用siRNA轉染下調巨噬細胞Nogo-B表達,通過觀察其對凋亡細胞吞噬指數及在凋亡細胞刺激下Rac1 GTPase活性的變化,探討Nogo-B是否對巨噬細胞的胞葬功能具有調控作用及其可能機制。
1 材料與方法
1.1細胞株及試劑
J774A.1小鼠巨噬細胞與HL60早幼粒細胞株(美國伊利諾伊大學芝加哥分校麻醉與藥理實驗室胡國昌老師惠贈);胎牛血清(Invitrogen,美國)、 DMEM 培養基(Thermo Fisher Scientific,美國)、RPMI-1640 培養基(Gibco,美國);兔抗小鼠 Nogo-B抗體(Abcam,美國),兔抗小鼠GAPDH抗體 (Cell Signaling Technology,美國);RhoA/Racl/Cdc42 活性分析試劑盒(Cytoskeleton,美國);膜聯蛋白Ⅴ(AnnexinⅤ)-FITC(含 PI)雙染凋亡試劑盒(BD Biosciences,美國);Nogo-B siRNA(Dharmacon,美國);紅色與綠色熒光CellTracker(Invitrogen,美國);Lipofectamine RNAiMAX轉染試劑(Invitrogen,美國)
1.2細胞培養與分組
J774A.1巨噬細胞用含10%胎牛血清的DMEM培養基置于37℃、5%CO2孵育箱中培養。細胞自然生長狀態下匯合50%-70%時分別轉入不同濃度(10、20、50、100 nM)Nogo-B siRNA,轉染48 h以western印跡法檢測轉染效果,優化最佳轉染濃度。HL60細胞用10%胎牛血清的RPMI-1640培養基置于37℃、5%CO2孵育箱中培養。
分組:將J774A.1巨噬細胞分為siRNA 陰性對照組(對照組)與Nogo-B siRNA 干擾組。對照組與Nogo-B siRNA組分別取生長狀態良好的J774A.1巨噬細胞,用細胞刮刮取細胞,反復吹打至單細胞懸液、計數,按每孔5×105個細胞鋪于普通6孔板中,待細胞完全貼壁后分別使用陰性對照siRNA與Nogo-B siRNA進行轉染,48 h后檢測巨噬細胞對凋亡細胞的胞葬功能以及在凋亡細胞刺激下巨噬細胞內Rac1 GTPase活性變化。所有實驗于相同條件下重復3次。
1.3紫外線法誘導HL60細胞凋亡
取107個HL60細胞,離心去上清,以無色、無血清RPMI培養基10 ml重懸。置于短波紫外燈下室溫照射后(波長254 nm,能量100 J/m2),轉移至 37℃,5% CO2培養箱中孵育3 h。使用Annexin V-FITC/PI雙染試劑盒染色后,以FACSCanto流式細胞儀(Beckman Coulter,美國)鑒定凋亡細胞比例,其中Annexin V 陽性,PI 陰性為凋亡細胞,本方法可獲得90%以上細胞發生凋亡(圖1)。
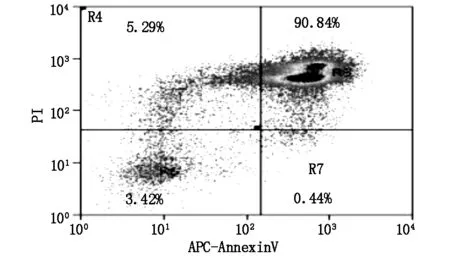
圖1 紫外線法誘導細胞凋亡
1.4體外檢測巨噬細胞的胞葬功能
實驗前1日,將105/well巨噬細胞接種于24孔板。吞噬前分別采用5 μM綠色與2 μM紅色熒光celltracker對巨噬細胞與凋亡細胞分別染色30 min及15 min,以PBS洗滌一次以去除多余染料,按照5∶1的比例將凋亡細胞加入已接種巨噬細胞的24孔板中,置于37℃,5%CO2培養箱共同孵育2 h,使巨噬細胞充分吞噬凋亡細胞后,免疫熒光顯微鏡下觀察,計算巨噬細胞對凋亡細胞的吞噬指數(每100個巨噬細胞所吞噬的凋亡細胞總數除以100,取三次計數的平均值)。
1.5Western印跡檢測細胞蛋白表達
接種于6孔板中的J774A.1巨噬細胞,加入RIPA裂解液,離心取上清液,BCA法測定各組蛋白含量。加入5X上樣緩沖液,100℃水浴變性提取蛋白,并在SDS-聚丙烯酰胺凝膠中進行電泳,經轉膜儀將蛋白轉移至硝酸纖維素膜后,經5 %脫脂奶粉室溫封閉2 h。分別加入Nogo-B抗體(1∶1 000)、GAPDH抗體(1∶2 000)、4℃過夜,次日使用PBST洗膜后,加入辣根過氧化物酶標記的二抗(1∶2 000)室溫孵育1 h,再次洗膜。蛋白條帶以Odyssey Fcimager (LI-COR Biosciences,美國)化學發光/熒光檢測數字成像系統進行檢測并拍照,應用ImageJ 軟件分析條帶光密度。
1.6谷胱甘肽巰基轉移酶-拉下實驗(GST-pulldownassay)檢測Rac1GTPase活性
按照RhoA/Racl/Cdc42 活性分析試劑盒操作說明進行。該試劑盒中含有被標記Rho GTPase下游效應蛋白的瓊脂糖珠,該瓊脂糖珠可特異性結合處于活性狀態的Rho GTPase,將其從瓊脂糖珠洗脫下后,通過Western印跡法可檢測活性Rac1 GTPase的含量。以12%SDS-PAGE行Western印跡分析(同前述)。
1.7統計學處理
2 結果
2.1Nogo-B對巨噬細胞胞葬功能的調控作用
首先采用Nogo-B siRNA(50 nM)轉染、下調J774A.1巨噬細胞Nogo-B 表達,以綠色與紅色熒光celltracker對巨噬細胞與凋亡細胞進行染色,隨后共同孵育、吞噬2 h,免疫熒光顯微鏡下觀察結果。我們發現,Nogo-B下調導致巨噬細胞對凋亡細胞的胞葬功能明顯受損,吞噬指數由對照組的(48.9±3.5)%顯著降低至(17.8±2.1)%(P<0.01)(圖2),提示Nogo-B對巨噬細胞的胞葬功能具有調控作用。
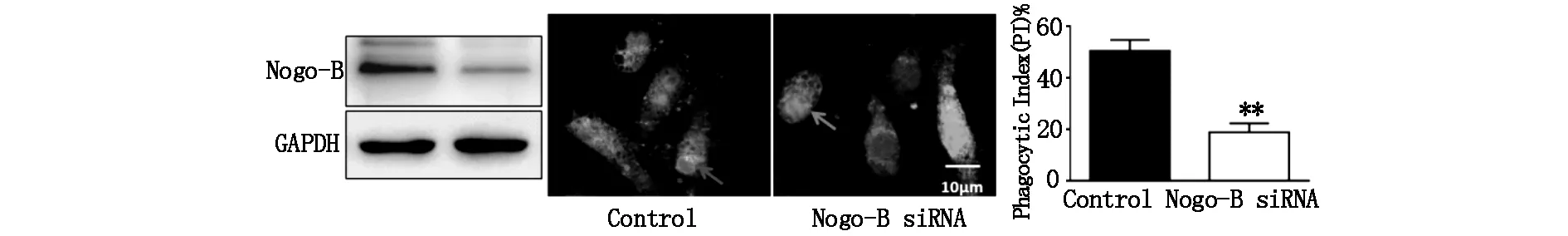
圖2 下調Nogo-B表達抑制巨噬細胞的胞葬功能 **P<0.01
2.2Nogo-B對巨噬細胞RaclGTPase活性的影響
為進一步明確Nogo-B如何調控巨噬細胞的胞葬功能,我們使用siRNA轉染下調巨噬細胞Nogo-B表達后,給予凋亡細胞刺激,分別于刺激5、10及15 min,采集巨噬細胞提取蛋白,采用pulldown技術檢測Rac1 GTPase活性變化。結果發現,對照組巨噬細胞在凋亡細胞刺激下Rac1 GTPase被逐漸激活,于刺激后的5至15 min其活性呈遞增趨勢;而使用siRNA下調Nogo-B表達后的巨噬細胞,在凋亡細胞刺激下Rac1活性無顯著變化,即出現Rac1 GTPase激活障礙(圖3)。肌動蛋白細胞骨架重組是巨噬細胞完成吞噬的必經步驟,而Rac1 GTPase是完成細胞骨架重組的重要分子,Rac1激活障礙將影響巨噬細胞肌動蛋白細胞骨架重組并可能導致吞噬功能受損。因此,該結果提示Nogo-B 可能通過調控Rac1 GTPase激活途徑影響細胞骨架重組,進而調節巨噬細胞的胞葬功能。
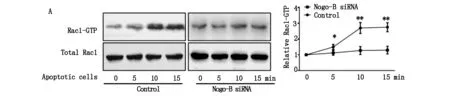
*P<0.05,**P<0.01
3 討論
人體每天有數以億計的細胞發生凋亡。若凋亡細胞未被及時清除,就會繼發性壞死,導致細胞內損傷性物質大量釋放、損傷機體。而巨噬細胞可以通過胞葬功能,在損傷性物質釋放到周圍組織之前將凋亡細胞吞噬并安全移除,因此胞葬功能對維持機體生長發育、內環境穩定等至關重要[3]。我們的研究發現, Nogo-B可以調控巨噬細胞的胞葬功能,采用siRNA轉染下調Nogo-B 表達后,巨噬細胞對凋亡細胞的胞葬功能明顯受損;Nogo-B 可能通過Rac1 GTPase激活途徑,影響細胞骨架重組,發揮對胞葬功能的調節作用。
胞葬功能受機體嚴密調控,胞葬凋亡細胞的過程包括凋亡細胞的識別、吞入及消化等多個環節[3,8],對任一環節的調控均可能影響胞葬功能。Nogo-B是一類主要定位于真核細胞內質網及細胞膜的跨膜蛋白,其高表達于單核/巨噬細胞中。已有研究發現,Nogo-B對巨噬細胞功能具有一定調節作用[4],Nogo-B 基因缺陷可導致單核/巨噬細胞的遷移、延展能力降低以及肌動蛋白細胞骨架重組功能障礙[4]。而我們的研究進一步發現,Nogo-B對巨噬細胞的胞葬功能也有調控作用,下調Nogo-B后巨噬細胞的胞葬功能嚴重受損,對凋亡細胞的吞噬指數由對照組的48.9±3.5%顯著降低至17.8±2.1%。
那么網狀蛋白Nogo-B是如何調節巨噬細胞的胞葬功能呢?已知胞葬過程中當凋亡細胞直接或間接被吞噬細胞識別后,最終導致Rho/Rac GTPase激活[9,10],促進纖絲狀肌動蛋白F-actin聚合并由此介導細胞骨架重組完成吞入及消化。Rac1 作為Rac GTPase的重要成員,是影響細胞骨架重組的關鍵分子,Rac1激活后可通過誘導肌動蛋白聚合、F-actin形成介導肌動蛋白細胞骨架重組[11-13]。肌動蛋白細胞骨架重組是巨噬細胞完成吞噬的必經步驟[5]。而現有研究提示,Nogo-B基因缺陷可導致小鼠骨髓單核/巨噬細胞細胞F-actin聚合及由此介導的肌動蛋白細胞骨架重組功能障礙[4]。此外,有研究進一步發現在單核/巨噬細胞系統中,Nogo-B與RhoA/Rac1存在共定位關系[7],提示二者可能存在功能上相互關聯。本研究中我們發現,使用siRNA轉染下調巨噬細胞Nogo-B表達后,Rac1 GTPase的激活過程受到抑制。提示,Nogo-B可能通過調控Rac1 GTPase的激活途徑以及由此介導的肌動蛋白細胞骨架重組,調控巨噬細胞的胞葬功能。
綜上所述,網狀蛋白Nogo-B對巨噬細胞的胞葬功能具有調控作用,下調Nogo-B 表達后巨噬細胞的胞葬功能明顯受損;Nogo-B 可能通過Rac1 GTPase激活途徑,影響細胞骨架重組,發揮對胞葬功能的調節作用。
[1]Elliott MR,Ravichandran KS.Clearance of apoptotic cells:implications in health and disease[J].J Cell Biol,2010,189(7):1059.
[2]deCathelineau AM,Henson PM.The final step in programmed cell death:phagocytes carry apoptotic cells to the grave.Essays Biochem,2003,39:105.
[3]Devitt A,Marshall LJ.The innate immune system and the clearance of apoptotic cells[J].J Leukoc Biol,2011,90:447.
[4]Yu J,Fernandez-Hernando C,Suarez Y,et al.Reticulon 4B (Nogo-B) is necessary for macrophage infiltration and tissue repair[J].Proc Natl Acad Sci USA,2009,106:17511.
[5]May RC,Machesky LM.Phagocytosis and the actin cytoskeleton[J].J Cell Sci,2001,114:1061.
[6]Nakaya M,Tanaka M,Okabe Y,et al.Opposite effects of rho family GTPases on engulfment of apoptotic cells by macrophages[J].J Biol Chem ,2006,281:8836.
[7]Schanda K,Hermann M,Stefanova N,et al.Nogo-B is associated with cytoskeletal structures in human monocyte-derived macrophages[J].BMC Res Notes,2011,4:6.
[8]Hochreiter-Hufford A,Ravichandran KS.Clearing the dead:apoptotic cell sensing,recognition,engulfment,and digestion[J].Cold Spring Harb Perspect Biol,2013,5:a008748.
[9]Leverrier Y,Ridley AJ.Requirement for Rho GTPases and PI 3-kinases during apoptotic cell phagocytosis by macrophages[J].Curr Biol,2001,11:195.
[10]Tosello-Trampont AC,Nakada-Tsukui K,Ravichandran KS.Engulfment of apoptotic cells is negatively regulated by Rho-mediated signaling[J].J Biol Chem,2003,278:49911.
[11]Wells CM,Walmsley M,Ooi S,et al.Rac1-deficient macrophages exhibit defects in cell spreading and membrane ruffling but not migration[J].J Cell Sci,2004,117:1259.
[12]Allen WE,Jones GE,Pollard JW,et al.Rho,Rac and Cdc42 regulate actin organization and cell adhesion in macrophages[J].J Cell Sci,1997,110 ( Pt 6):707.
[13]Wheeler AP,Wells CM,Smith SD,et al.Rac1 and Rac2 regulate macrophage morphology but are not essential for migration[J].J Cell Sci,2006,119:2749.

