LIMK1調控骨肉瘤細胞耐藥的實驗研究及機制分析
陳 瑞,高奕瑤,楊建增,榮小麗,王 巖
(吉林大學中日聯誼醫院 科學研究中心,吉林 長春130033)
骨肉瘤是兒童和青少年多發的惡性骨腫瘤[1],其治療主要是以手術為主,放、化療為輔,聯合化療不僅控制腫瘤細胞增殖,消除局部或遠處轉移,而且改善患者生存率[2]。然而化療中多藥耐藥(Multidrug resistance,MDR)的發生成為了治療的主要障礙[3],約有40%的患者在治療初期表現出化療耐藥[4]。LIMK1 屬于LIM 激酶蛋白家族成員[5],本項目組的前期研究發現LIMK1在骨肉瘤多藥耐藥細胞中呈高表達,同時驗證了LIMK1對骨肉瘤多藥耐藥細胞耐藥及遷移具有重要的調控作用[6,7]。
本實驗通過瞬時轉染技術驗證了LIMK1基因表達上調對人成骨肉瘤細胞耐藥的影響,并通過MEM和DAVID平臺分析LIMK1及其共表達基因富集情況,進一步探討可能的耐藥機制,為臨床防治腫瘤、開發靶向治療研究奠定基礎。
1 材料和方法
1.1材料
1.1.1細胞系及質粒 本實驗的人成骨肉瘤細胞系(MG63)來自吉林大學中日聯誼醫院科學研究中心,重組質粒CFP- LIMK1- WT cDNA由中日聯誼醫院科學研究中心王巖教授贈送。
1.1.2主要試劑耗材及儀器 高糖 DMEM(H- DMEM)來自Gibico/USA,特級胎牛血清來自北京元亨金馬/China,Lipofectamine 2000來自Invitrogen/USA,Trizol來自Invitrogen/USA,(DL- 2000) Marker 來自北京康為/China,RT- PCR 試劑盒來自Thermo/USA,2×Taq PCR MasterMix來自TaKaRa/Japan,引物來自上海生工/China,預染 marker來自NEB/USA。CCK- 8檢測試劑盒來自Dojindo/Japan,長春新堿來自上海新華聯制藥有限公司/China, CO2 孵箱來自SANYO/Japan,超凈工作臺來自VS- 1301L- U 蘇州安泰/ China。
1.1.3數據庫分析 利用基因共表達網絡分析平臺MEM(http://biit.cs.ut.ee/mem/index.cgi)獲得LIMK1的共表達基因;通過DAVID(https://david.ncifcrf.gov/summary.jsp)篩選LIMK1與其共表達基因相關聯的信號轉導通路,分析LIMK1可能的作用機制。
1.2方法
1.2.1質粒瞬時轉染 取對數生長期的MG63細胞,用含 10%FBS的DMEM 培養基將細胞濃度稀釋至 1×105/ml,接種于 6 孔板中,每孔300 μl,放置細胞培養箱內培養,條件為37℃、CO2,待細胞密度達70%- 80%時進行轉染。瞬時轉染采用 Lipofectamine 2000 進行,將重組質粒CFP- LIMK1- WT cDNA 按0 μg/ml、2.5 μg/ml、10 μg/ml三個濃度稀釋到300 μl 無血清培養基中;放入培養箱內孵育4- 5小時,更換成含有 10%FBS的培養基。所有組別設3個復孔。
1.2.2RT- PCR實驗檢測 LIMK1及MDR1基因表達 取對數生長期的上述細胞,用 Trizol法提取各組細胞總 RNA(濃度為1 000 ng/μl),用Thermo 反轉錄試劑盒逆轉錄合成 cDNA,用TaKaRa試劑盒進行RT- PCR檢測LIMK1及MDR1表達,以β- Actin內參進行比較,結果用2-△△ct計算相對表達量。所用引物見表1。
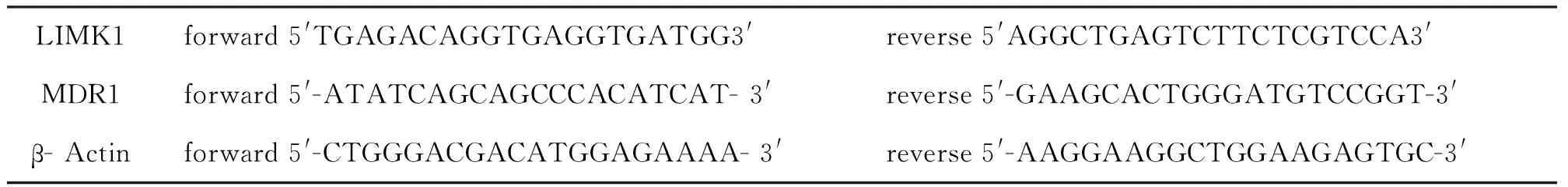
表1 引物序列
1.2.3藥物抑制率測定 將上述細胞至于96孔板中培養,待細胞密度達70%- 80%時分別加入不同濃度的長春新堿,以其臨床血漿峰濃度為參照設7個濃度梯度,分別為0 ng/ml、0.0625 ng/ml、0.25 ng/ml、1 ng/ml、4 ng/ml、16 ng/ml、64 ng/ml繼續培養 48 h。更換為含10%CCK- 8 的無血清培養基,于孵箱內避光培養 2 h后用酶標儀檢測,選用450 nm 波長測吸光度A值,以不含細胞的孔作為空白對照組調零。抑制率公式:抑制率(%)=1-[A(陰性)-A(實驗)]/[A(陰性)]×100%,利用GraphPad Prism軟件算出長春新堿對各細胞的半數抑制濃度 IC50值。
1.2.4統計學分析 IC50及RT- PCR采用 GraphPad Prism進行統計學分析,用mean±SD表示。MEM、DAVID及實驗中的數據通過t檢驗獲得P值,且P值<0.05為差異具有統計學意義。
2 結果
2.1瞬轉后RT-PCR結果
用RT- PCR檢測瞬時轉染后各實驗組中LIMK1及MDR1基因表達水平,結果如圖1所示,轉染濃度越高,LIMK1基因表達水平越高;同時,多藥耐藥基因MDR1的表達也隨著LIMK1基因表達增強而增高。提示LIMK1基因表達上調增強骨肉瘤細胞的耐藥能力,二者呈正相關。
2.2LIMK1表達上調增強細胞耐藥能力
根據藥物抑制率實驗結果,應用抑制率公式計算抑制率;采用 GraphPad Prism統計軟件,計算親本及轉染細胞的半數抑制濃度 IC50值。結果如表2所示,隨著轉染濃度增加,IC50值增加,二者呈正相關。
上述結果證明LIMK1表達上調,細胞耐藥能力增強。
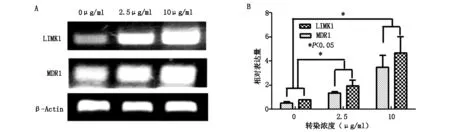
圖1 RT- PCR 結果。A為LIMK1、MDR1及內參β- Actin的電泳結果。B為LIMK1及MDR1基因的相對表達量直方圖。

cDNA濃度(μg/ml)02.510IC50(ng/ml)1.407±0.1112.083±0.0133.443±0.083P值-0.001<0.0001
2.3LIMK1影響腫瘤耐藥可能的作用機制
通過MEM平臺搜索LIMK1基因,篩選出與其密切相關的50個共表達基因,主要包括SRC,CSF1,EFNA2,FGF6等(見下圖2)。同時通過DAVID平臺分析上述共表達基因主要的富集信號通路,結果如表3所示,表中從左往右分別為信號通路名稱、該通路中共表達基因所占百分比(%)、檢驗富集顯著性的p值、相關聯的共表達基因名稱。與LIMK1共表達基因密切相關聯的信號通路主要有Rap1 signaling pathway、TNF signaling pathway、Osteoclast differentiation、Influenza A、Calcium signaling pathway等,其中以Rap1 signaling pathway中共表達基因所占比例最高,相關性最強。
此外,利用Cancer Hallmarks Analytics Tool(CHAT,http://t.cn/Rp21Yxy)網絡平臺分析LIMK1在腫瘤中的主要作用,通過計算標準化逐點交互信息值,繪制成雷達圖。如圖3所示,圖中10個扇形分別代表了10個不同的作用,分別是腫瘤侵襲和轉移(0.1894)、免疫破壞(-0.0340)、細胞力學(-1)、永久復制(-1)、逃避生長抑制(0.0526)、基因組不穩定和突變(0.0002)、誘導血管生成(0.0718)、抵抗細胞死亡(0.0208)、維持增殖信號(0.1402)、腫瘤促進炎癥(0.0121)。其中,以腫瘤侵襲和轉移的標準化逐點交互信息值最高,達0.1894,提示LIMK1在腫瘤中以侵襲和轉移作用為主。

圖2 LIMK1及其共表達基因熱圖。如圖所示,顏色深紅,相關性大。
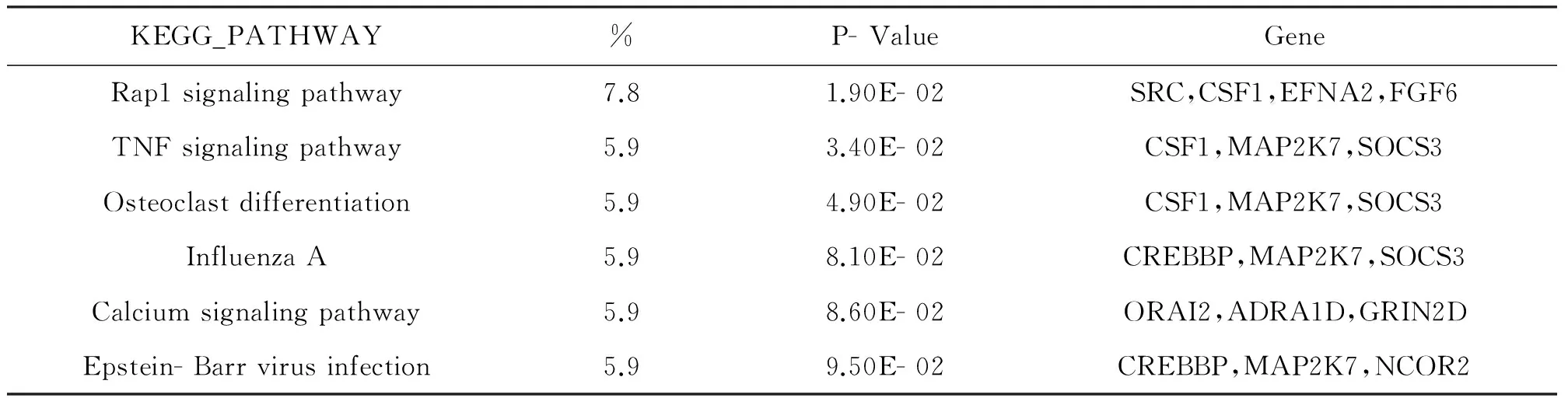
KEGG_PATHWAY%P-ValueGeneRap1signalingpathway7.81.90E-02SRC,CSF1,EFNA2,FGF6TNFsignalingpathway5.93.40E-02CSF1,MAP2K7,SOCS3Osteoclastdifferentiation5.94.90E-02CSF1,MAP2K7,SOCS3InfluenzaA5.98.10E-02CREBBP,MAP2K7,SOCS3Calciumsignalingpathway5.98.60E-02ORAI2,ADRA1D,GRIN2DEpstein-Barrvirusinfection5.99.50E-02CREBBP,MAP2K7,NCOR2
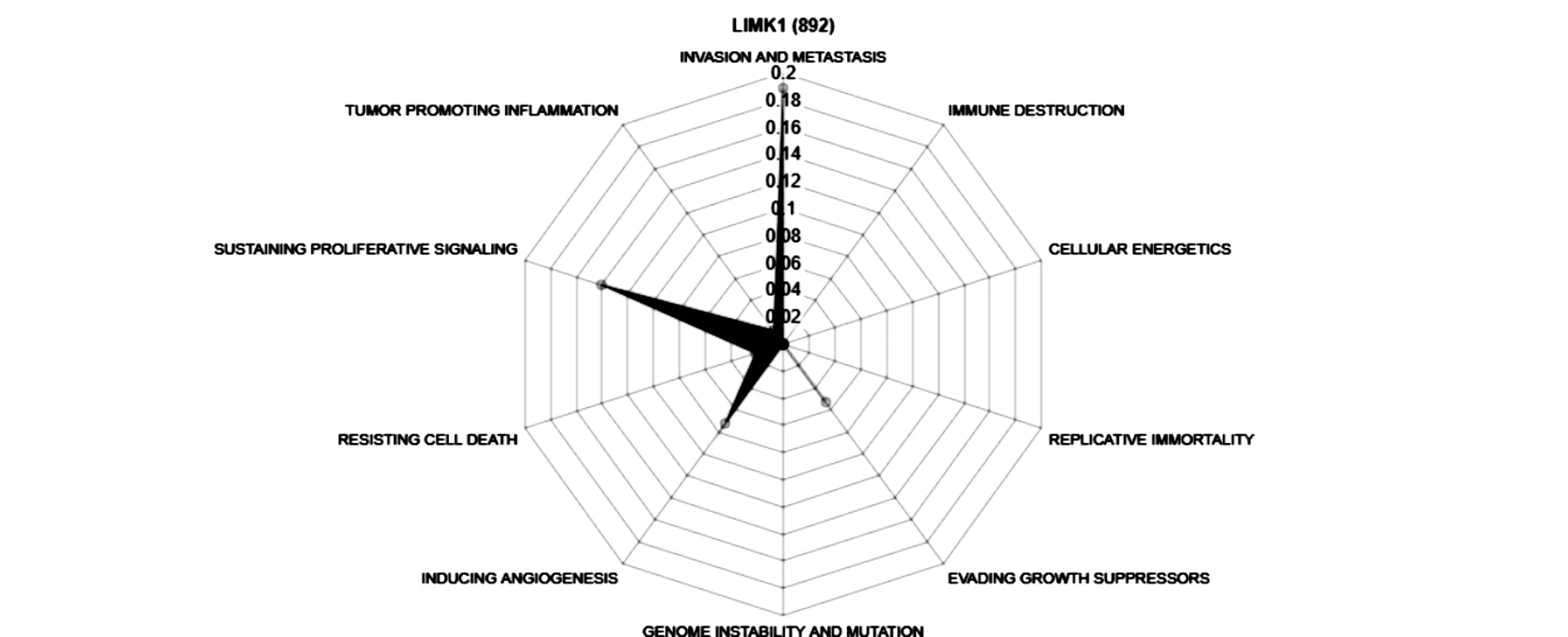
圖3 LIMK1在腫瘤中主要作用的雷達圖。圖中10個扇形分別代表了10個不同的作用,十個同心圓代表標準化逐點交互信息值。
3 討論
腫瘤耐藥是當前腫瘤治療與研究中面臨的首要難題[8]。雖然已有不少對腫瘤耐藥的分子機制方面的研究,比如增加藥物外排,改變藥物靶點,DNA損傷的修復等等[9],但腫瘤耐藥是一個非常復雜的機制。MDR1又稱ABCB1基因,編碼P- gp蛋白,該蛋白屬于ATP- 結合盒轉運體,MDR1基因高表達提示細胞多藥耐藥,是腫瘤細胞多藥耐藥程度的主要評價標準[10]。LIMK1是一種包含兩個LIM/鋅指結構域N端的絲/蘇氨酸激酶[11]。相關研究表明,LIMK1是調節腫瘤進展、轉移和耐藥的元素之一[12,13]。本文通過CHAT網絡平臺分析LIMK1在腫瘤中的主要作用,發現LIMK1主要與腫瘤侵襲和轉移、免疫破壞、細胞力學、永久復制、逃避生長抑制、基因組不穩定和突變、誘導血管生成、抵抗細胞死亡、維持增殖信號、腫瘤促進炎癥等多方面有關,其中,以腫瘤侵襲和轉移為主,其次為維持增殖信號、誘導血管生成等(圖3)。此外,還有研究證明LIMK1促進上皮- 間質轉換(EMT,epithelial- mesenchymal transition),影響腫瘤患者生存率[14]。
將含有LIMK1激酶活性的重組質粒CFP-LIMK1-WT cDNA按不同濃度梯度瞬時轉染人骨肉瘤細胞MG63,發現上調LIMK1基因表達,細胞的耐藥能力及多藥耐藥基因MDR1的表達增強,二者呈正相關趨勢(圖1及表2)。說明LIMK1能促進骨肉瘤細胞的耐藥能力,其可能成為克服腫瘤耐藥的靶基因,旨在為開發新的靶向治療提供理論支撐。
DAVID是由整合的生物學知識庫和分析工具組成的生物信息學數據庫分析平臺[15],本文應用該平臺從LIMK1及其共表達基因中篩選出主要富集的信號通路,如Rap1 signaling pathway、TNF signaling pathway、Osteoclast differentiation、Influenza A、Calcium signaling pathway等(表3)。有研究表明在非小細胞肺癌中,RAP1-NF-κB軸對細胞增殖和耐藥有調節作用[16],還有研究顯示TNF可以激活多藥耐藥腫瘤細胞中的新的細胞毒性通路[17]。上述信號通路為LIMK1影響腫瘤耐藥的作用機制的研究提供線索和思路。
[1]Cai S,Zhang T,Zhang D,et al.Volume-sensitive chloride channelsare involved in cisplatin treatment of osteosarcoma[J].Mol Med Rep,2015,11:2465.
[2]Wang Y,Teng JS.Increased multi- drug resistance and reduced apoptosis inosteosarcoma side population cells are crucial factors for tumor recurrence[J].Exp Ther Med,2016,12:81.
[3]Xiaojie Wang,Hong Zheng,Tao Shou,et al.Effectiveness of multi- drug regimen chemotherapy treatment in osteosarcoma patients:a network meta- analysis of randomized controlled trials[J].J Orthop Surg Res,2017,12(1):52.
[4]Hattinger CM,Pasello M,Ferrari S,et al.Emerging drugs for highgrade osteosarcoma[J].Expert Opin Emerg Drugs,2010,15:615.
[5]Arber S,Barbayannis FA,Hanser H,et al.Caroni P:Regulation of actin dynamics through phosphorylation of cofilin by LIM- kinase[J].Nature,1998,393:805.
[6]Zhang H1,Wang Y,Xing F,et al.Overexpression of LIMK1 promotes migration ability of multidrug- resistant osteosarcoma cells[J].Oncol Res,2011,19(10- 11):501.
[7]Jianzeng Yang,Lihong Huang,et al.LIM kinase 1 serves an important role in themultidrug resistance of osteosarcoma cells[J].Oncology Letters,2017,73(17):1792.
[8]Luetke A,Meyers P A,Lewis I,et al.Osteosarcoma treatment-Where do we stand A state of the art review[J].Cancer Treatment Reviews.2014,40(4):523.
[9]Holohan C,Van Schaeybroeck S,Longley D B,et al.Cancer drug resistance:an evolving paradigm[J].Nature Reviews Cancer,2013,13(10):714.
[10]Rajkumar T,Yamuna M.Multiple pathways are involved in drug resistance to doxorubicin in an osteosarcoma cell line [J].Anticancer Drugs,2008,19(3):257.
[11]Okano I,Hiraoka J,Otera H,et al.Identification and characterization of a novel family of serine/threonine kinases containingtwo N- terminal LIM motifs[J].J Biol Chem,1995,270(52):31321.
[12]Tiangeng You,Wei Gao,Jun Wei,et al.Overexpression of LIMK1 promotes tumor growth and metastasis ingastric cancer [J].Biomed Pharmacother,2015,69:96.
[13]Qingyong Chen,Demin Jiao,Huizhen Hu,et al.Downregulation of LIMK1 Level Inhibits Migration ofLung Cancer Cells and Enhances Sensitivity to Chemotherapy Drugs[J].Oncol Res,2013,20(11):491.
[14]Bo Su,Jian Su,Ying Zeng,et al.Diallyl disulfide suppresses epithelial- mesenchymal transition,invasion and proliferation by downregulation of LIMK1 in gastriccancer[J].Oncotarget,2016,7(9):10498.
[15]Dennis GJr,Sherman BT,Hosack DA,et al.DAVID:Database for Annotation,Visualization,and Integrated Discovery [J].Genome Biol,2003,4(5):3.
[16]Lu Xiao1,Xiaoying Lan,Xianping Shi,et al.Cytoplasmic RAP1 mediates cisplatin resistance ofnon- small cell lung cancer [J].Cell Death Dis,2017,8(5):e2803.
[17]D′Alessandro N1,Flugy A,Tolomeo M,et al.The apoptotic signaling of TNF- alpha in multidrug resistant Friend leukemia cells[J].Anticancer Res,1998,18(4C):3065.

