中國藥典2015年版四部特性檢查法主要增修訂內容解析
許 倩,鄭 正,蔣 菲,秦紹剛
(合肥市食品藥品檢驗中心,安徽 合肥 230088)
藥典是從本草學、藥物學以及處方集的編著發展而來的,其歷史源遠流長。中國人民共和國成立以后,黨和政府高度重視醫藥事業,建國伊始即著手啟動藥品標準體系建設[1]。1950年成立了第一屆藥典委員會,并于1953年頒布了第一版《中國藥典》。此后陸續部頒了10版藥典。各版藥典均客觀地反映了我國不同歷史時期醫藥產業和臨床用藥的水平,對于提升我國藥品質量控制水平發揮著不可替代的重要作用。
現行藥典是《中國藥典》2015年版,于2015年12月1日起正式實施啟用。現行的藥典較往常作了很大的改變,主要的改變集中在四部。2015年版藥典四部內容包括凡例、通則和藥用輔料,整合和代替了之前藥典的附錄,使的藥典變得更加簡潔和規范。其中通則是藥典標準的根基,涵蓋了所有的通用性要求、檢驗方法、指導原則以及試劑和標準物質等藥品標準的一般要求,本文簡要介紹新版藥典四部中關于特性檢查法部分的增、修訂情況[2]。
1 增修訂情況
現行藥典四部匯總了2010年版藥典一、二、三部附錄中一樣的內容,項目匯總后共刪減121項重復項目,在力爭簡潔的同時,也呈現出實驗室檢驗方法發展和日益完善的方向。其中部分特性檢查法具體變化總結見表1。
2 具體內容
2.1 溶液的顏色檢查法修訂
中國藥典2010年版中存在各部附錄文字內容描述、使用詞匯不統一的問題。新版藥典編纂過程中,為統一和規范文字的表述,對內容做出了一定的修改。例如重新定義了溶液顏色中幾乎無色的概念,即指供試品溶液的顏色不深于相應色調0.5號標準比色液。2015年版藥典新增了綠黃色色調及標準儲備液的配制,新增0.5號及標準比色液的配制。
2.2 澄清度檢查法修訂
15年版澄清度檢查法新增一種方法-濁度儀法,該法基本同歐洲藥典第三法,即采用散射光式濁度儀,適用于低,中濁度無色供試品溶液的濁度測定。
2.3 可見異物檢查法修訂
2015年版中國藥典在可見異物檢查法通則中幾處較為重要的修訂。
2.3.1 檢查方法的選擇原則
15年版藥典新增適用范圍,即混懸型、乳狀液型注射液和滴眼液不能使用光散射法。
2.3.2 樣品前處理方式
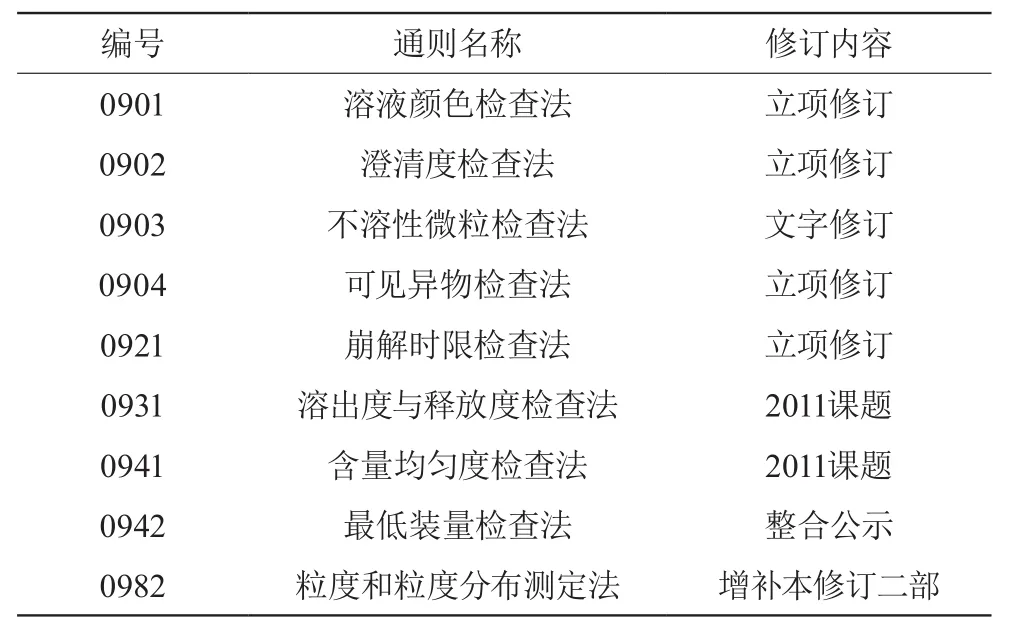
表1 增修訂情況
15年版藥典四部對溶液型,乳狀液及混懸型制劑和注射用無菌制劑的前處理方式作了明確規定,即乳狀液及混懸型制劑有大量氣泡產生影響觀察時,需靜置足夠時間至氣泡消失后檢查;注射用無菌制劑中經真空處理的樣品,必要時應當用適當的方法破其真空,低溫冷藏的品種,應先將其放至室溫,再進行溶解和檢查。
2.3.3 注射用無菌制劑結果判定的修訂
新版藥典對明顯可見異物判定新增不得檢出煙霧狀微粒沉積物、無法計數的微粒群或搖不散的沉淀,以及在規定時間內較難計數的蛋白質絮狀物;對微細可見異物判定新增不得檢出半透明的小于約1 mm的細小蛋白質絮狀物或蛋白質顆粒。
2.4 溶出度與釋放度測定法修訂
新版藥典將二部中溶出度測定法和釋放度測定法整合為一個測定法。10年版藥典測定溶出度方法為籃法,漿法和小杯法,新版藥典新增漿碟法和轉筒法。實驗過程中如需要使用沉降裝置時,可將膠囊劑先裝入規定的沉降裝置內;品種項下未規定使用沉降裝置時,如膠囊劑浮于液面,新版藥典新增可用一小段耐腐蝕的細金屬絲輕繞與膠囊外殼。
2.5 含量均勻度檢查法修訂
新版藥典對含量均勻度的適用范圍作了調整,25 mg以下規格需做含量均勻度,25 mg規格及以上規格不需做含量均勻度。與2010年版比較,排除了25 mg的規格。結果判定也作了調整,A+2.2 S≤L,則供試品的含量均勻度符合規定,新版藥典要求更加嚴格。
3 討 論
中國藥典2015年版四部通則中收錄的特性檢查方法合并了10年版藥典一、二、三部的內容,不僅吸收了近幾年藥品檢測過程中總結的新理念、新方法,更提高了技術標準,檢測方法日趨規范完善,先進檢測技術應用不斷擴大,藥用輔料標準顯著提升,文字表述和實驗操作更加規范,對于保障藥品安全和質量把控有著明顯的提升。隨著藥品檢測實踐的不斷加深,藥典理論的不斷完善,藥典內容的不斷豐富,我國藥品質量控制水平必將進一步提高,中國藥典的影響力必將不斷增強。
4 結 語
綜上所述,在進行相關實驗前,檢驗人員應根據2015年版《中國藥典》(四部)通則中對特性檢查法部分新修訂的實驗方法和內容,更改以往的實驗習慣,應用新的檢查和測定方法,以符合其要求。
[1]錢 琛,陳 佳,陳桂良.《中國藥典》2015年版通則理化檢驗方法的修訂與淺析[J].中國醫藥工業雜志,2014,45(12):1195-1198.
[2]唐黎明.陳桂良.《中華人民共和國藥典(2015年版)》(四部)通則中有關生物測定部分的增、修訂情況介紹[J].專家論壇,2016,37(7):9-10.

