抗除草劑轉基因油菜與野芥菜的抗性回交3代子3代的適合度
閆靜,王曉蕾,張玉池,張慶玲,王建,強勝,宋小玲
(南京農業大學生命科學學院,南京 210095)
0 引言
【研究意義】隨著生物技術的發展,全球轉基因作物的種植面積從1996年的170萬公頃增至2016年的1.85億公頃,種植的國家已達26個。其中轉基因油菜(Brassica napus)的種植面積達到總面積的5%,主要種植國家為美國、加拿大、澳大利亞和智利[1]。商業化種植的轉基因油菜中主要性狀為抗草甘膦和草丁膦性狀。美國孟山都(Monsanto)公司將cp4 epsps和goxv247導入到油菜中,得到抗草甘膦轉基因油菜;杜邦公司將gat4621轉入油菜中獲得抗草甘膦油菜;拜耳公司將Bar和Pat導入油菜中,獲得抗草丁膦轉基因油菜;此外,該公司培育出抗溴苯腈(bromoxynil)的轉基因油菜(ISAAA數據庫)[2]。抗除草劑轉基因油菜的商業化種植在產生經濟效益的同時,也存在潛在的生態風險,包括轉基因油菜自生雜草化及抗性基因漂移,一旦發生雜草化或基因漂移,將會給農田雜草防除帶來很大困難。因此在轉基因油菜商業化釋放前對其潛在的生態風險進行長期跟蹤研究具有重要意義。【前人研究進展】由于油菜的落粒性和二次休眠強等特性,被認為是最容易發生雜草化的作物之一[3-4]。對于抗除草劑轉基因油菜而言,由于導入了抗除草劑基因,可能使其具有更強的環境適應能力,從而增加其演化為雜草的可能性[5]。目前已有多個抗除草劑轉基因油菜自生雜草化的報道[6-8]。油菜屬于異花授粉作物,其花粉可通過風媒、蟲媒等途徑傳播,并與野生近緣種雜交或回交,從而發生基因漂移。在田間條件下,轉基因油菜可以和蕪菁(B. rapa)[9-10]、芥菜(B.juncea)[11-12]、野蘿卜(Raphanus raphanistrum)[13-15]等野生近緣種自發雜交,且能產生攜帶抗性基因的雜交后代。在評估基因漂移的風險時,除評價轉基因作物和野生近緣種能否發生初始雜交外,攜帶抗性基因的雜交和回交后代的適合度(fitness)是抗性基因能否成功漂移至野生近緣種的另外一個重要評價內容[14,16-17]。適合度是指個體在特定環境下的生存和繁殖能力。轉基因逃逸是否會帶來生態風險,很大程度上取決于雜交或回交后代的適合度[18]。研究表明,轉基因作物與蕪菁[9-10,19-23]、芥菜[12]、野蘿卜[15,24-25]的雜交或回交后代都具有一定的適合度。其后代的適合度受親本基因組、基因型[26-27]和環境因素,如種植密度、競爭和選擇壓[28-31]等的影響。因此對后代適合度的研究要充分考慮各方面因素。在中國與轉基因油菜親緣關系最近的雜草是野芥菜(wildB. juncea)。野芥菜是西北地區和長江流域荒地及農田的重要雜草[32]。在自然條件下轉基因油菜和野芥菜能自發雜交[12,33-34],產生攜帶抗性基因的F1,雖然F1的花粉育性較低[12],但雜交后代可以與親本發生回交,且適合度隨回交代數的增加而提高[12,35-37],因此對轉基因油菜與野芥菜回交后代適合度的研究不容忽視。【本研究切入點】筆者實驗室前期研究了抗草甘膦[38]和抗草丁膦(待發表)轉基因油菜與野芥菜的抗性正反回交3代子1代和子2代的田間適合度,發現兩種抗除草劑轉基因油菜與野芥菜的抗性正反回交 3代子 1—2代的總適合度(composite fitness)在混種條件下存在差異。對抗草甘膦的正反回交3代子1—2代,除正反回交3代子1代在低密度4∶1混種比例下的總適合度,以及正反回交3代子1代在高密度3個混種比例下的總適合度顯著低于野芥菜外,其他情況下各回交后代的總適合度均與野芥菜相當。而抗草丁膦的正反回交3代子1—2代中,低密度混種時,在4∶1和3∶2比例下,只有BC3mF3的總適合度與野芥菜無顯著差異,在1∶1比例下,只有BC3mF2和BC3mF3的總適合度與野芥菜無顯著差異,其余情況下各后代的總適合度均顯著小于野芥菜;高密度混種時,3個比例下各回交后代的總適合度均顯著小于野芥菜。因此有必要對抗草甘膦和抗草丁膦的正反回交3代子3代田間適合度進行跟蹤研究。【擬解決的關鍵問題】在前期研究的基礎上,以攜帶抗草甘膦轉基因油菜和抗草丁膦轉基因油菜與野芥菜的抗性正反回交3代子3代為研究對象,在田間條件下研究這些回交后代單種和在與其雜草親本野芥菜混種下的適合度,為兩種抗除草劑轉基因油菜的抗性基因滲入野芥菜可能導致的生態后果提供長期的多世代的試驗數據,同時也為轉基因油菜的安全性評估提供可靠的理論依據。
1 材料與方法
1.1 試驗材料
野芥菜采集于南京江浦;抗草甘膦轉基因油菜(DS-Roughrider,Roundup Ready,event RT73)和抗草丁膦轉基因油菜(Swallow,Liberty Link,event HCN92)均來自加拿大。以野芥菜為母本,抗除草劑轉基因油菜為父本人工雜交獲得抗草甘膦和抗草丁膦的F1[34];以野芥菜為母本,F1或者抗性回交代為父本獲得正向回交 1、2、3 代(BC1mF1、BC2mF1、BC3mF1),以F1或者抗性回交代為母本,野芥菜為父本獲得反向回交 1、2、3 代(BC1pF1、BC2pF1、BC3pF1)[35],其中抗性BC3mF1與BC3pF1連續套袋自交和抗性篩選3代得到抗草甘膦的正反向回交3代子3代(BC3mF4R和BC3pF4R),以及抗草丁膦的正反向回交3代子3代(BC3mF4L和BC3pF4L),如圖1虛線內所表示的材料。

圖1 野芥菜和抗除草劑轉基因油菜雜交和回交框架圖Fig. 1 Crossing scheme of hybridization and backcross between wild Brassica juncea and transgenic herbicide-resistant B. napus
1.2 試驗方法
1.2.1 田間種植方法 2014年11月初將經過抗性篩選后存活下來的長勢良好、大小適中的植株幼苗移栽至試驗田。試驗采用的是裂區設計,把田塊均勻劃分為兩個主區,分別是抗草甘膦后代區和抗草丁膦后代區;在每個主區內劃分為單種和混種兩個副區;在單種副區內再分為低密度和高密度兩個密度副區,每個密度副區采用隨機區組設計;在混種副區內再劃分為低密度和高密度兩個副區,在每個密度副區內分別劃分出野芥菜∶回交后代比例為4∶1、3∶2和1∶1的3個混種比例副區,每個比例副區內采用隨機區組設計。低密度15株/區(1∶1比例時低密度是20株每/區,株距不變,面積擴大)和高密度 30株/區。低密度下,每一區種植3行×5列,高密度下,每一區種植6行×5列。混種種植方法見圖2。試驗重復3次,共108個小區。

圖2 野芥菜與回交后代混種時小區植株分布圖Fig. 2 Layout of field experiment in mixed plot
1.2.2 適合度成分測量 所測指標包括營養生長指標(株高、莖粗、一次分枝數、地上部單株干生物量)和生殖生長指標(單株有效角果數、單株種子質量、角果長、每角果飽粒數)。測定方法為株高:成熟后,用直尺測量地上基部到主莖最高處;莖粗:與株高測量同步進行,用直尺測量地上基部的直徑;一次分枝數:成熟后統計主莖上的分枝數目;地上部單株干生物量:成熟后測定每株的干生物量[12];單株有效角果數:單株所有的至少含有一粒飽滿或半飽種子的角果數;單株種子質量:每單株種子的總質量;角果長:每株選中下部20個角果測量其長度;每角果飽粒數:與角果長測量同步進行,統計20個角果內的飽滿種子數。統計每小區內的全部植株,計算平均值。
1.3 數據統計與分析
數據分析采用SPSS 19.0統計軟件進行。單種相同種植密度下,采用 Duncan復極差測驗(Duncan’s multiple range test)的方法,分析抗草甘膦或抗草丁膦的正反回交3代子3代和野芥菜的適合度成分及總適合度差異;混種條件下,采用配對樣本T檢驗的方法,分析同一種植密度和比例下抗草甘膦或抗草丁膦的回交后代與親本野芥菜的適合度成分和總適合度的差異。
各適合度成分的相對適合度值計算方法:以野芥菜為比較的標準“1”,相應回交后代的各項適合度成分與野芥菜的該適合度成分之比為相對適合度值,總適合度值是其各項適合度成分的相對適合度值的加權平均數[26,39],本試驗中總適合度=∑(各指標相對適合度值)/8。
運用SPSS 19.0中的雙因素方差分析,對各回交后代的適合度成分與混種時密度以及混種比例的相關性進行分析。
2 結果
2.1 單種條件下BC3F4與野芥菜的適合度成分比較
低密度單種條件下,野芥菜與供試的回交后代生長良好。兩種抗除草劑轉基因油菜與野芥菜的抗性正反回交3代子3代的營養生長指標株高、莖粗、一次分枝數和地上部單株干生物量分別在 151.33—158.01 cm、1.49—1.62 cm、15.07—17.66和 119.96—133.36 g,均與野芥菜無顯著差異;生殖生長指標有效角果、單株種子質量、角果長和每角飽粒數分別在1 297.63—1 362.42、25.74—26.68 g、3.42—3.52 cm 和 13.87—15.31粒,也均與野芥菜無顯著差異(表1)。
高密度單種條件下,BC3mF4R和BC3pF4R的各適合度成分及總適合度均已達到與野芥菜相當水平,但BC3mF4L和 BC3pF4L有部分適合度成分仍低于野芥菜,其中,BC3pF4L的株高顯著低于野芥菜19.22 cm;BC3mF4L和 BC3pF4L的莖粗也均顯著低野芥菜 0.30 cm和0.27 cm;且BC3mF4L和BC3pF4L的地上部單株干生物量和有效角果數都顯著低野芥菜 19.32 g和19.97 g、228.7和247.25(表1)。
2.2 混種條件下BC3F4與野芥菜的適合度成分比較
2.2.1 低密度混種條件下 BC3F4與野芥菜的適合度成分比較 由表2可知,4∶1混種條件下,BC3mF4R、BC3pF4R和BC3mF4L的各適合度成分與各自混種的野芥菜相比無顯著差異,但BC3pF4L的株高和莖粗顯著低于野芥菜的151.80 cm和1.56 cm。所有供試材料的一次分枝數和地上部單株干生物量均與各自混種的野芥菜無顯著差異;且其生殖生長指標有效角果、單株種子質量、角果長和每角飽粒數分別在 875.33—1 137.44、17.68—23.13 g、3.44—3.46 cm 和 13.55—14.49粒間,也均與各自混種的野芥菜無顯著差異。
3∶2混種條件下,所有供試材料的各適合度成分與野芥菜相比無顯著差異。營養生長指標株高、莖粗、一次分枝數和地上部單株干生物量分別在 134.15—145.00 cm、1.23—1.30 cm、12.23—13.40和 87.21—99.97 g;生殖生長指標有效角果、單株種子質量、角果長和每角飽粒數分別在 873.8—1118.3、17.43—21.56 g、3.38—3.58 cm和13.83—14.40粒。
1∶1混種條件下,所有供試材料的各適合度成分也與野芥菜相比無顯著差異,與3∶2混種條件下結論一致。營養生長指標株高、莖粗、一次分枝數和地上部單株干生物量分別在 144.00—147.73 cm、1.31—1.41 cm、12.82—15.33和100.67—113.63 g;生殖生長指標有效角果、單株種子質量、角果長和每角飽粒數分別為 1 048.73—1105.03、20.50—26.37 g、3.41—3.55 cm和13.63—14.93粒。
2.2.2 高密度混種條件下 BC3F4與野芥菜的適合度成分比較 由表3可知,3個比例混種條件下,BC3mF4R和 BC3pF4R的各適合度成分與野芥菜相比無顯著差異,其營養生長指標株高、莖粗、一次分枝數和地上部單株干生物量分別在 129.57—133.95 cm、1.07—1.19 cm、11.67—12.81和69.47—72.86 g;生殖生長指標有效角果、單株種子質量、角果長和每角飽粒數分別在 689.11—766.84、13.83—15.99 g、3.28—3.67 cm和13.04—15.08粒。
但BC3mF4L和BC3pF4L的各適合度成分中,除角果長和每角飽粒數外,其他各個適合度成分均顯著低于野芥菜的。株高在125.81—131.22 cm、莖粗在1.06—1.19 cm、一次分枝數在9.36—11.34,地上單株干生物量在 57.67—67.93 g,均顯著低于各自混種的野芥菜;有效角果數在 648.21—788.04,單株種子質量在13.30—14.74 g,均顯著低于野芥菜的 937.42—1 032.68和19.21—21.33 g。
2.3 單種和混種條件下BC3F4與野芥菜的總適合度比較
2.3.1 單種條件下 BC3F4與野芥菜的總適合度比較在單種兩種密度條件下,兩種轉基因油菜與野芥菜的抗性回交3代子3代的總適合度介于0.89—1.04,與野芥菜相比無顯著差異(圖 3),表明在無競爭狀態下,兩種抗除草劑的正反回交3代子3代的總適合度皆已達到與野芥菜相當的水平。

圖3 單種條件下BC3F4與野芥菜的總適合度Fig. 3 Composite fitness of BC3F4 and wild B. juncea under pure stands
2.3.2 混種條件下 BC3F4與野芥菜的總適合度比較由圖4可知,低密度3個混種條件下,兩種轉基因油菜與野芥菜的抗性正反回交3代子3代的總適合度介于 0.94—1.01,均與野芥菜無顯著差異,說明在低密度競爭種植條件下,兩種抗除草劑轉基因油菜與野芥菜的抗性正反回交3代子3代競爭力和野芥菜相當。
高密度3個比例混種條件下,抗草甘膦的正反回交3代子3代的總適合度在0.97—1.01,均與野芥菜無顯著差異;而抗草丁膦的正反回交3代子3代的總適合度在0.80—0.82,均顯著低于混種的野芥菜。
在高密度競爭條件下,抗草甘膦轉基因油菜與野芥菜的抗性正反回交3代子3代已達到與野芥菜相當的水平,但草丁膦轉基因油菜與野芥菜的抗性正反回交3代子3代的總適合度仍然顯著低于野芥菜,說明抗草甘膦的回交3代子3代比抗草丁膦的回交3代子3代存在更大的生態風險。
2.4 種植密度和混種比例對野芥菜和 BC3F4適合度成分的影響
由表4可知,種植密度(D)對抗草甘膦轉基因
油菜與野芥菜的抗性正反回交3代子3代以及野芥菜的有效角果數、地上部單株干生物量和單株種子質量有顯著影響,但混種比例(P)及密度與比例的互作(D×P)對其影響不顯著;抗草丁膦的正反回交3代子3代的所有適合度成分均受種植密度的影響,混種比例及密度與比例的互作對其影響不顯著。

表1 單種條件下BC3F4 與野芥菜的適合度成分的比較Table 1 Comparison of the fitness components of BC3F4 and wild B. juncea under pure stands

表2 低密度混種條件下BC3F4 與野芥菜適合度成分的比較Table 2 Comparison of the fitness component of BC3F4 and wild B. juncea under mixed stands at low density
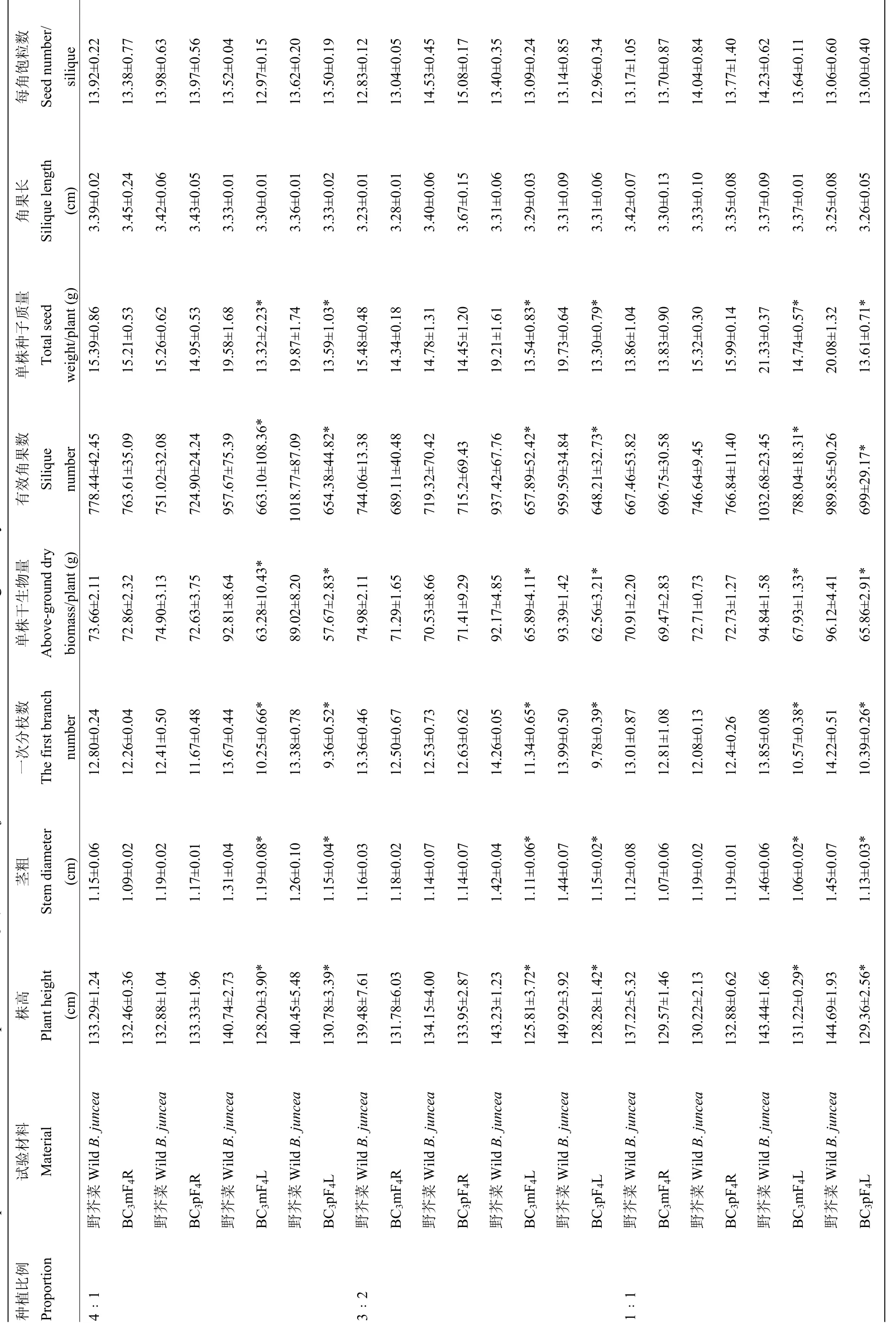
表3 高密度混種條件下BC3F4 與野芥菜適合度成分的比較Table 3 Comparison of the fitness componentsof BC3F4 and wild B. juncea under mixed stands at high density

表4 雙因素方差分析種植密度(D)和混種比例(P)對野芥菜和BC3F4各適合度成分的影響Table 4 Effect of plant density and proportion on the fitness components of wild B. juncea and BC3F4 under mixed stands by Two-way ANOVA

圖4 低密度和高密度混種條件下BC3F4與野芥菜的總適合度Fig. 4 Composite fitness of BC3F4 and wild B. juncea at low and high densities under mixed stands
由此可見,種植密度能夠顯著影響抗除草劑轉基因油菜與野芥菜的抗性正反回交3代子3代的主要適合度成分,且抗草甘膦的正反回交3代子3代比抗草丁膦的正反回交3代子3代具有更強的競爭力。
3 討論
抗除草劑轉基因作物的抗性基因如果漂移到野生近緣種中,攜帶抗性基因的后代在選擇壓下可能會提高其適合度[23,40-42]。適合度是衡量個體或種群在不同生境下的適應程度或者是個體對群體基因庫的相對貢獻程度,即特定基因型個體在同種生物群體中生存和繁殖后代的能力[18,43]。
轉基因作物與近緣種雜交或回交后代的適合度和親本基因型有關[26,44-45];且受環境因素的影響,如競爭[26]、種植密度[21,23]和環境壓力[23,31]。本試驗結果表明,在單種條件下,無論是低密度還是高密度,抗草甘膦和抗草丁膦的正反回交3代子3代均已達到與野芥菜相當的水平,這說明它們在田間環境下有較強的生存能力。前期研究表明兩種轉基因油菜的抗性回交3代子1代和子2代的總適合度也與野芥菜相當,因此單種條件下回交3代子1—3代的總適合度都具有和野芥菜相當的生存定植能力。這說明防范轉基因作物與近緣種間的基因漂移一定要防范 F1與近緣種之間的回交。
在低密度3個比例混種條件下,抗草甘膦和抗草丁膦轉基因油菜與野芥菜的抗性正反回交3代子3代的總適合度均與野芥菜無顯著差異;但在高密度3個比例混種條件下,抗草甘膦轉基因油菜與野芥菜的抗性正反回交3代子3代的總適合度與野芥菜無顯著差異,而抗草丁膦轉基因油菜與野芥菜的抗性正反回交3代子3代的總適合度顯著低于野芥菜。前期研究表明,在低密度混種條件下,4∶1比例種植時抗草甘膦的正反回交3代子1代的總適合顯著低于野芥菜[38];4∶1和3∶2比例種植時,抗草丁膦的正反回交3代子1代和反向回交3代子2代的總適合度均顯著低于野芥菜;1∶1比例種植時,抗草丁膦的反向回交3代子1代和子2代的總適合度也顯著低于野芥菜。隨著自交代數的增加,兩種抗除草劑的回交3代子3代均能達到與野芥菜相當的水平。在高密度3種比例種植條件下,抗草甘膦的正反回交3代子1代的總適合度顯著低于野芥菜,隨著自交代數的增加,抗草甘膦的正反回交3代子2代和子3代均達到與野芥菜相當的水平[38];但抗草丁膦的正反回交3代子1—3代的總適合度始終顯著低于野芥菜(待發表)。
由上述可知,抗草甘膦的回交后代比抗草丁膦的回交后代存在更大的生態風險,這一結論通過相關性分析可以證實。相關性分析結果表明,抗草甘膦的正反回交3代子3代的一次分枝數、角果長和每角飽粒數與種植密度相關性不顯著,但抗草丁膦的正反回交3代子3代的所有適合度指標均與種植密度顯著相關。
導致抗草丁膦后代和抗草甘膦后代在競爭條件下的適合度不同,可能的原因是親本基因型不同。HUANGFU等[27]研究了4種不同地理種群野芥菜與抗草甘膦轉基因油菜雜交后代的花粉育性和結實量,發現不同種群的雜交后代間存在顯著差異;鄭愛琴等[36]研究了抗草甘膦和抗草丁膦轉基因油菜與野芥菜的F1與5種常規栽培油菜的回交1代,發現這5種回交1代的適合度存在差異。本研究中所用的抗草甘膦轉基因油菜和抗草丁膦轉基因油菜的基因型不同,可能是導致兩種轉基因油菜與野芥菜的抗性回交3代子3代適合度不同的原因之一。因此,對轉基因油菜與野生近緣種雜交和回交后代的研究應該考慮親本基因型的影響。
轉基因油菜與近緣種的雜交后代可以不斷自交或與野生近緣種回交,使得抗性后代的染色體越來越接近野生近緣種甚至與野生近緣種相同,因此后代的適合度也會不斷提高。這在轉基因油菜與蕪菁的回交后代中[10]以及轉基因油菜與野蘿卜的雜交和回交后代中[24-25,46]得到證實。理論上講,轉基因油菜和野芥菜的回交后代的染色體數量應該是變化的,且變化范圍介于20(2A)+ 8(B)+ 0-8(B)+ 0-9(C)之間。C染色體由于在減數分裂過程中沒有同源染色體配對而隨著代數的增加趨于逐漸丟失[19],因此隨著回交或自交次數的增加,后代染色體趨于穩定,適合度也應不斷提高。本試驗中,抗草甘膦后代適合度提高的速度較抗草丁膦的后代快,這也可能是由于抗草甘膦基因位于 A-染色體組,而抗草丁膦基因位于 C-染色體組。如果抗草丁膦基因位于C-染色體上,在草丁膦選擇壓下 C-染色體被保留在回交后代中,導致抗草丁膦后代的 C-染色體丟失速度較慢,因此適合度提高較慢,但這一推論還有待進一步研究證實。因此對外源基因的插入位點也要綜合考慮到適合度評價研究中。
MERCER等[26]研究發現,在與小麥競爭條件下,抗磺酰脲類轉基因向日葵(Helianthus annuus)和野生向日葵的 F1種子量顯著低于在無競爭條件下的種子量;HALFHILL等[47]研究發現,在與小麥競爭條件下,轉Bt油菜與蕪菁的回交2代子1代的單株干生物量顯著低于在無競爭條件下的單株干生物量;SIMARD等[29]研究表明,抗草甘膦基因、抗草丁膦基因和抗咪唑啉酮的3種轉基因油菜之間自發產生的抗2種除草劑的雜交后代在與小麥競爭條件下的種子量僅達到在無競爭條件下的64%;HAUSER等[22]研究了在6個混種比例及單種條件下,甘藍型油菜與蕪菁的雜交及回交后代的適合度,發現混種條件下回交1代和兩親本的結實量低于單種條件下的結實量。本試驗中,僅在高密度混種條件下,抗草丁膦的正反回交3代子3代的總適合度顯著低于野芥菜,在單種無競爭條件下,其適合度與野芥菜無顯著差異。由此可見,本試驗設置的競爭只對抗草丁膦的正反回交3代子3代產生了顯著影響。盡管如此,由于抗草丁膦的正反回交3代子3代在高密度競爭條件下仍可以結出 600多個有效角果,且每個角果都可以產生近13粒飽滿種子,這就意味著單株植物可以產生7 800粒種子,因此抗草甘膦基因和抗草丁膦基因向野芥菜的基因逃逸風險同樣都不可忽視。
油菜在高密度條件下的結實量會降低[48-49];種植密度也對轉基因作物與近緣種的雜交或回交后代的適合度有影響。HAUSER等[22]研究了在3種種植密度及單種條件下甘藍型油菜與蕪菁的雜交及回交后代的適合度,發現低密度條件下的結實量較高;JOHANNESSEN等[50]證實提高種植密度能降低油菜和蕪菁 F1的有效角果數、單株產量和地上部干生物量。本試驗中,抗草丁膦的正反回交3代子3代在低密度條件下的適合度與野芥菜相當,但在高密度條件下的適合度顯著低于野芥菜,說明提高種植密度會降低抗草丁膦回交后代的適合度。
選擇壓對后代適合度也有顯著影響,VACHER等[23]發現轉Bt油菜與蕪菁的F1在無蟲壓條件下比蕪菁少產生 6.4倍種子,而在高蟲壓條件下比蕪菁多產生 1.4倍種子;LONDO等[31]研究了抗草甘膦轉基因油菜與蕪菁的回交1代的單株生物量和種子數量,發現在漂移的草甘膦選擇壓下,攜帶抗草甘膦基因的回交后代相對于不攜帶抗性基因的后代適合度明顯提高。本試驗是在自然田間條件下進行的,尚未研究草甘膦或草丁膦不同劑量選擇壓對適合度的影響,因此,供試后代在不同劑量除草劑選擇壓下的適合度還待進一步深入研究。
轉基因油菜與近緣雜草回交后代種子的擴散是轉基因油菜逃逸的一種重要途徑[5,51],因此種子在不同環境下的萌發能力是決定其逃逸的重要因素。筆者研究室在溫室測定了這些后代的出苗率,發現出苗率與野芥菜均無顯著差異,可達90%以上,但對回交3代子3代的種子在不同環境下的萌發能力還有待進一步研究。
4 結論
抗草甘膦或抗草丁膦的正反回交3代子3代都具有在野外生存定植的可能性,且抗草甘膦的回交3代子3代比抗草丁膦的回交3代子3代的可能性更大。因此,在防范轉基因作物的基因逃逸時不僅要防范轉基因作物與近緣雜草的初始雜交,而且要防范雜交后代與近緣雜草的不斷回交,以免產生適合度較高的回交后代。
[1] 國際農業生物技術應用服務組織. 2016年全球生物技術/轉基因作物商業化發展態勢. 中國生物工程雜志, 2017, 37(4): 1-8.International Service for the Acquisition of Agri-biotech Applications.The global commercialization of biotech crops/transgenic crop in 2016.China Biotechnology, 2017, 37(4): 1-8. (in Chinese)
[2] International Service for the Acquisition of Agri-biotech Applications.http://www.isaaa.org/gmapprovaldatabase/advsearch/default.asp?Crop ID=2&TraitTypeID=1&DeveloperID=Any&CountryID=Any&Appro valTypeID=Any[EB/OL]. [2017-09-26].
[3] WARWICK S I, STEWART C N. Crops come from wild plants: how domestication, transgenes, and linkage together shape ferality.Crop Ferality and Volunteerism, 2005, 36(1): 9-30.
[4] LéGèRE A. Risks and consequences of gene flow from herbicideresistant crops: canola (Brassica napusL.) as a case study.Pest Management Science, 2005, 61: 292-300.
[5] PANDOLFO C E, PRESOTTO A, CARBONELL F T, URETA S,POVERENE M, CANTAMUTTO M. Transgenic glyphosate-resistant oilseed rape (Brassica napus) as an invasive weed in Argentina:detection, characterization, and control alternatives.Environment Science and Pollution Research, 2016, 23: 24081-24091.
[6] YOSHIMURA Y, BECKIE H J, MATSUO K. Transgenic oilseed rape along transportation routes and port of Vancouver in western Canada.Environment Biosafety Research, 2006, 5(2): 67-75.
[7] KNISPEL A L, MCLACHLAN S M, VAN ACKER R C, FRIESEN L F. Gene flow and multiple herbicide resistance in escaped canola populations.Weed Science, 2008, 56: 72-80.
[8] SCHAFER M G, ROSS A, LONDO J P, BURDICK C, LEE E H,TRAVERS S E, VAN DE WATER P K, SAGERS C L. The establishment of genetically engineered canola populations in the U.S.PLoS ONE, 2011, 6(10): e25736.
[9] J?RGENSEN R B, ANDERSEN B. Spontaneous hybridization between oilseed rape (Brassica napus) and weedyB. campestris(Brassicaceae): a risk of growing genetically modified oilseed rape.American Journal of Botany, 1994, 81(12): 1620-1626.
[10] SNOW A A, ANDERSEN B, J?RGENSEN R B. Costs of transgenic herbicide resistance introgressed fromBrassica napusinto weedyB.rapa.Molecular Ecology, 1999, 8(4): 605-615.
[11] BING D J, DOWNEY R K, RAKOW G F W. Hybridizations amongBrassica napus,B. rapaandB. junceaand their two weedy relativesB.nigraandSinapis arvensisunder open pollination conditions in the field.Plant Breeding, 1996, 115: 470-473.
[12] LIU Y B, WEI W, MA K P, DARMENCY H. Backcrosses toBrassica napusof hybrids betweenB. junceaandB. napusas a source of herbicide-resistant volunteer-like feral populations.Plant Science,2010, 179(5): 459-465.
[13] EBER F, CHèVRE A M, BARANGER A, VALL6E P, TANGUY X,RENARD M. Spontaneous hybridization between a male-sterile oilseed rape and two weeds.Theoretical and Applied Genetics, 1994,88: 362-368.
[14] DARMENCY H, LEFOL E, FLEURY A. Spontaneous hybridizations between oilseed rape and wild radish.Molecular Ecology, 1998, 7(11):1467-1473.
[15] GUERITAINE G, SESTER M, EBER F, CHèVRE A M,DARMENCY H. Fitness of backcross six of hybrids between transgenic oilseed rape (Brassica napus) and wild radish (Raphanus raphanistrum).Molecular Ecology, 2002, 11(8): 1419-1426.
[16] HALL L, TOPINKA K, HUFFMAN J, DAVIS L, GOOD A. Pollen flow between herbicide-resistantBrassica napusis the cause of multiple-resistantB. napusvolunteers.Weed Science, 2000, 48:688-694.
[17] AONO M, WAKIYAMA S, NAGATSU M, KANEKO Y,NISHIZAWA T, NAKAJIMA N, TAMAOKI M, KUBO A, SAJI H.Seeds of a possible natural hybrid between herbicide-resistantBrassica napusandBrassica rapadetected on a riverbank in Japan.Genetically Modified Crops, 2011, 2(3): 201-210.
[18] JENCZEWSKI E, RONFORT J, CHèVRE A M. Crop-to-wild gene flow, introgression and possible fitness effects of transgenes.Environmental Biosafety Research, 2003, 2: 9-24.
[19] MIKKELSEN T R, ANDERSEN B, JORGENSEN R B. The risk of crop transgene spread.Nature, 1996, 380: 31.
[20] HAUSER T P, SHAW R G, ?STERG?RD H. Fitness of F1hybridsbetween weedyBrassica rapaand oilseed rape (B. napus).Heredity,1998, 81(4): 429-435.
[21] HAUSER T P, J?RGENSEN R B, ?STERG?RD H. Fitness of backcross and F2hybrids between weedyBrassica rapaand oilseed rape (B. napus).Heredity, 1998, 81(4): 436-443.
[22] HAUSER T P, DAMGAARD C, J?RGENSEN R B. Frequencydependent fitness of hybrids between oilseed rape (Brassica napus)and weedyB. rapa(Brassicaceae).American Journal of Botany, 2003,90(4): 571-578.
[23] VACHER C, WEIS A E, HERMANN D, KOSSLER T, YOUNG C,HOCHBERG M E. Impact of ecological factors on the initial invasion ofBttransgenes into wild populations of birdseed rape (Brassica rapa).Theoretical and Applied Genetics, 2004, 109: 806-814.
[24] CHèVRE A M, EBER F, BARANGER A, RENARD M. Gene flow from transgenic crops.Nature, 1997, 389(6654): 924.
[25] CHèVRE A M, EBER F, BARANGER A, HUREAU G, BARRET P,PICAULT H, RENARD M. Characterization of backcross generations obtained under field conditions from oilseed rape-wild radish F1interspecific hybrids: an assessment of transgene dispersal.Theoretical and Applied Genetics, 1998, 97(1/2): 90-98.
[26] MERCER K L, ANDOW D A, WYSE D L,WYSE D L, SHAW R G.Stress and domestication traits increase the relative fitness of crop-wild hybrids in sunflower.Ecology Letters, 2007, 10: 383-393.
[27] HUANGFU C, QIANG S, SONG X. Performance of hybrids between transgenic oilseed rape (Brassica napus) and wildBrassica juncea: An evaluation of potential for transgene escape.Crop Protection, 2011,30(1): 57-62.
[28] CAMPBELL D R, WASTER N M. Genotype-by-environment interaction and the fitness of plant hybrids in the wild.Evolution, 2001,55(4): 669-676.
[29] SIMARD M J, LéGèRE A, SéGUIN-SWARTZ G, NAIR H,WARWICK S. Fitness of double vs. single herbicide-resistant canola.Weed Science, 2005, 53: 489-498.
[30] CAMPBELL L G, SNOW A A, RIDLEY C E. Weed evolution after crop gene introgression: greater survival and feeundity of hybrids in a new environment.Ecology Letters, 2006, 9: 1198-1209.
[31] LONDO J P, BAUTISTA N S, SAGERS C L, LEE E H, WATRUD L S. Glyphosate drift promotes changes in fitness and transgene gene flow in canola (Brassica napus) and hybrids.Annals of Botany, 2010,106(6): 957-965.
[32] HUANGFU C H, SONG X L, QIANG S. ISSR variation within and among wildBrassica junceapopulations: implication for herbicide resistance evolution.Genetic Resources and Crop Evolution, 2009,56(7): 913-924.
[33] 浦惠明, 戚存扣, 張潔夫, 傅壽仲, 高建芹, 陳新軍, 陳松, 趙祥祥.轉基因抗除草劑油菜對近緣作物的基因漂移. 生態學報, 2005,25(3): 581-588.PU H M, QI C K, ZHANG J F, FU S Z, GAO J Q, CHEN X J, ZHAO XX. Studies on the gene flow from herbicide-tolerant GM rapeseed to its close relative crops.Acta Ecologica Sinica, 2005, 25(3): 581-588.(in Chinese)
[34] 宋小玲, 皇甫超河, 強勝. 抗草丁膦和抗草甘膦轉基因油菜的抗性基因向野芥菜的流動. 植物生態學報, 2007, 31(4): 729-737.SONG X L, HUANGFU C H, QIANG S. Gene flow from glufosinate or glyphosate-tolerant oilseed rape to wild rape.Journal of Plant Ecology, 2007, 31(4): 729-737. (in Chinese)
[35] SONG X L, WANG Z, ZUO J, HUANGFU C H, QIANG S. Potential gene flow of two herbicide-tolerant transgenes from oilseed rape to wildB. junceavar.gracilis.Theoretical and Applied Genetics, 2010,120(8): 1501-1510.
[36] 鄭愛琴, 強勝, 宋小玲. 抗除草劑轉基因油菜與野芥菜的雜交1代與 5種常規栽培油菜回交后代的適合度. 應用與環境生物學報,2014, 20(3): 337-344.ZHENG A Q, QIANG S, SONG X L. Fitness of backcross between F1(wildB. juncea× herbicide-resistant transgenic oilseed rape) and 5 conventional cultivate varieties.Chinese Journal of Applied and Environmental Biology, 2014, 20(3): 337-344. (in Chinese)
[37] LIU Y B, DARMENCY H, JR STEWART C N, WEI W, TANG Z X,MA K P. The effect ofBt-transgene introgression on plant growth and reproduction in wildBrassica juncea.Transgenic Research, 2015,24(3): 537-547.
[38] 張慶玲, 王建, 強勝, 王曉蕾, 閆靜, 伏建國, 宋小玲. 抗草甘膦轉基因油菜與野芥菜回交3代子1代和子2代的適合度研究. 南京農業大學學報, 2017, 40(3): 434-443.ZHANG Q L, WANG J, QIANG S, WANG X L, Yan J, Fu J G, Song X L. Fitness of BC3F2and BC3F3between glyphosate-resistant transgenic oilseed rape and wildBrassica juncea.Journal of Nanjing Agricultural University, 2017, 40(3): 434-443. (in Chinese)
[39] RIEGER M A, LAMOND M, PRESTON C, POWLES S B, ROUSH R T. Pollen-mediated movement of herbicide resistance between commercial canola fields.Science, 2002, 296(5577): 2386-2388.
[40] HAYGOOD R, IVES A R, ANDOW D A. Consequences of recurrent gene flow from crops to wild relatives.Proceedings of the Royal Society of London B: Biological Sciences, 2003, 270: 1879-1886.
[41] MOON H S, HALFHILL M D, GOOD L L, RAYMER P L, JR STEWART C N. Characterization of directly transformed weedyBrassica rapaand introgressedB. rapawithBt cry1Acandgfpgenes.Plant Cell Reports, 2007, 26: 1001-1010.
[42] WANG W, XIA H, YANG X, XU T, SI HJ, CAI XX, WANG F, SU J,SNOW A A, LU B R. A novel 5-enolpyruvoylshikimate-3-phosphate(EPSP) synthase transgene for glyphosate resistance stimulates growth and fecundity in weedy rice (Oryza sativa) without herbicide.New Phytologist, 2014, 202: 679-688.
[43] WILKINSON M, TEPFER M. Fitness and beyond: preparing for the arrival of GM crops with ecologically important novel characters.Environmental Biosafety Research, 2009, 8: 1-14.
[44] LANDBO L, J?RGENSEN R B. Seed germination in weedyBrassica campestrisand its hybrids withB. napus: Implications for risk assessment of transgenic oilseed rape.Euphytica, 1997, 97(2):209-216.
[45] ROACH D A, WULFF R D. Maternal effects in plants.Annual Review of Ecology and Systematics, 1987, 18: 209-235.
[46] CHèVRE A M, ADAMEZYK K, EBER F, HUTEAU V, CORITON O,LETANNEUR J C, LAREDO C, JENCZEWSKI E, MONOD H.Modelling gene flow between oilseed rape and wild radish. Ⅰ.Evolution of ehromosome strueture.Theoretieal and Applied Geneties,2007, 114: 209-221.
[47] HALFHILL M D, SUTHERLAND J P, MOON H S, POPPY G M,WARWICK S, WEISSINGER A, RUFTY T, RAYMER P L, Jr STEWART C N. Growth, productivity, and competitiveness of introgressed weedyBrassica rapahybrids selected for the presence of Btcry1Acandgfptransgenes.Molecular Ecology, 2005, 14(10):3177-3189.
[48] 馬霓, 張春雷, 李俊, 李光明. 種植密度對直播油菜結實期源庫關系及產量的調節. 中國油料作物學報, 2009, 31(2): 180-184.MA N, ZHANG C L, LI J, LI G M. Regulation of planting density on source-sink relationship and yield at seed-set stage of rapeseed(Brassica napusL.).Chinese Journal of Oil Crop Sciences, 2009,31(2): 180 -184. (in Chinese)
[49] 邵留東. 不同播期條件下種植密度對油菜生長發育及產量的影響[D]. 武漢: 華中農業大學, 2009.SHAO L D. Effects of planting density on the development and yield of rapeseed (Brassica napusL.) under different sowing dates[D].Wuhan: Huazhong Agricultural University, 2009. (in Chinese)
[50] JOHANNESSEN M M, DAMGAARD C, ANDERSEN B A,J?RGENSEN R B. Competition affects the production of first backcross offspring on F1-hybrids,Brassica napus×B. rapa.Euphytica, 2006, 150: 17-25.
[51] DEVOS Y, HAILS R S, MESSéAN A, PERRY J N, SQUIRE G R.Feral genetically modified herbicide tolerant oilseed rape from seed import spills: are concerns scientifically justified?Transgenic Research, 2012, 21(1): 1-21.

