木材細胞壁結構及其流變特性研究進展*
李安鑫 呂建雄 蔣佳荔
(中國林業科學研究院木材工業研究所 國家林業局木材科學與技術重點實驗室 北京 100091)
流變學(rheology)主要研究材料在應力/應變、溫度、濕度等條件下與時間因素有關的變形規律和機制,以研究材料的黏彈性為主要內容。木材是一種生物高分子聚合物材料,其對應力的響應同時體現彈性固體和黏性流體的雙重特性,即黏彈性。木材黏彈性主要研究木材在應力作用下所發生的與時間因素有關的變形規律和機制,以蠕變研究為典型代表。蠕變是在恒定應力作用下木材應變隨時間增加而增大的現象,木材發生蠕變時時,其質際承載結構是細胞壁,細胞壁的壁層構造和化學組分對木材宏觀黏彈行為有著極其重要的影響(Salménetal., 2009; Navietal., 2009)。Eder等(2006)首次聯合利用厚度為200 μm的木材組織切片和單根纖維拉伸技術,分別從組織和細胞壁水平上揭示了S2層微纖絲角對木材力學松弛行為的影響。Zhang等(2012)首次采用原位納米壓痕技術研究了木材細胞壁的黏彈行為。此外,對于木材單根纖維(本文特指針葉材的管胞和闊葉材的木纖維)而言,深入了解其黏彈性及濕熱軟化機制,對于實現木纖維/塑料復合材料的高效設計具有重要意義,并可為高效節能的制漿造紙工藝設計提供科學依據。因此,將木材流變學研究從宏觀引向微觀尺度,從細胞壁水平上揭示木材結構與黏彈性之間的關系及其影響因子,才能真正掌握木材黏彈行為的作用機制。然而,在我國木材科學領域,目前關于細胞壁水平的木材黏彈行為研究較少,尤其是圍繞細胞壁結構與黏彈性關系的系統研究更少。
鑒于此,本文從歸納木材細胞壁構造和化學組分的最新研究成果入手,圍繞微纖絲角和化學組分對木材細胞壁黏彈行為的影響規律與作用機制進行綜述,總結開展木材細胞壁黏彈性研究的測試方法和技術手段,并且提出今后進一步開展這方面工作的建議與設想。
1 木材細胞壁結構
1.1 細胞壁S2層超微構造
微纖絲在細胞壁各層的沉積主要取決于細胞的幾何尺寸、纖維素分子鏈的數量以及微纖絲之間的橫向距離(Emonsetal., 1998; 2000)。由于S2層最厚,占細胞壁質量的80%以上,其對木材宏觀性質具有決定性影響,因此S2層一直是木材細胞壁結構研究的關鍵與熱點。
隨著現代顯微技術的不斷發展,透射電子顯微鏡(TEM)、原子力顯微鏡(AFM)和小角X-射線散射儀(SAXS)的應用,木材細胞壁S2層的超微構造逐漸被揭示。人們認識到,細胞壁纖維素聚集體(cellulose aggregate)的尺寸分布范圍為3.5~30 nm(Fahlénetal., 2003; 2005; Bardageetal., 2004; Jungnikletal., 2007),平均尺寸為16~20 nm,具有吸濕性,與水分子作用會引起橫向尺寸發生較大變化,因此可推測纖維素聚集體內存在部分結晶的纖維素或無定形的半纖維素(Salménetal., 2006a)。Andersson等(2015)研究了銀杏(Ginkgobiloba)木材沿髓心至樹皮方向細胞壁S2層纖維素的微晶尺寸分布,結果發現纖維素微晶的平均寬度為3.1~3.2 nm,長度為27.5~30.0 nm。?kerholm等(2001; 2003)利用動態傅里葉紅外光譜(FTIR)證明了針葉材的纖維素與葡甘露聚糖之間存在緊密連接,在外力作用下2個組分的分子性能顯示二者之間有較強的交互作用。Joseleau(2007)研究表明,對于闊葉材,半纖維素包括低取代度的木聚糖和高取代度的木聚糖2種類型,其中低取代度的木聚糖首先沉積于微纖絲上并與之形成緊密連接,從而增加了微纖絲的聚合度。Bardage等(2004)利用快速冷凍和深度蝕刻技術(RFDE)揭示了針葉材管胞S2層的微纖絲沿細胞軸向呈波浪形聚集態分布,相鄰的纖維素聚集體之間形成紡錘形狀,其橫向直徑為3~14 nm(圖1),證實了之前Boyd(1982)所提出的木材細胞壁微纖絲排列呈紡錘狀的設想。正是根據S2層的這種結構特點,可以對“濕熱處理或脫部分Matrix物質(全部由半纖維素和木質素組成)處理會引起纖維素聚合度增加”(Duchesneetal., 2000; Hultetal., 2001; Fahlénetal., 2003)的現象做出解釋: 沿細胞壁軸向,纖維素聚集體之間被Matrix物質填充,經過破壞半纖維素的濕熱處理和脫Matrix物質處理后,相鄰纖維素聚集體之間的距離減小、接觸面積增大,從而使纖維素聚合度增加(Salmén, 2006)。關于纖維素聚集體的空間排列方式,目前的觀點認為是沿細胞軸向呈同心圓的層狀排列(Fahlénetal., 2005; Salménetal., 2006a)。
諸多研究表明,木材細胞壁S2層中不同類型木質素是以特定方式與不同種類的半纖維素相結合的(Lawokoetal., 2005; Joseleauetal., 2005)。Joseleau等(2005)采用免疫標記法研究了位于纖維素聚集體之間的Matrix中半纖維素和木質素的結構排列,在細胞壁形成的不同階段,觀察到了非縮合型木質素(包括愈創木基結構和紫丁香基結構)、縮合型木質素(愈創木基結構)和多種木聚糖的沉積,提出了“縮合型木質素和低取代度木聚糖的早期沉積會將Matrix與纖維素聚集體更緊密地聯系在一起”的觀點。Lawoko等(2005)對云杉(Piceaasperata)的木質素-碳水化合物復合體(LCC)進行了化學分析,發現高縮合型木質素與葡甘露聚糖之間、低縮合型木質素與木聚糖之間均存在化學連接。對于闊葉材,低取代度木聚糖在纖維素與縮合型木質素之間起連接作用,而高取代度木聚糖與非縮合型木質素之間的結合更為緊密。對于針葉材,低取代度木聚糖的位置被葡甘露聚糖取代,如圖1所示。至于纖維素聚合體內部的半纖維素與微纖絲之間是否存在交聯作用以及交聯的方式,目前仍不清楚(Terashimaetal., 2004)。由此可見,木材細胞各化學組分之間的連接與相互作用極其復雜,其共同決定了細胞壁的物理力學性能(Salménetal., 1998)。
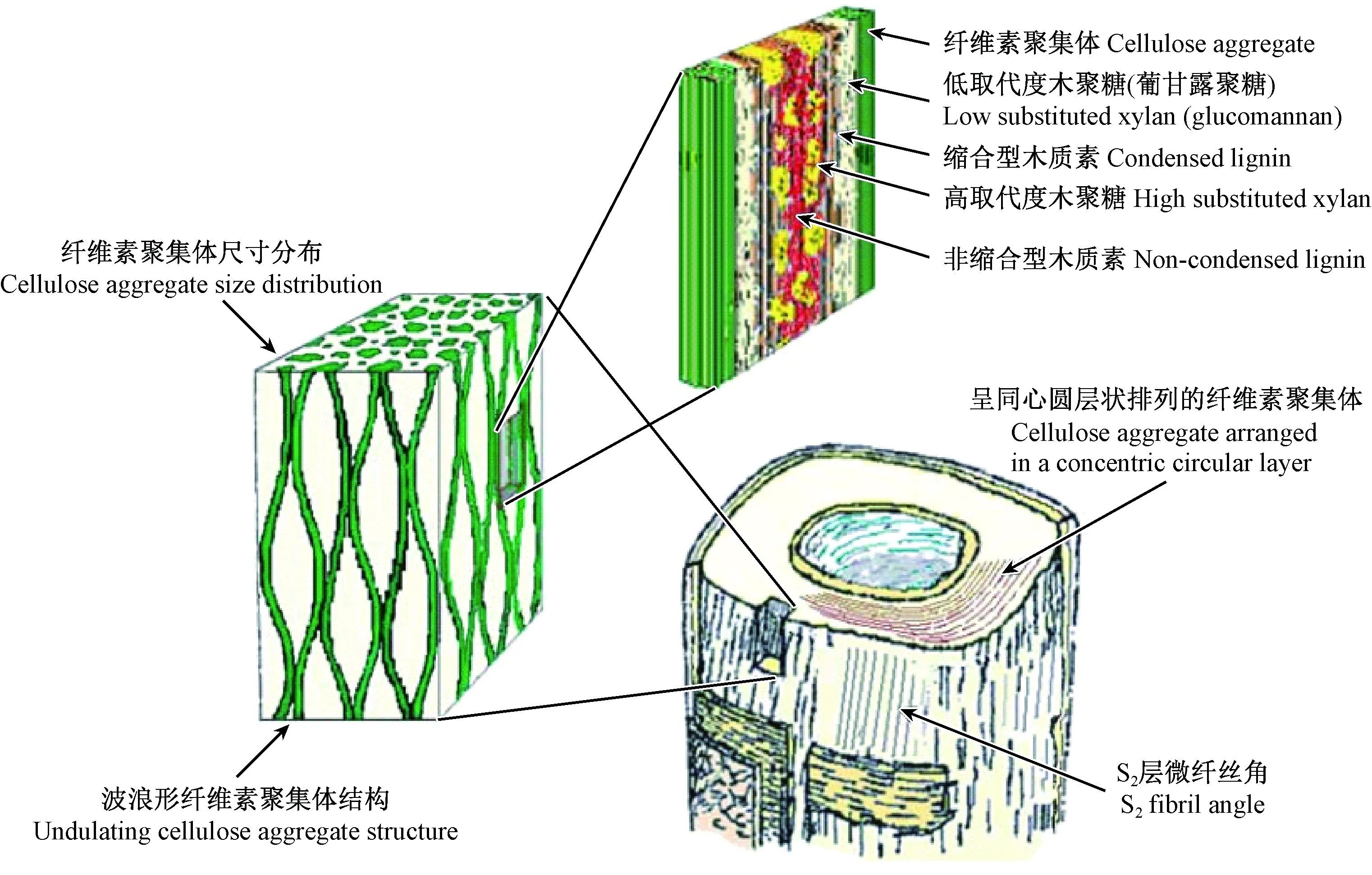
圖1 針葉材管胞壁結構示意 (Salmén et al., 2009)Fig.1 Schematic illustration of tracheid wall structure of softwood
1.2 細胞壁的化學組分
木材細胞壁主要由纖維素、半纖維素和木質素構成。針對單個細胞而言,可視為由微纖絲(全部由纖維素構成)與Matrix(全部由木質素和半纖維素構成)組成。對于纖維素,過去30年來研究取得的最大進展是對其Iα和Iβ晶型結構的認識(Atallaetal., 1984)。迄今為止,關于2種晶型結構的差異是否會對纖維素的力學性質產生影響仍不清楚。據報道,結晶纖維素的剛度約為134 GPa(Nishinoetal., 1995); 然而,纖維素作為細胞壁的骨架物質,其有效剛度仍亟待研究。此外,對于纖維素聚集體的結晶度與剛度之間的關系也亟待闡明。對于半纖維素和木質素,由于處于分離狀態和原位狀態時其分子結構和空間排列均存在很大差異,因此,木材細胞壁半纖維素和木質素單一組分的力學參數測定有賴于細胞壁原位測試技術的進步(Salménetal., 2009)。Takeichi等(2013)利用原位測試技術獲得日本柳杉(Cryptomeriajaponica)細胞壁木質素的拉伸彈性模量為2.8 GPa。
纖維素、半纖維素和木質素之間的鍵合方式對木材細胞壁性能有重要影響。迄今為止,未發現纖維素與木質素之間存在直接交聯。而具有雙親性的半纖維素: 一方面,通過氫鍵與纖維素之間建立物理連接; 另一方面,與木質素之間既存在物理連接,同時也存在化學連接(酯鍵、醚鍵、苷鍵等共價鍵)。Westbye等(2007)研究證實了木質素與木聚糖之間通過共價鍵連接,揭示了木聚糖同時沉積于木質素和纖維素表面。有研究指出,葡甘露聚糖的脫除,能增強木質素與纖維素之間的交聯,可揭示木質素對細胞壁軸向剛度的貢獻(Salménetal., 2016)。由此可見,木材細胞壁是通過半纖維素將剛性的、親水性的纖維素與黏性的、疏水性的木質素聯系在一起,從而維持細胞壁的整體性(圖1)。
2 木材細胞壁的黏彈性
圍繞木材細胞壁黏彈性的研究,考察的對象主要有3類: 1) 拉伸模式下厚度不大于200 μm的組織切片(Kojimaetal., 2004; 2005; Roszyketal., 2010; 2012); 2) 拉伸模式下的單根纖維(Ederetal., 2006; Dongetal., 2010; Olssonetal., 2014); 3) 單個細胞壁橫截面的原位壓痕(Zhangetal., 2012; Mengetal., 2015)。所涉及的研究內容主要是從材料內因(微纖絲角、化學組分)和環境外因(主要是水分)2個角度探討木材細胞壁黏彈性的響應機制。本文分別以“細胞壁S2層微纖絲角”和“細胞壁的化學組分”對木材細胞壁黏彈性的影響為主線,同時將水分通過改變細胞壁結構進而影響其黏彈性的研究結果穿插其中,歸納了近年來木材細胞壁流變學的研究進展和取得的主要結論。
2.1 細胞壁S2層微纖絲角
細胞壁S2層微纖絲角對木材細胞壁的蠕變行為有顯著影響。諸多研究表明,木材細胞壁縱向拉伸蠕變變形量隨著微纖絲角的增加而增大(Kojimaetal., 2004; 2005; Dongetal., 2010; Roszyketal., 2010; 2012)。可通過木材細胞壁的復合結構理論來解釋這一現象: 木材細胞壁可視為由Matrix與纖維素微纖絲構成,其中,Matrix全部由半纖維素和木質素構成,其黏性大,對木材細胞壁的蠕變變形起主要貢獻; 而纖維素微纖絲具有高剛度,包裹于Matrix中,作為其增強相存在。當微纖絲角很小時,微纖絲沿細胞軸向的剛度分量大,制約了Matrix沿軸向的蠕變變形; 隨著微纖絲角增大,微纖絲沿細胞軸向的剛度分量減小,即對Matrix沿軸向蠕變變形的約束力減弱,使得木材細胞的軸向蠕變變形量增加(Engelundetal., 2011; Roszyketal., 2013)。
微纖絲角不同是造成早材與晚材、幼齡材與成熟材、應力木與正常材之間蠕變存在差異的主要原因(Dongetal., 2010; Brémaudetal., 2013; Sharmaetal., 2015)。Dong等(2010)研究了挪威云杉(Piceaabies)早材與晚材、成熟材與幼齡材的單根纖維蠕變行為,結果表明: 早材的微纖絲角比晚材大,早材的蠕變變形量大于晚材; 幼齡材的微纖絲角大于成熟材,是幼齡材蠕變變形量較大的原因。Roszyk等(2012)研究了歐洲赤松(Pinussylvestris)蠕變變形量與微纖絲角之間的關系,揭示了當微纖絲角為10°~18°時,蠕變變形量與微纖絲角之間呈線性正相關; 當微纖絲角高于18°時,蠕變變形量顯著增大。Brémaud等(2013)比較研究了正常材和應壓木的動態剛度與阻尼性質,證實了應壓木的微纖絲角大于正常材,使得前者具有較低的動態剛度和較高的阻尼。圍繞微纖絲角對應力木與正常材細胞壁應力松弛行為的影響,Eder等(2006)以挪威云杉應壓木和正常材為試驗材料,聯合利用厚度為200 μm的木材組織切片和單根纖維拉伸技術開展應力松弛測定,揭示了與具有較小微纖絲角(10°~20°)的正常材組織切片及單根纖維相比,具有較大微纖絲角(40°~ 45°)的應壓木組織切片和單根纖維的應力松弛行為更顯著。
此外,木材細胞壁的水分變化也會引起微纖絲角發生改變,進而影響細胞壁的蠕變行為。諸多研究表明,木材細胞壁縱向拉伸蠕變變形量隨著平衡含水率的增加而增大(Kojimaetal., 2005; Roszyketal., 2010; 2012; Engelundetal., 2012)。原因在于: 當水分子進入木材細胞壁時,會切斷細胞壁聚合物分子之間的氫鍵連接,進而與非結晶纖維素、半纖維素和木質素的羥基、羧基、羰基等極性基團之間形成新的氫鍵。一方面,加大了分子鏈之間的距離,“自由體積”增加,使得分子鏈的延展性增強; 另一方面,Matrix發生各向同性的吸濕潤脹,會對微纖絲產生橫向作用力,引起微纖絲角增大,促使微纖絲與Matrix之間發生剪切滑移,最終使得細胞壁的軸向蠕變變形量增加(Navietal., 2002; Placetetal., 2007; Engelundetal., 2011; Tobaetal., 2013)。Kojima等(2005)以日本柳杉早材組織切片為研究對象,在不同微纖絲角條件下探討了纖維飽和點以下的平衡含水率對細胞壁縱向拉伸蠕變性能的影響,結果表明: 當微纖絲角很小(12.0°)時,含水率增加對細胞壁縱向拉伸蠕變的影響甚微,這是因為此時的微纖絲對Matrix發生縱向吸濕潤脹的束縛力大,制約了細胞壁的縱向蠕變變形; 當微纖絲角增大(20.4°,29.8°、44.1°)時,微纖絲對Matrix發生縱向吸濕潤脹的約束力減弱,此時含水率增加會引起細胞壁縱向拉伸蠕變變形量明顯增大。
當木材細胞壁中的水分處于動態變化時,在恒定外力下所產生的蠕變變形量比同載荷高平衡含水率下的蠕變變形量要大得多,這就是機械吸濕蠕變現象(Olssonetal., 2007; 2014; Dongetal., 2010; Roszyketal., 2010; Violaineetal., 2015)。當發生機械吸濕蠕變時,木材往往在較低的應力水平、較短的時間內就發生破壞。然而,關于木材單根纖維是否存在機械吸濕蠕變現象曾存在爭議: Sedlachek等(1994; 1995)以采用化學分離法獲得的木材單根纖維為研究對象,沒有觀察到機械吸濕蠕變現象; Salmén等(2006b)、Navi等(2006)和Meylan(2006)通過機械分離法獲得了細胞次生壁中天然化學組分保持完整的木材單根纖維(Burgertetal., 2005),蠕變試驗結果表明, 單根纖維在相對濕度循環變化條件下的蠕變變形量要比在高恒定相對濕度下的蠕變變形量明顯增大,從而證明了木材單根纖維具有機械吸濕蠕變效應。由此可認為,單根纖維是否存在機械吸濕蠕變現象取決于纖維的分離方式。Roszyk等(2010)在7%~25%含水率范圍內研究了微纖絲角對木材組織切片軸向機械吸濕蠕變的影響,結果發現: 當微纖絲角為12°~18°時,機械吸濕蠕變變形量差異很小; 當微纖絲角超過18°時,機械吸濕蠕變變形量隨微纖絲角的增大明顯增加。此外,隨著微纖絲角增大,細胞壁的彈性變形稍有降低,而塑性變形顯著增加,這說明微纖絲角的變化主要影響木材機械吸濕蠕變的塑性變形部分。
2.2 細胞壁的化學組分
木材細胞壁的纖維素、半纖維素、木質素以及抽提物的性質及其在細胞壁中的作用均存在較大差異,分別研究其在細胞壁中的相對含量、分布方式、結構特點與木材細胞壁黏彈性之間的關系,有利于從本質上認識木材黏彈性的發生和演變機制。
木材單根纖維受縱向拉伸時,細胞壁中的纖維素為主要承載物質,其在細胞各壁層的取向與結晶度對細胞壁的彈性有顯著影響(Berganderetal., 2003)。Gierlinger等(2006)利用拉曼光譜技術分析了縱向拉伸過程中單根纖維細胞壁內部分子鍵的變形情況,發現纖維素的特征峰發生了明顯偏移,而木質素的特征峰未發生明顯變化,從而證實了纖維素是木材單根纖維縱向拉伸時的主要承載物質,對細胞壁的縱向剛度起決定作用。類似地,Salmén等(2004)通過動態傅里葉紅外光譜技術揭示了細胞壁主要通過纖維素的C—O—C骨架震動來承載和抵抗縱向變形。此外,纖維素結晶區的寬度對細胞壁的阻尼性質有較大影響(Horietal., 2002)。有研究指出,半纖維素和木質素也可以增加細胞壁的剛性,但貢獻度低于纖維素(Schelleretal., 2010; Salménetal., 2016)。
木材細胞壁的黏性主要由木質素和半纖維素共同決定,尤其是細胞壁的橫向性能(Berganderetal., 2003; Salmén, 2004; Sharmaetal., 2015)。木質素含量、類型或性質的不同會引起木材細胞壁黏彈性的差異,例如,與正常材相比,應壓木具有較高的縮合型木質素含量,因此后者的阻尼僅為前者的66%(Brémaudetal., 2013)。Sharma等(2015)研究指出,木質素和木聚糖的含量對應壓木的阻尼性質有顯著影響。在有水分參與的情況下,由于木質素和半纖維素的吸濕能力不同,二者對木材細胞壁黏彈性的影響存在差異: 木質素的吸濕性弱,受水分影響小,隨著脫木質素程度的增加,細胞壁中的吸著點增加,吸濕能力增強,使得機械吸濕蠕變明顯增大(Zhangetal., 2006a; 2006b; 2007; Olssonetal., 2014); 半纖維素的吸濕性強,木聚糖和葡甘露聚糖的部分脫除對木材單根纖維機械吸濕蠕變的影響不顯著(Olssonetal., 2014),但完全脫除半纖維素會引起木材單根纖維機械吸濕蠕變顯著降低(Fioravantietal., 2006; Navietal., 2009)。
此外,近年來的一些研究指出,細胞壁中的抽提物會影響其黏彈性,引起細胞壁的剛性增加、黏滯性降低,對于細胞壁的濕熱軟化是不利因素(Bagetal., 2011; Songetal., 2014)。
3 木材細胞壁黏彈性的測試技術
動態力學分析技術(DMA)和納米壓痕技術(nanoindentation)的發展,為從組織切片、單根纖維和細胞壁原位測定等不同層次上研究木材結構與黏彈性之間的關系提供了新的技術手段。
利用動態力學分析技術可以實現組織切片或單根纖維的軸向拉伸,獲得動態或靜態黏彈性參數。當單根纖維受到拉伸作用時,基于細胞壁S2層中的微纖絲沿細胞軸呈“Z螺旋型”取向(Meylanetal.,1978),微纖絲往往會沿軸向發生旋轉,引起細胞壁中的分子變形(Salménetal., 2004; Gierlingeretal., 2006)。具體表現(圖2)為: 在拉伸應力作用下,細胞壁S2層的微纖絲角變小(MFA1< MFA0),同時,纖維素分子鏈中2個葡萄糖分子之間的“C—O—C”鍵被拉長(L1>L0)。聯合利用單根纖維拉伸技術和光譜分析技術(偏光顯微鏡、激光共聚焦顯微鏡、X-射線散射/衍射技術等),可以從微纖絲角、晶格和分子鍵的變化等方面揭示細胞壁在軸向拉伸過程中黏彈性變形的演變機制和分子機制(Kamiyamaetal., 2005; K?llnetal., 2005; Marjanetal., 2007; Peuraetal., 2007; Thygesenetal., 2007)。
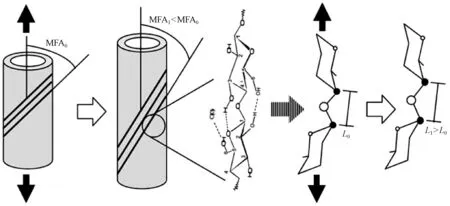
圖2 拉伸應力下細胞壁S2層微纖絲C—O—C鍵的分子變形示意 (Salmén et al., 2009)Fig.1 Schematic illustration of molecular deformation of C—O—C bridge in microfibril in S2 layer of cell wall under tensile stress
近年來,利用納米壓痕技術可以實現在亞微米水平下直接測量木材細胞壁的黏彈性質(Zhangetal., 2012; Mengetal., 2015),主要內容包括靜態恒定應力作用下的蠕變現象及動態交變應力作用下的滯后現象和力學損耗。Zhang等(2012)利用納米壓痕技術測定了苦油楝(Carapaprocera)木材細胞壁蠕變柔量與時間的關系曲線、貯存模量和損耗因子與載荷頻率的關系曲線,揭示了木材細胞壁的蠕變速率與應力水平呈正相關,壓痕深度與載荷頻率對木材細胞壁的貯存模量和損耗因子有顯著影響。Meng等(2015)采用配備環境濕度控制裝置的納米壓痕儀測定了火炬松(Pinustaeda)木材細胞壁在不同平衡含水率(0%、6%、18%和110%)下的蠕變行為,并分別利用Burgers模型和Maxwell模型對蠕變曲線進行擬合分析,揭示了木材細胞壁的蠕變柔量隨著平衡含水率的增加而增大,闡明了水分所引起的細胞壁結構變化對其蠕變性能的影響。
4 總括與科學問題
隨著微觀力學表征技術的不斷發展,有關木材細胞壁結構與黏彈性關系的研究也在逐漸深化。然而總體來看,目前國內圍繞木材細胞壁流變學的研究尚未系統開展; 國際上近20年在該領域取得的最突出進展僅為: 微纖絲角對木材細胞壁黏彈性影響的顯著性不斷被研究者所證實(Salménetal., 2009)。根據上述關于木材細胞壁結構及其流變學的研究現狀分析,綜合學科發展和研究趨勢,本文提出一些亟待解決的科學問題和深化研究的建議。
木材細胞壁黏彈性宏觀性能是細胞壁微觀分子結構的反映,準確認識和掌握木材細胞壁結構才能對其黏彈行為的發生和演變機制做出合理解釋。因此,圍繞木材細胞壁結構的深化研究,應集中在: 1) 釋明木材細胞生長過程中的微纖絲取向、纖維素結晶區與非結晶區比例的分子控制機制; 2) 闡明木材細胞壁次生壁Matrix的空間組織排列方式、纖維素聚合體與Matrix之間相互作用的力學行為表達; 3) 揭示木材細胞壁中半纖維素的含量、種類以及木質素類型對細胞壁黏彈性的影響機制。在此基礎上,將環境外因(溫度、濕度)和載荷類型(靜態/動態、拉/壓/彎)納入研究體系,系統揭示“濕-熱-力”協同作用下木材細胞壁的機械吸濕蠕變行為規律和響應機制。另外,多種測試技術手段的聯合運用,相關學科研究方法及理論模型的引入,如有限元法和復合材料的研究方法的應用,構建可以解釋木材細胞壁黏彈特性的物理和數學模型,也勢在必行。
?kerholm M, Salmén L. 2001. Interactions between wood polymers studied by dynamic FT-IR spectroscopy. Polymer, 42(3): 963-969.
?kerholm M, Salmén L. 2003. The oriented structure of lignin and its viscoelastic properties studied by static and dynamic FT-IR spectroscopy. Holzforschung, 57(5): 459-465.
Andersson S, Wang Y, P?nni R,etal. 2015. Cellulose structure and lignin distribution in normal and compression wood of the maidenhair tree (GinkgobilobaL.). Journal of Integrative Plant Biology, 57(4): 388-395.
Atalla R H, VanderHart D L. 1984. Native cellulose: a composite of two distinct crystalline forms. Science, 223(4633): 283-285.
Bag R, Beaugrand J, Dole P,etal. 2011. Viscoelastic properties of woody hemp core. Holzforschung, 65(2): 239-247.
Bardage S, Donaldson L, Tokoh C,etal. 2004. Ultrastructure of the cell wall of unbeaten norway spruce pulp fibre surfaces. Nordic Pulp and Paper Research Journal, 19(4): 448-482.
Bergander A, Salmén L. 2003. Cell wall properties and their effects on the mechanical properties of fibers. Radiation Protection Dosimetry, 103(2): 103-109.
Boyd J D. 1982. An anatomical explanation for visco-elastic and mechano-sorptive creep in wood, and effects of loading rate on strength∥New perspectives in wood anatomy. Springer Netherlands, 171-222.
Brémaud I, Ruelle J, Thibaut A,etal. 2013. Changes in viscoelastic vibrational properties between compression and normal wood: role of microfibril angle and of lignin. Holzforschung, 67(1): 75-85.
Burgert I, Eder M, Frühmann K,etal. 2005. Properties of chemically and mechanically isolated fibres of spruce (Piceaabies[L.] Karst.). Part 3: Mechanical characterisation. Holzforschung, 59(3): 354-357.
Dong F, Olsson A M, Salmén L. 2010. Fibre morphological effects on mechano-sorptive creep. Wood Science and Technology, 44(3): 475-483.
Duchesne I, Daniel G. 2000. Changes in surface ultrastructure of Norway spruce fibres during kraft pulping-visualization by field emission-SEM. Nordic Pulp and Paper Research Journal, 15(1): 54-61.
Eder M, Burgert I, Stanzl-Tschegg S. 2006.Relaxation experiments on wood fibres and tissues.Proceedings of the Third International Conference of the European Society of Wood Mechanics, 141-147.
Emons A M C, Mulder B M. 1998. The making of the architecture of the plant cell wall: how cells exploit geometry. Proceedings of the National Academy of Sciences, 95(12): 7215-7219.
Emons A M, Mulder B M. 2000. How the deposition of cellulose microfibrils builds cell wall architecture. Trends in Plant Science, 5(1): 35-40.
Engelund E T, Svensson S. 2011. Modelling time-dependent mechanical behaviour of softwood using deformation kinetics. Holzforschung, 65(2): 231-237.
Engelund E T, Salmén L. 2012. Tensile creep and recovery of norway spruce influenced by temperature and moisture. Holzforschung, 66(8): 959-965.
Fahlén J, Salmén L. 2003. Cross-sectional structure of the secondary wall of wood fibers as affected by processing. Journal of Materials Science, 38(1): 119-126.
Fahlén J, Salmén L. 2005. Pore and matrix distribution in the fibre wall revealed by atomic force microscopy and image analysis. Biomacromolecules, 6(1): 433-438.
Fioravanti M, Sodini N, Navi P. 2006. Investigation of the influence of hemicelluloses on time dependent behaviour of wood. Proceedings of the International Conference on Integrated Approach to Wood Structure, Behaviour and Application, 190-195.
Gierlinger N, Schwanninger M, Reinecke A,etal. 2006. Molecular changes during tensile deformation of single wood fibers followed by Raman microscopy. Biomacromolecules, 7(7): 2077-2081.
Hori R, Müller M, Watanabe U,etal. 2002. The importance of seasonal differences in the cellulose microfibril angle in softwoods in determining acoustic properties. Journal of Materials Science, 37(20): 4279-4284.
Hult E L, Larsson P T, Iversen T. 2001. Cellulose fibril aggregation-an inherent property of kraft pulps. Polymer, 42(8): 3309-3314.
Joseleau J P, Ruel K. 2005. Deposition of hemicelluloses and lignins during secondary wood cell wall assembly. New Knowledge in Wood Quality, 103-113.
Joseleau J P. 2007. Micro-scale approaches for wood cell wall analysis and structure∥Entwistle K, Harris P, Walker J. The compromised wood workshop Univ. Canterbury, ISBN 0-473-12768-8, 113-124.
Jungnikl K, Paris O, Fratzl P,etal. 2007. The implication of chemical extraction treatments on the cell wall nanostructure of softwood. Cellulose, 15(3): 407-418.
Kamiyama T, Suzuki H, Sugiyama J. 2005. Studies of the structural change during deformation inCryptomeriajaponicaby time-resolved synchrotron small-angle X-ray scattering. Journal of Structural Biology, 151(1): 1-11.
Kojima Y, Yamamoto H. 2004. Effect of microfibril angle on the longitudinal tensile creep behavior of wood. Journal of Wood Science, 50(4): 301-306.
Kojima Y, Yamamoto H. 2005. Effect of moisture content on the longitudinal tensile creep behavior of wood. Journal of Wood Science, 51(5): 462-467.
K?lln K, Grotkopp I, Burghammer M,etal. 2005. Mechanical properties of cellulose fibres and wood. Orientational aspects in situ investigated with synchrotron radiation. Journal of Synchrotron Radiation, 12(6): 739-744.
Lawoko M, Henriksson G, Gellerstedt G. 2005. Structural differences between the lignin-carbohydrate complexes present in wood and in chemical pulps. Biomacromolecules, 6(6): 3467-3473.
Marjan S G, Navi P. 2007. Experimental observations and micromechanical modeling of successive-damaging phenomenon in wood cells’ tensile behavior. Wood Science and Technology, 41(1): 69-85.
Meylan B A, Butterfield B G. 1978. Helical orientation of the microfibrils in tracheids, fibres and vessels. Wood Science and Technology, 12(3): 219-222.
Meylan B. 2006. Characterization and modeling of the thermo-hydro-mechanical behavior of isolated wood fibres. Master thesis in Material and Science and Engineering, Ecole Poly-technique Fédérale de Lausanne, Lausanne, Switzerland.
Meng Y, Xia Y, Young T M,etal. 2015. Viscoelasticity of wood cell walls with different moisture content as measured by nanoindentation. RSC Advances, 5: 47538-47547.
Navi P, Pittet V, Plummer C J G. 2002. Transient moisture effects on wood creep. Wood Science and Technology, 36(6): 447-462.
Navi P, Meylan B, Plummer C J G. 2006. Role of hydrogen bonding in wood stress relaxation under humidity variation. In International Conference on Integrated Approach to Wood Structure, Behavior and Application, Joint Meeting of ESWM and COST Action E35.
Navi P, Stefanie S T. 2009. Micromechanics of creep and relaxation of wood. A review cost action E35 2004—2008: wood machining-micromechanics and fracture. Holzforschung, 63(2): 186-195.
Nishino T, Takano K, Nakamae K. 1995. Elastic modulus of the crystalline regions of cellulose polymorphs. Journal of Polymer Science Part B: Polymer Physics, 33(11): 1647-1651.
Olsson A M, Salmén L, Eder M,etal. 2007. Mechano-sorptive creep in wood fibres. Wood Science and Technology, 41(1): 59-67.
Olsson A M, Salmén L. 2014. Mechano-sorptive creep in pulp fibres and paper. Wood Science and Technology, 48(3): 569-580.
Peura M, K?lln K, Grotkopp I,etal. 2007. The effect of axial strain on crystalline cellulose in Norway spruce. Wood Science and Technology, 41(7): 565-583.
Placet V, Passard J, Perré P. 2007. Viscoelastic properties of green wood across the grain measured by harmonic tests in the range 0-95 C: hardwood vs. softwood and normal wood vs. reaction wood. Holzforschung, 61(5): 548-557.
Roszyk E, Moliński W, Jasińska M. 2010. The effect of microfibril angle on hygromechanic creep of wood under tensile stress along the grains. Wood Research, 55(3): 13-24.
Roszyk E, Mania P, Moliński W. 2012. The influence of microfibril angle on creep of scotch pine wood under tensile stress along the grains. Wood Research, 57(3): 347-358.
Roszyk E, Kwiatkowski T, Moliński W. 2013. Mechanical parameters of pine wood in individual annual rings under tensile stress along the grains in dry and wet state. Wood Research, 58(4): 571-580.
Salmén L, Olsson A M. 1998. Interaction between hemicelluloses,lignin and cellulose:structure-property relationships. Journal of Pulp and Paper Science, 24(3): 99-103.
Salmén L. 2004. Micromechanical understanding of the cell-wall structure. Comptes Rendus Biologies, 327(9): 873-880.
Salmén L, ?kerholm M, Hinterstoisser B. 2004. Two-dimensional Fourier transform infrared spectroscopy applied to cellulose and paper. Polysaccharides: Structural Diversity and Functional Versatility, 159-187.
Salmén L. 2006. Ultra-structural arrangement and rearrangement of the cellulose aggregates within the secondary cell wall. Proceedings of the Fifth Plant Biomechanics Conference, STFI-Packforsk, Stockholm, 215-220.
Salmén L, Fahlén J. 2006a. Reflections on the ultrastructure of softwood fibres. Cell Chem Technol, 40:181-185.
Salmén L, Olsson A M, Eder M,etal. 2006b. Role of hydrogen bonding in wood stress relaxation under humidity variation. Proceedings of International Conference on Integrated Approach to Wood Structure, Behaviour and Application, Joint Meeting of ESWM and COST Action E35, 87-91.
Salmén L, Burgert I. 2009. Cell wall features with regard to mechanical performance. A review COST Action E35 2004—2008: wood machining-micromechanics and fracture. Holzforschung, 63(2): 121-129.
Salmén L, Stevanic J S, Olsson A M. 2016. Contribution of lignin to the strength properties in wood fibres studied by dynamic FTIR spectroscopy and dynamic mechanical analysis (DMA).Holzforschung, 70(12): 1155-1163.
Scheller H V, Ulvskov P. 2010. Hemicelluloses. Annual Review of Plant Physiology, 61(1): 263-289.
Sedlachek K M, Ellis R L. 1994. The effect of cyclic humidity on the creep of single fibres of southern pine. Moisture-induced Creep Behaviour of Paper and Board, STFI USDA Stockholm, 22-49.
Sedlachek K M. 1995. The effect of hemicelluloses and cyclic humidity on the creep of single fibres. PhD thesis, Institute of Paper Science and Technology, Atlanta, University of Georgia Tech, Atlanta, GA, USA.
Sharma M, Brennan M, Chauhan S S,etal. 2015. Wood quality assessment ofPinusradiatasaplings by dynamic mechanical analysis. Wood Science and Technology, 49(6): 1239-1250.
Song K, Yin Y, Salmén L,etal. 2014. Change in the properties of wood cell walls during the transformation from sapwood to heartwood. Journal of Material Science, 49(4): 1734-1742.
Takeichi Y, Yoshida M, Kitano K,etal. 2013. In situ measurement of tensile elastic moduli of individual component polymers with a 3D assembly mode in wood cell walls. Journal of Wood Science, 59(2): 104-111.
Terashima N, Awano T, Takabe K,etal. 2004. Formation of macromolecular lignin in ginkgo xylem cell walls as observed by field emission scanning electron microscopy. Comptes Rendus Biologies, 327(9): 903-910.
Thygesen L G, Eder M, Burgert I. 2007. Dislocations in single hemp fibres—investigations into the relationship of structural distortions and tensile properties at the cell wall level. Journal of Materials Science, 42(2): 558-564.
Toba K, Yamamoto H. 2013. On the mechanical interaction between cellulose microfibrils and matrix substances in wood cell wall: effects of chemical pretreatment and subsequent repeated dry-and-wet treatment. Journal of Wood Science, 59(5): 359-366.
Violaine G-R, Cisse O, Placet V,etal. 2015. Creep behaviour of single hemp fibres. Part Ⅱ: Influence of loading level, moisture content and moisture variation. Journal of Materials Science, 50(5): 2061-2072.
Westbye P, K?hnke T, Glasser W,etal. 2007. The influence of lignin on the self-assembly behavior of xylan rich fractions from birch (Betulapendula). Cellulose, 14(6): 603-613.
Zhang W, Tokumoto M, Takeda T,etal. 2006a. Effects of delignifying treatments on mechano-sorptive creep of wood Ⅰ: instantaneous and total compliance of radial specimens. Journal of the Japan Wood Research Society, 52(1): 19-26.
Zhang W, Tokumoto M, Takeda T,etal. 2006b. Effects of delignifying treatments on mechano-sorptive creep of wood Ⅲ: MS creep of longitudinal specimens. Journal of the Japan Wood Research Society, 52(1): 206-214.
Zhang W, Tokumoto M, Takeda T. 2007. Effects of temperature on mechano-sorptive creep of delignified wood. Journal of Wood Science, 53(3): 187-191.
Zhang T, Bai S L, Zhang Y F,etal. 2012. Viscoelastic properties of wood materials characterized by nanoindentation experiments. Wood Science and Technology, 46(5): 1003-1016.

