酶生物傳感器在農殘檢測中的應用
王 虹 王 軍
(江蘇警官學院公安科技系,江蘇 南京 210031)
農藥常被廣泛地應用于抵抗病蟲災害、清除雜草、提高產量。食用受到農藥污染的蔬菜、水果而造成的急性中毒事件[1]、食品出口過程中因農藥殘留超標導致退貨的國際貿易事件[2]、與農藥中毒有關的自殺案件、投毒案件、意外事故也時常出現[3,4]。對農藥進行分析檢測,其檢測結果對判斷中毒原因和案件的性質至關重要。
農藥檢測的常規方法有氣相色譜法[5]、液相色譜法[6]、色譜-質譜法[7,8]、光譜分析[9,10]等。這些方法雖然具有高準確度、高精確度,但需要較長的前處理時間,不能進行現場快速檢測并獲得檢測結果。隨著生物技術和微電子技術的發展,生物傳感器在農藥殘留檢測中則體現出實時快速、簡單便攜和低成本的分析優勢,因此頗受關注[11,12]。本文介紹了酶生物傳感器的分類、酶的固定技術,比較了電化學型酶生物傳感器、光學型及壓電型酶生物傳感器的應用領域、檢測限和優缺點。
1酶生物傳感器
酶生物傳感器(Enzymatic Biosensor,EBS)是指將酶與特定的載體或電極結合并將酶促反應的產物信息(如物質濃度變化、光熱反應等)經過能量轉換器變為電信號輸出的一種裝置[13]。 根據酶與物質反應機理不同,酶生物傳感器一般可以分為膽堿酯酶傳感器(CHE)和有機磷水解酶傳感器(OPH)[14]。
根據酶生物傳感器制作過程中的信號轉換器的不同,又可將其分為電化學型生物傳感器、光學型生物傳感器、壓電晶體生物傳感器等[15],其中電化學型生物傳感器最為常見,按電極反應方式不同分為電位型、電流型(安培型)、電位-電流型以及隨著微電子技術發展起來的離子選擇性場效應晶體管型(ISFET)[16]。
電化學型EBS的能量轉換器即電化學電極,識別元件則為酶活性材料。由于反應在電極周圍即完成,故它既有電化學電極響應快、操作簡便的特點,又有酶的特異性識別和選擇性催化功能,因此在傳感領域發展最早,研究內容最豐富,應用范圍也最為廣泛。
光導纖維EBS由光導纖維、酶分子識別元件及檢測器構成[17]。它是依據酶選擇性識別待檢測物質,催化反應,并伴隨可檢測的磷光、熒光、拉曼光、化學發光和生物發光等光變化,通過檢測器檢測到待檢測物質濃度[18]。
石英晶體微天平(QCM)依據壓電石英晶體諧振測量技術,早期主要用于檢測氣體有機物和無機物[19],后來發展到壓電石英晶體EBS。Abad等[20]將固定有乙酰膽堿酯酶(AChE)的晶體電極浸沒在3-吲哚乙酸組織培養基中,來測量對氧磷和西維因,檢測限分別可達5.0×10-8和1.0×10-7mol/L。
2檢測食品中農殘常用的酶生物傳感器
圖1所示為傳感器基本構成,其核心部件是分子識別元件和能量轉換器。在酶生物傳感器中識別元件即為固定化的酶,可以識別待測物質催化反應,引起的物質的量的變化或光熱的變化即經信號轉換后用于檢測。因此酶的固定技術可以說是酶生物傳感器制作中最重要的一項技術。
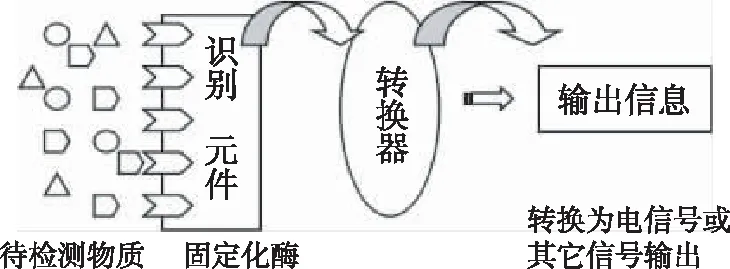
圖1 生物傳感器構成示意圖Fig 1 sketch drawing of biosensor
2.1 酶固定技術
酶的固定技術是將酶和載體或者電極結合,使酶能夠集中在一定空間范圍內與待測物質進行催化反應的方式。酶的固定方法會影響酶的穩定性、反應靈敏性和使用壽命等。一般酶固定方法有吸附法、交聯法、共價鍵結合法、包埋法等[21]。
吸附法較為簡單,有物理吸附和化學吸附兩種。優點在于操作簡單,且酶活力損失較小,但是這種固定方法酶易脫落,不夠穩定。在絲網印刷電極表面乙酰膽堿酯酶(AChE) 的固定中會用到這種方法[22]。
交聯法是由酶分子間或分子內通過交聯劑作用發生交聯反應,而形成不溶于水的網狀結構,這樣的網狀結構輕薄且易吸附,會附著在一些固體的表面從而使酶得到固定[23]。這種酶固定方法穩定性好,響應快,但酶活性中心易失活所以重復性較差。
共價鍵結合法是酶的側鏈基團和電極表面發生反應形成共價鍵而相互結合從而使酶得到固定的方法。參加共價結合反應的不能是酶的活性中心,否則會使酶的活性大大降低。這種固定方法由于發生了化學反應故穩定牢固,酶分子不易脫落,使用壽命長,但是化學修飾和激烈的反應可能使酶活性降低,且操作復雜,成本較高。
包埋法是通過物理方法將酶分子包埋在高分子聚合物形成的三維空間網狀結構基質中得以固定。與共價鍵結合法不同,這種方法一般不產生化學修飾,故很少改變酶的高級結構,對酶活性影響較小。缺點是分子量大的底物在凝膠網格內擴散較固難。光纖型EBS的制作中常用這種方法來固定酶,在電流型EBS制作中也常見到[23]。
酶的固定方法各有優點和不足,應該結合具體的酶生物傳感器類型、固定的基質性質及傳感器作用方式來確定選擇合適的固定方法來提高性能。在實際應用中,有時會把兩種固定方法結合起來使用以優勢互補獲得更好的性能。例如將吸附和交聯法結合,通過交聯網狀結構的穩定性來克服吸附法中酶易從載體漏失或脫落的問題,增強了酶的穩定性[24]。
2.2 電化學型酶生物傳感器
電化學型酶生物傳感器是目前應用最為廣泛的一種酶生物傳感器。隨著研究進展它又分為多個不同的分支種類,表1列出了幾種類型電化學型酶生物傳感器的制作方式及檢測限。在制作方式、檢測限、重復性、反應時間以及線性范圍方面均有不同。
傳統電位型EBS在檢測農藥殘留方面發展最早,它制作簡單、靈敏度較高、響應快、線性范圍寬、重復性較好,且易于實現自動化、基本無需對待測樣品做前處理。但相對而言傳統pH電極直接檢測的精密度不高、工作曲線也不是很穩定、電極壽命短,因此逐漸被其他類型電化學型EBS所取代。
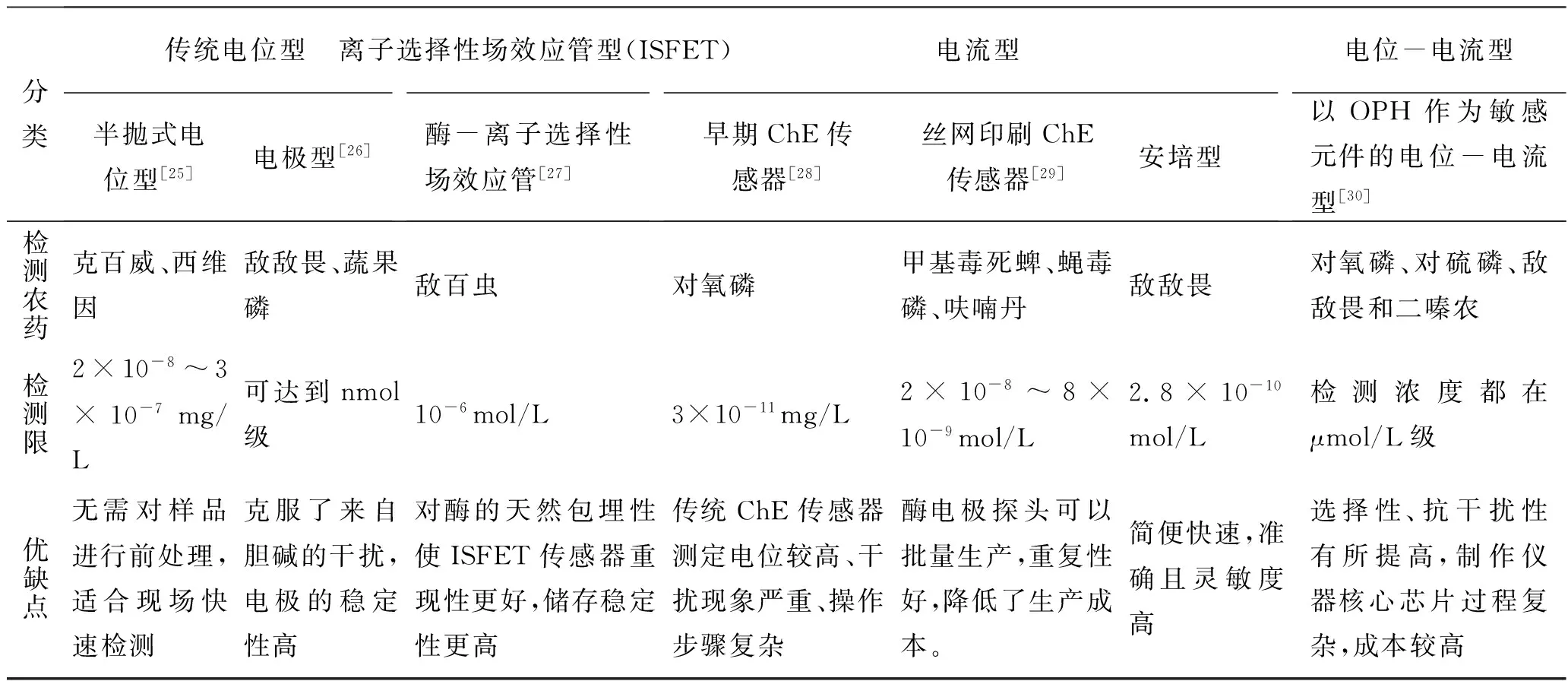
表1 常見電化學型酶生物傳感器比較Table 1 the compare of electrochemical enzyme biosensor
離子選擇性場效應管(ISFET) EBS是隨著微電子技術的發展而產生的。其構造簡單,穩定性更高,且檢測靈敏度和使用壽命較傳統電極高。該種EBS本身也向微型化、集成化發展;同時ISFET適合批量制造,故其市場已較為成熟,具有廣闊的應用潛力。
電流型EBS的種類最為繁多,早期的電流型EBS由于檢測電位較高,一些電化學活性物質對其干擾較大,影響其靈敏度;加入一些介體修飾后雖然降低了檢測電位,并且提高了檢測限,但電極制作工藝復雜,重復性差,難以推廣應用。后來絲網印刷技術的發展和引入使電流型EBS研究有了新的突破,在選擇性、重復性、靈敏度方面均得到提高[16]。絲網印刷技術最大優勢是實現了酶電極探頭批量生產,且電極重現性好,降低了傳感器的成本,在實際推廣應用中只需進一步提高酶的穩定性以及成本控制。從表中可以看出,電流型EBS的檢測限在幾種電化學型EBS中是最高的,可以達到10-8的數量級,在今后的發展中也很有潛力。
電位-電流型EBS作為兩者的結合,是一個新的研究方向。它結合了電位型EBS響應時間短、重復性好、檢測范圍廣以及電流型EBS靈敏度高、檢測限低的優勢,但是受傳感器制作成本高及核心芯片制作工藝復雜的限制,到實際應用仍需研究改進。
不同類型的酶生物傳感器的優缺點不是一成不變的,與制作方式和應用場合有極大關系,選擇不同的酶就會使傳感器效果不同。例如膽堿酯酶中,丁酰膽堿酯酶對農藥的抑制性比乙酰膽堿酯酶更強,故用其代替乙酰膽堿酯酶所制作的傳感器更加的靈敏、檢測限也更高,有時甚至能提高一個數量級。有機磷水解酶則是通過水解底物來完成反應的,其針對性、準確性很高,它只需一步反應,故其反應速度比較快,響應時間短,但一般由于底物量較少,對檢測精度要求就很高,制作起來也相對比較困難。綜上可見,酶生物傳感器的效果其實是各個因素的綜合結果。
2.3 光學型及壓電型酶生物傳感器
光學型EBS主要由光纖和生物敏感膜組成,隨著研究進展不斷有最新技術引入,也存在著一些亟待解決的不足之處。
壓電型(石英晶體微天平(QCM))EBS以QCM為信號轉換器。QCM是根據壓電石英晶體諧振測量技術制成的,晶體吸附外來物后振動頻率的變化和附著層的質量變化可以轉換為信號輸出,具有10-9g級的質量檢測能力,它對表面質量負載的高度靈敏特性使之成為傳感器制備中較好的信號轉換器。表2列出了幾種常見的光學型和壓電型酶生物傳感器的比較結果。

表2 常見光學型及壓電型酶生物傳感器比較Table 2 the compare of optical and piezoelectric enzyme biosensor
光纖EBS以光為檢測信號,靈敏度極高,可以達到10-9~10-10數量級,響應時間短,抗電磁場干擾能力強,信息傳遞容量大,能量損耗低等,在常量至微量甚至超微量分析方面,具有其他傳感技術所不具有的優勢。同樣由于光的特性,使得光纖EBS易受背景光的干擾,穩定性較差,且制作時固定生物材料難度更大。然而無論如何,光纖EBS快速、可逆,能夠實現在線實時檢測,這點在實際應用中有重要意義。
壓電型(石英晶體微天平(QCM))EBS是一種新穎的生物傳感器,它檢測靈敏度很高,快速簡單,成本較低,且對樣品無需破壞處理,可以在線監測。但是壓電型EBS對操作環境條件要求嚴格,濕度和溫度都可能影響其結果,故在實際應用中有時難以達到預期效果,不利于推廣應用。 但是光纖EBS和壓電型EBS的出現,給酶生物傳感器的發展提供了新的思路,從能量轉換的角度來開發更多種類的傳感器。
對比電化學型、光學型、壓電型這三大類酶生物傳感器,雖有各自發展之先后,但自身都存在一些優點和不足之處。
電化學型EBS以酶作分子識別元件對底物有高度選擇性,具有較高的靈敏度,同時電極響應時間短,檢測迅速。現在隨著發展還出現了以動植物細胞和組織來代替純酶試劑,降低了生物傳感器的制作成本。電化學型EBS適用范圍廣,性能穩定,其技術已經相對完善且有實際應用意義,有廣闊的發展前景。
光學型和壓電型EBS是新型的生物傳感器,它們都有極高的檢測靈敏度(這也是酶生物傳感器的特性之一),并且都可以實現在線實時檢測。但是兩者的制作過程均略顯復雜,檢測范圍受到限制,壓電型EBS對操作環境要求嚴格,因此兩者離實際應用推廣還有一段距離,但仍是生物傳感技術的重要分支,具有重要的研究意義。
3結 論
酶生物傳感器開辟了農藥殘留檢測的新領域,在測定農藥,特別是痕量微量的農藥殘留,與其它需用儀器進行分析的方法相比較,它更方便、快速且需對樣品所做的前處理較少。但酶生物傳感器尤其是一些電化學生物傳感器以及一些新型酶生物傳感器的研究多在實驗室條件下,被開發應用到實際檢測中的種類很少。目前要生產用于農藥殘留日常檢測的酶生物傳感器并在工業中實現推廣還要進行大量的研究工作,其最大問題還是穩定性、靈敏度、重復性和準確性。當前要有所突破克服現有的一些不足還需要研究新的酶固定化技術,做到提高酶活力的同時延長酶生物傳感器使用壽命;也可以通過研發新型信號轉換技術來研制新型酶生物傳感器。今后,酶生物傳感器將朝著經濟化、小型化、功能多樣化、智能化和集成化方面發展。而想要把酶生物傳感器應用到公安工作中來,不僅僅是要考慮到它快速檢測的優勢,還要考慮到酶生物傳感器的選擇性比較高,但也正是這樣其毒物檢測范圍就會受到限制,通常只能針對某類毒物或者農藥進行檢測,但公安案件中的檢材通常是很復雜多樣的,這樣的檢測結果就會出現假陰性。不管是將多種酶一起固定在基質上形成多酶膜還是一些其他的解決方法,酶生物傳感器在公安工作中的真正應用還有很長一段路要走,還有很多實際的問題需要大家一起探索解決,不管如何,酶生物傳感器作為一種快速檢測方法還是十分有發展潛力的。
[1] 袁義昌,楊群.濰坊市2006-2014年農藥中毒報告時間序列分析[J].中國衛生工程學,2017,16(1):56~58.
[2] 王坦,宋瑋,李玉博等.我國食用菌出口技術壁壘特點及應對措施研究[J].農產品質量與安全,2016,14(1):61~66.
[3] 江波,陳明,王燕軍.通過模擬實驗揭示一起投毒案件真相[J].刑事技術,2014,42(1):52~53.
[4] 劉國群,王學珍.兒童意外中毒影響因素分析與干預[J].中國婦幼保健,2014,29(4):556~558.
[5] 夏英,張瀾,趙爾成等.分散固相萃取/分散液液微萃取-氣相色譜法測定甘藍中的擬除蟲菊酯類農藥殘留[J].分析測試學報,2014,33(2):192~196.
[6] 劉小文,羅江,張敏等.果蔬中擬除蟲菊酯農藥殘留分析方法進展[J].理化檢驗(化學分冊),2013,49(9):1 141~1 147.
[7] 曹新悅,龐國芳,金鈴和等.氣相色譜-四極桿-飛行時間質譜和氣相色譜-串聯質譜對水果、蔬菜中208種農藥殘留篩查確證能力的對比[J].色譜,2015,33(4):389~396.
[8] 張婷亭,王靜靜,鞏志國等.分散固相萃取-超高效液相色譜-質譜/質譜法測定干果果肉中56種農藥殘留[J].分析試驗室,2016,35(3):287~292.
[9] 王曉彬,吳瑞梅,劉木華等.多菌靈農藥的激光拉曼光譜分析[J].光譜學與光譜分析,2016,34(4):1 566~1 570.
[10] 孫俊,周鑫,毛罕平等.基于熒光光譜的生菜農藥殘留檢測[J].農業工程學報,2016,32(19):302~307.
[11] 郭明,梁東軍,譚賢.農藥殘留檢測用新型碳納米管固載酶生物傳感器的制備及其電學傳感性能分析[J].農藥學學報,2014,16(3):319~329.
[12] 王曉朋,曾梅,萬德慧等.化學發光生物傳感器法測定食品中有機磷與氨基甲酸酯類農藥殘留[J].食品安全質量檢測學報,2014,5(12):4 163~4 171.
[13] 烏日娜,李建科.生物傳感器在農藥殘留分析中的研究現狀及展望[J].食品與機械,2005,21(2):54~56.
[14] 趙靜,劉曉宇,江豐.電化學酶傳感器在有機磷農藥殘留檢測中的應用[J].農產品加工學刊,2010,3(6):60~62.
[15] 傅深娜,侯長軍,霍丹群等.用于農殘檢測的酶抑制生物傳感器研究進展[J].廣州化工,2013,41(17):20~21.
[16] 王麗紅,張林,陳歡林.有機磷農藥酶生物傳感器研究進展[J].化學進展,2006,18(4):440~452.
[17] 張先恩.生物傳感器[M].北京:化學工業出版社,2006.
[18] 蔣雪松,應義斌,王劍平.生物傳感器在農藥殘留檢測中的應用[J].農業工程學報,2005,21(4):118~121.
[19] E P. Scheide,G.G.Guilbault,.Piezoelectric detectors for organophosphorus compounds and pesticides[J].Anal. Chem,1972,44(11):1 764~1 768.
[20] J M. Abad,F.Pariente,L.Hernandez,et al..Determination of organophosphorus and carbamate pesticides using piezoelectric biosensors[J].Anal. Chem,1998,70(14):2 848~2 855.
[21] 楊麗娟,鄭文剛,趙春江,等.用于農藥殘留檢測的酶生物傳感器[J].化學通報,2009,76(3):208~214.
[22] 張淑平,單聯剛,經媛元.檢測有機磷農藥電流型膽堿酯酶傳感器的研究進展[J].化學傳感器,2006,26(2):8~13.
[23] 趙靜,劉曉宇,江豐.電化學酶傳感器在有機磷農藥殘留檢測中的應用[J].農產品加工學刊,2010,3(6):60~62.
[24] S H. Chough,A. Mulchandani,P. Mulchandani,et al..Organophosphorus hydrolase-base amperometric sensor:modulation of sensitivity and substrate selectivity[J].Electroanalysis,2002,14(4):273~276.
[25] W Limbut,P. Thavarungkul,P. Kanatharana et al. .Comparative study of controlled pore glass,silica gel and Poraver? for the immobilization of urease to determine urea in a flow injection conductimetric biosensor system[J].Biosens. Bioelectron,2004,19(8):813~821.
[26] T Imato,N. Ishibashi. .Potentiometric butyrylcholine sensor for organophosphate pesticides[J].Biosens. Bioelectron,1995,10(5):435~441.
[27] K Wan,JM. Chovelon,N. Jaffrezic-Renault et al. .Enzyme-octadecylamine Langmuir-Blodgett membranes for ENFET biosensors[J].Sens. Actuat.(B),1999,58(1-3):399~408.
[28] N Mionetto,R. Rouillon,J. L. Marty. .Inhibition of acetylcholinesterase by organophosphorus and carbamates compounds. Studies on free and immobilized enzymes[J].Zeitschrift für Wasser- und Abwasser-Forschung,1992,25(3):171~174.
[29] A Ivanov,GEvtugyn,H. Budnikov et al..Anal.Chholinesterase sensors based on screen-printed electrodes for detection of organophosphorus and carbamic pesticides[J].Bioanal. Chem,2003,377(4):624~631.
[30] M J. Schoning,RKrause,K. Block et al. .A dual amperometric/potentiometric FIA-based biosensor for the distinctive detection of organophosphorus pesticides[J].Sens. Actuat,2003,95(1-3):291~296.
[31] M P. Xavier,BVallejo,M. D. Marazuela et al.. Fiber optic monitoring of carbamate pesticides using porous glass with covalently bound chlorophenol red[J].Biosens. Bioelectron,2000,14(12):895~905.
[32] V G. Andreou,YD. Clonis. .A portable fiber-optic pesticide biosensor based on immobilized cholinesterase and sol-gel entrapped bromcresol purple for in-field use[J].Biosens. Bioelectron,2002,17(1-2):61~69.
[33] J MAbad,FPariente,L. Hernández et al. .Determination of Organophosphorus and Carbamate Pesticides Using a Piezoelectric Biosensor[J].Anal. Chem,1998,70(14):2 848~2 855.
[34] N Kim,I. S. Park,D. K. Kim. .High-sensitivity detection for model organophosphorus and carbamate pesticide with quartz crystal microbalance-precipitation sensor[J].Biosens. Bioelectron,2007,22(8):1 593~1 599.

