急性缺血性卒中合并頸動脈斑塊患者神經功能損傷與血漿氧化低密度脂蛋白水平相關性研究
蘇兆萍,楊寓玲,劉長城,趙晶,孟維靜,楊光,王素珍
卒中已成為全球致死和致殘的首要病因。目前,全世界大約有3300萬卒中患者,其中很大比例患者具有中重度神經功能損傷,加重了全球卒中相關的醫療負擔和經濟負擔[1]。研究證實,頸動脈斑塊在動脈粥樣硬化(atherosclerosis,AS)基礎上發生潰瘍、破裂進而激活血小板使血栓形成,最終導致血管閉塞是急性缺血性卒中(acute ischemic stroke,AIS)發生的主要機制之一[2-3]。而氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)可誘導炎癥因子的釋放、血管內皮功能障礙和平滑肌細胞及巨噬細胞的移動,是AS的啟動和發展的關鍵[4-6]。本研究推測:ox-LDL可能參與了AIS后神經功能損傷的發展過程。因此,本研究通過分析存在頸動脈斑塊的AIS患者早期美國國立衛生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)評分與血漿ox-LDL的關系,探討AIS后神經功能損傷與ox-LDL的相關性。
1 對象與方法
1.1 研究對象 該研究入選人群來自急性缺血性卒中患者氧化應激水平的臨床觀察研究(Study on Oxidative Stress in Patients with Acute Ischemic Stroke,SOS-Stroke)[7]。該研究納入了來自全國43個醫療機構的4164例AIS患者。本研究已通過首都醫科大學附屬北京天壇醫院、首都醫科大學宣武醫院和北京協和醫院倫理委員會批準,并取得所有參與者或授權親屬的知情同意。入選標準:①年齡≥18歲;②AIS均被神經內科醫師通過頭部計算機斷層掃描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)診斷;③AIS發病到確診<7 d;④均簽署知情同意。排除標準:①通過頭部CT或MRI證實患者有出血性、其他病理性(血管畸形、腫瘤、膿腫、多發硬化)或非缺血性腦血管疾病;②短暫性腦缺血發作(transient ischemic attack,TIA);③因血管成形或其他手術操作導致的醫源性卒中。
1.2 NIHSS評分評估神經功能損傷 所有患者均在入院24 h內接受NIHSS評分。NIHSS評分均由兩名臨床經驗豐富的神經內科醫師參照NIHSS量表進行評估,取平均值作為最終評分。
1.3 血液樣本的采集與ox-LDL測定 經肘靜脈抽取晨起空腹血5 ml,置于防氧化劑及抗凝的真空管中。搖勻后,2000 r/min離心5 min后析出血漿;微量移液器移取血漿置于聚丙烯試管中,-80℃保存。用酶聯免疫吸附法(enzyme-linked immune sorbent assay,ELISA)測定血漿ox-LDL水平。ox-LDL試劑盒購自美國RapidBio Lab公司,嚴格按照說明書進行操作。
1.4 頸動脈斑塊性質的判定 所有患者均在入院24 h內行頸動脈超聲檢查。①頸動脈斑塊判斷標準:頸動脈內-中膜厚度(intima-media thickness,IMT)是指在血管橫截面上,從斑塊纖維帽管腔面至血管外膜內緣的垂直距離。IMT≥1.5 mm為斑塊形成。②斑塊穩定性判斷標準:根據斑塊的聲學特性,將其分為低回聲、等回聲及強回聲斑塊。兩種回聲斑塊同時存在為混合性斑塊。斑塊潰瘍指斑塊表面不光滑,至少有長2 mm和深2 mm的凹陷,且斑塊有明顯的基底。將表面光滑、強回聲斑塊定義為穩定性斑塊,低回聲、等回聲、混合回聲和潰瘍斑塊定義為不穩定性斑塊[8]。
1.5 統計學處理 應用SAS 9.3統計分析軟件進行分析,計量資料使用或中位數(四分位數)表示。計數資料使用頻數(百分比)表示。計量資料符合正態分布的使用t檢驗和方差分析進行統計處理;非正態分布資料使用Kruskal-Wallis H或Wilcoxon符號秩檢驗進行統計分析;分類變量使用χ2檢驗或Fisher確切概率法進行比較。多元線性回歸分析用于評估ox-LDL與AIS患者神經功能損傷的相關性。P<0.05為差異有顯著性。
2 結果
2.1 AIS患者的基線特征 本研究在4164例注冊登記的SOS-Stroke研究中,入選了2421例AIS合并頸動脈斑塊的患者,男1607例,女814例,平均年齡(65.17±11.39)歲,ox-LDL平均水平為(56.55±20.86)μg/dl,平均NIHSS評分為4(2~8)分。NIHSS>5分組患者的血漿ox-LDL水平顯著高于NIHSS≤5分組患者的血漿ox-LDL水平(P<0.0001)。而且,與NIHSS≤5分組比較,NIHSS>5分組的患者年齡更大(P=0.0002),且更多為女性(P=0.0004)。然而,兩組患者頸動脈斑塊的穩定性與不穩定性未見顯著統計學差異(表1)。
2.2 NIHSS評分與血漿ox-LDL水平之間的多因素分析 在多元線性回歸分析模型中,AIS患者血漿ox-LDL水平對NIHSS評分具有顯著的影響。校正年齡、性別、高血壓、糖尿病等因素后,血漿ox-LDL水平對NIHSS評分仍有顯著影響,且ox-LDL每升高10個單位,NIHSS評分增加0.23分(P<0.0001)(表2)。
2.3 因素分層對NIHSS評分與血漿ox-LDL水平相關性的影響 在基于年齡、性別及斑塊穩定性分層的多元線性回歸分析模型中,校正了體質指數、高血壓、糖尿病、吸煙、飲酒、低密度脂蛋白、高密度脂蛋白及甘油三酯等混雜因素后,男性與女性、是否超過65歲以及頸動脈斑塊是否穩定未對NIHSS評分與血漿ox-LDL水平相關性產生影響(表3)。
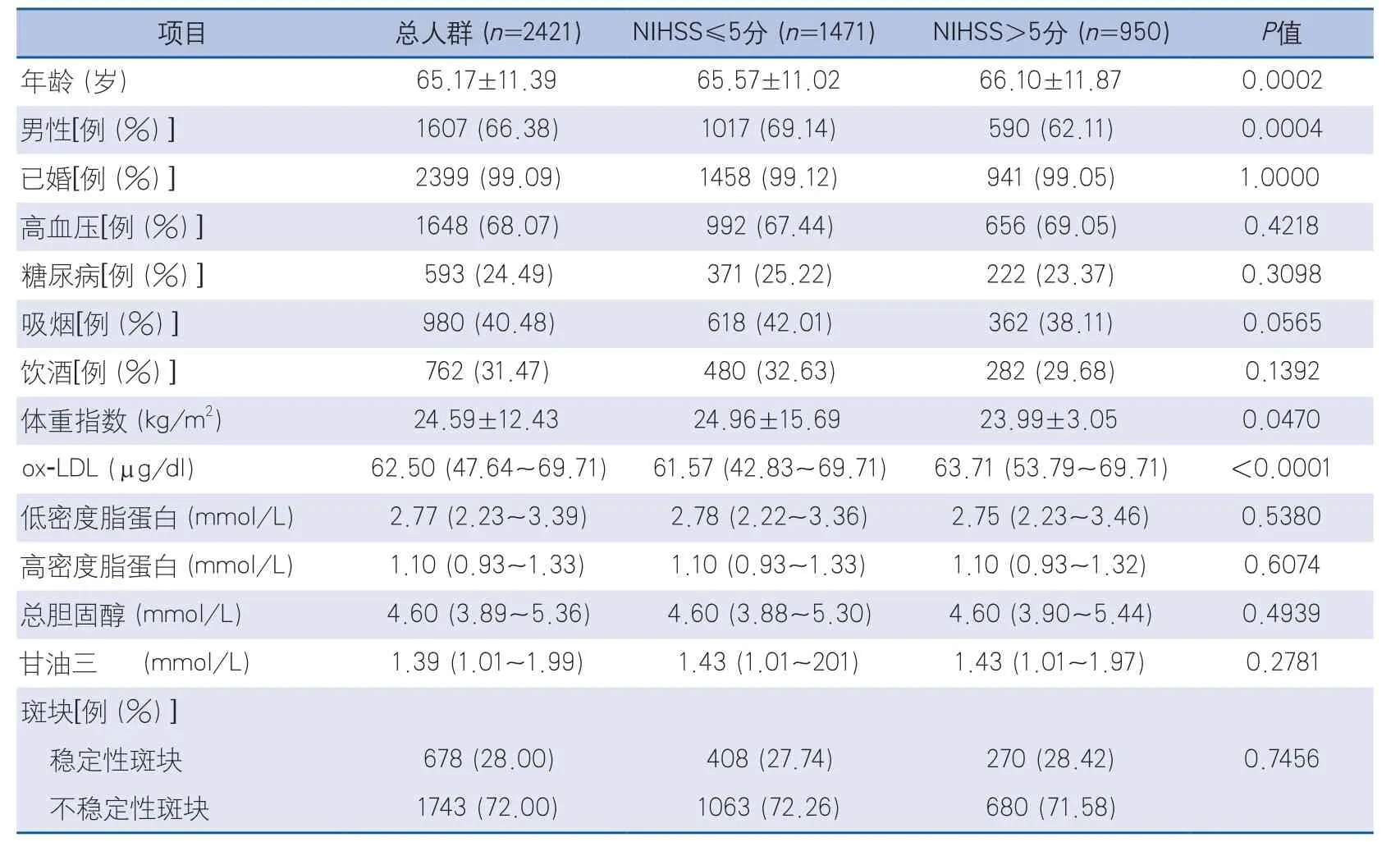
表1 輕度(NIHSS≤5分)與中重度(NIHSS>5分)AIS患者基線資料比較
3 討論
ox-LDL作為AS的始動因素,已成為心血管疾病的獨立危險因子,并且增加了急性心肌梗死患者的死亡風險[9-10]。腦血管粥樣硬化性病變與冠狀動脈粥樣硬化具有相似的病理生理機制,而且有研究證實,AIS患者的血漿ox-LDL水平顯著高于健康人群[11]。NIHSS評分操作簡單、可重復性強,是評估卒中患者神經功能損傷的簡捷、有效的方法[12]。但是AIS患者神經功能損傷與血漿ox-LDL水平相關性研究尚少。本研究的結果顯示:AIS患者NIHSS評分與ox-LDL水平呈正相關性。
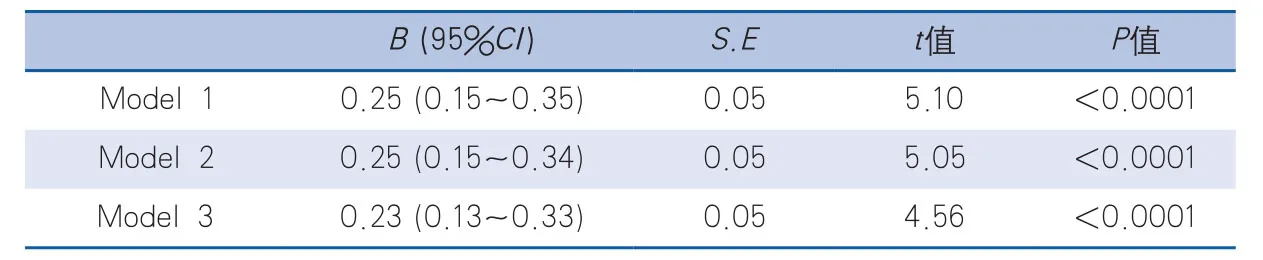
表2 AIS患者NIHSS評分與每增加10個單位ox-LDL水平之間的多因素分析
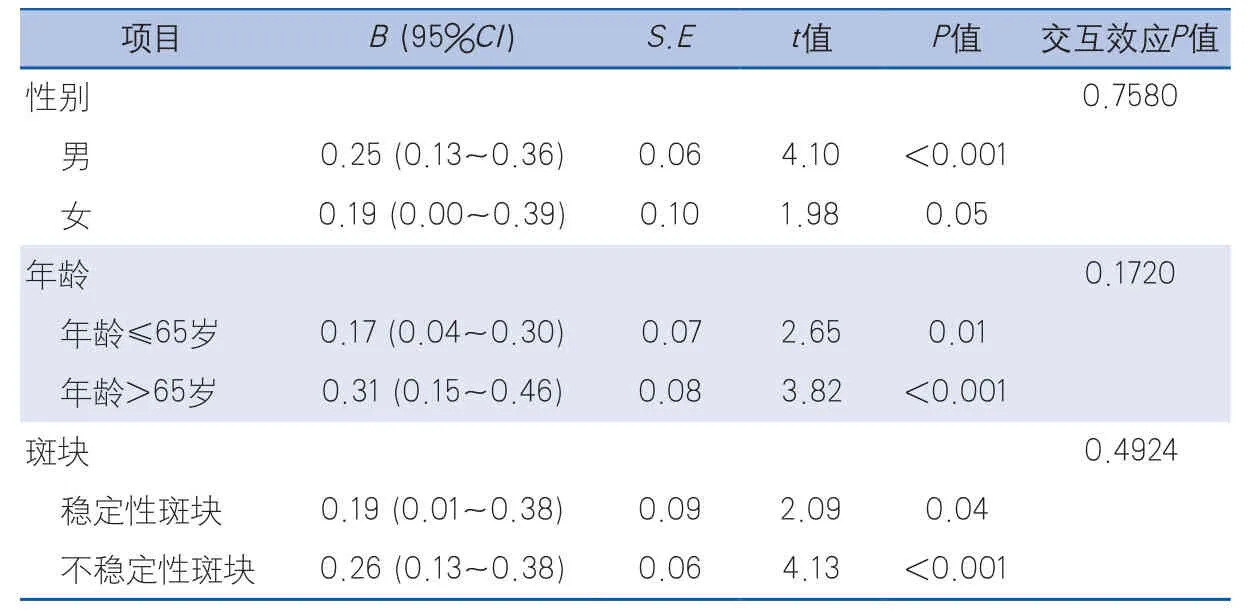
表3 不同因素分層的NIHSS評分與每增加10個單位ox-LDL水平之間的多因素線性回歸分析
本研究證實而且進一步拓展了以前的相關研究。Ryglewicz等[13]研究證明頸動脈狹窄導致卒中患者血液中低密度脂蛋白呈明顯氧化狀態。Uno等[14]評估了ox-LDL與急性卒中缺血損傷的關系并證實持續升高的ox-LDL水平與AIS早期腦缺血損傷面積增大具有相關性。
然而,NIHSS評分與血漿ox-LDL水平之間正相關性的確切機制仍需進一步闡明。ox-LDL在AS的進展和破裂過程中起到了至關重要的作用:①ox-LDL具有細胞毒性,可致血管內皮細胞功能障礙[15];②ox-LDL促進單核細胞、平滑肌細胞和T淋巴細胞向血管內膜下遷移,但抑制巨噬細胞的運動,從而促進了脂質的沉積[16];③ox-LDL可刺激機體炎癥因子釋放,促進粥樣斑塊的炎癥反應和不穩定性,最終增加了AS所導致的AIS發生的風險。此外,ox-LDL不僅反映了機體的氧化狀態,而且可誘導機體產生氧自由基,對維持機體氧化應激的狀態具有重要的作用。而氧化應激可加重AIS的神經功能損傷。另外,全身或局部氧化應激進一步促進低密度脂蛋白向ox-LDL轉化[17]。上述可能解釋AIS患者NIHSS評分與持續增高的ox-LDL水平之間的正相關性。
頸動脈斑塊的不穩定性與AIS的發生和進展密切相關。相關研究顯示,粥樣硬化斑塊損傷所致的血栓造成了高達80%的急性心腦血管病事件[8]。另有研究顯示,年齡和血漿ox-LDL水平是頸動脈斑塊形成的危險因素,而且后者與斑塊的不穩定性密切相關[18]。盡管年齡與AS形成具有正相關性,但是隨著年齡增加,AS逐漸出現鈣化,斑塊的炎癥反應也逐漸減弱。Redgrave等[19]研究也發現,年齡與AS的不穩定性無顯著相關性。
Cipollone等[20]研究發現,ox-LDL可激活內皮細胞和巨噬細胞表達基質金屬蛋白酶的活性,使得基質金屬蛋白酶增多。而基質金屬蛋白酶-2和基質金屬蛋白酶-9(MMSE-9)能特異性地黏附和降解細胞外基質,從而導致纖維帽變薄,增加斑塊的不穩定性。另外,ox-LDL可促進巨噬或單核細胞分泌并釋放腫瘤壞死因子-α(TNF-α)、白細胞介素-1(IL-1)和單核細胞趨化蛋白-1(MCP-1)等炎癥因子,一方面促使炎癥細胞聚集,增加斑塊的炎癥反應;另一方面加重內皮細胞功能障礙進而壞死,使纖維帽進一步變薄,促進斑塊破裂[21-22]。本研究根據頸動脈斑塊的性質進行分層,發現與穩定斑塊AIS患者比較,不穩定斑塊患者血漿ox-LDL水平顯著增高。然而,不穩定斑塊僅是AIS發生發展的重要因素之一。因此本研究中頸動脈斑塊穩定與否對NIHSS評分與血漿ox-LDL水平相關性未產生影響。
本研究結果表明升高的血漿ox-LDL水平可反映AIS患者神經功能損傷的嚴重程度。但是本研究也存在一定的局限性:①作為橫斷面研究,未闡述AIS后ox-LDL水平變化與NIHSS評分之間的關系;②僅將頸動脈斑塊易損性作為分層因素,不同的AIS亞型或許對ox-LDL水平與NIHSS評分的相關性產生影響。由于ox-LDL對AS的發生、發展和破裂以及影響氧化應激方面具有重要作用,進一步的研究應該致力于血漿ox-LDL水平變化與不同卒中亞型AIS預后的關系,以及AIS早期抗氧化治療。
1 Lozano R,Naghavi M,Foreman K,et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet,2012,380:2095-2128.
2 Katagiri H,Yamada T,Oka Y. Adiposity and cardiovascular disorders:disturbance of the regulatory system consisting of humoral and neuronal signals[J]. Circ Res,2007,101:27-39.
3 Cherubini A,Ruggiero C,Polidori MC,et al.Potential markers of oxidative stress in stroke[J]. Free Radic Biol Med,2005,39:841-852.
4 Kugiyama K,Kerns SA,Morrisett JD,et al.Impairment of endothelium-dependent arterial relaxation by lysolecithin in modified low-density lipoproteins[J]. Nature,1990,344:160-162.
5 Stiko-Rahm A,Hultg?rdh-Nilsson A,Regnstr?m J,et al. Native and oxidized LDL enhances production of PDGFAA and the surface expression of PDGF receptors in cultured human smooth muscle cells[J].Arterioscler Thromb,1992,12:1099-1109.
6 Yui S,Sasaki T,Miyazaki A,et al. Induction of murine macrophage growth by modified LDLs[J].Arterioscler Thromb,1993,13:331-337.
7 Yue W,Wang A,Liang H,et al. Association between carotid intima-media thickness and cognitive impairment in a Chinese stroke population:A crosssectional study[J]. Sci Rep,2016,6:19 556.
8 Vir mani R,Ladich ER,Burke AP,et al.Histopathology of carotid atherosclerotic disease[J].Neurosurgery,2006,59:S219-227; discussion S3-13.
9 Chen KC,Liao YC,Wang JY,et al. Oxidized lowdensity lipoprotein is a common risk factor for cardiovascular diseases and gastroenterological cancers via epigenomical regulation of microRNA-210[J]. Oncotarget,2015,6:24 105-24 118.
10 Ehara S,Ueda M,Naruko T,et al. Elevated levels of oxidized low density lipoprotein show a positive relationship with the severity of acute coronary syndromes[J]. Circulation,2001,103:1955-1960.
11 Vibo R,K?rv J,Roose M,et al. Acute phase proteins and oxidised low-density lipoprotein in association with ischemic stroke subtype,severity and outcome[J].Free Radic Res,2007,41:282-287.
12 Yao M,Herve D,Allili N,et al. NIHSS scores in ischemic small vessel disease:a study in CADASIL[J].Cerebrovasc Dis,2012,34:419-423.
13 Ryglewicz D,Rodo M,Roszczynko M,et al.Dynamics of LDL oxidation in ischemic stroke patients[J]. Acta Neurol Scand,2002,105:185-188.
14 Uno M,Harada M,Takimoto O,et al. Elevation of plasma oxidized LDL in acute stroke patients is associated with ischemic lesions depicted by DWI and predictive of infarct enlargement[J]. Neurol Res,2005,27:94-102.
15 Jialal I. Evolving lipoprotein risk factors:lipoprotein(a) and oxidized low-density lipoprotein[J].Clin Chem,1998,44:1827-1832.
16 Steinberg D. Low density lipoprotein oxidation and its pathobiological significance[J]. J Biol Chem,1997,272:20 963-20 966.
17 Guldiken B,Guldiken S,Turgut B,et al. The roles of oxidized low-density lipoprotein and interleukin-6 levels in acute atherothrombotic and lacunar ischemic stroke[J]. Angiology,2008,59:224-229.
18 Fang R,Zhang N,Wang C,et al. Relations between plasma ox-LDL and carotid plaque among Chinese Han ethnic group[J]. Neurol Res,2011,33:460-466.
19 Redgrave JN,Lovett JK,Rothwell PM. Histological features of symptomatic carotid plaques in relation to age and smoking:the oxford plaque study[J]. Stroke,2010,41:2288-2294.
20 Cipollone F,Iezzi A,Fazia M,et al. The receptor RAGE as a progression factor amplifying arachidonatedependent inflammatory and proteolytic response in human atherosclerotic plaques:role of glycemic control[J]. Circulation,2003,108:1070-1077.
21 Rajavashisth TB,Liao JK,Galis ZS,et al.Inflammatory cytokines and oxidized low density lipoproteins increase endothelial cell expression of membrane type 1-matrix metalloproteinase[J]. J Biol Chem,1999,274:11 924-11 929.
22 Dwivedi A,Anggard EE,Carrier MJ. Oxidized LDL-mediated monocyte adhesion to endothelial cells does not involve NF kappaB[J]. Biochem Biophys Res Commun,2001,284:239-244.

