表沒食子兒茶素沒食子酸酯對中波紫外線誘導小鼠皮膚黑素小體轉移與降解的影響
賈肖肖 胡文婷 王敏 華優 高亞麗 耿清偉 李劉雨 宋秀祖
310009杭州,浙江中醫藥大學附屬杭州第三醫院 杭州市第三人民醫院皮膚科
·論著·
表沒食子兒茶素沒食子酸酯對中波紫外線誘導小鼠皮膚黑素小體轉移與降解的影響
賈肖肖 胡文婷 王敏 華優 高亞麗 耿清偉 李劉雨 宋秀祖
310009杭州,浙江中醫藥大學附屬杭州第三醫院 杭州市第三人民醫院皮膚科
目的觀察茶多酚單體表沒食子兒茶素沒食子酸酯(EGCG)對中波紫外線(UVB)誘導小鼠皮膚色素沉著及黑素小體轉移和降解的影響,探討自噬在其中的作用機制。方法將16只C57/BL6雌性小鼠32只鼠耳用簡單隨機方法隨機等分為4組:①丙酮對照組:每日予丙酮溶液外涂耳部皮膚;②EGCG組:每日予10 g/L EGCG丙酮溶液外涂;③UVB照射組:單次500 mJ/cm2UVB照射,照射2 h后每日外涂丙酮溶液;④UVB+EGCG組:單次UVB照射2 h后每日外涂EGCG丙酮溶液。10 d后處死小鼠,收集耳部皮膚,透射電鏡觀察黑素小體及自噬體超微結構變化,免疫組化法檢測蛋白酶活性受體2(PAR2)及微管相關蛋白輕鏈3(LC3)在表皮中的表達,免疫印跡法檢測PAR2、Rab27a及LC3在表皮中的表達。結果丙酮對照組、UVB照射組、UVB+EGCG組和EGCG組間黑素小體及自噬體數量差異均有統計學意義(H值分別為12.249、13.888,均P<0.05);與丙酮對照組小鼠皮膚角質形成細胞內黑素小體數量(1.00±0.41)、自噬體數量(1.00±0.46)相比,UVB照射組黑素小體(1.85±0.32)和自噬體(1.94±0.64)均顯著增加(均P<0.05);相較于UVB照射組,UVB+EGCG組黑素小體(1.30±0.44)顯著減少(P<0.05),而自噬體(3.03±0.75)則明顯增加(P<0.05)。免疫組化顯示,4組間PAR2在表皮中的表達差異有統計學意義(H=18.700,P<0.05);與UVB照射組(12.54±3.07)比較,UVB+EGCG組PAR2表達(7.94±4.57)顯著減少(Z=2.143,P<0.05);但4組表皮LC3表達均不明顯,表達水平差異無統計學意義(H=5.051,P>0.05)。免疫印跡顯示,4組間PAR2、Rab27a表達及LC3Ⅱ/LC3Ⅰ比值差異均有統計學意義(F值分別為18.739、25.967、24.022,均P<0.05);與UVB照射組(PAR2 3.12±0.61,Rab27a 1.42±0.07,LC3Ⅱ/LC3Ⅰ1.24±0.07)比較,UVB+EGCG組PAR2(0.91±0.54)、Rab27a(0.99±0.16)表達均顯著減少(P< 0.05),而LC3Ⅱ/LC3Ⅰ比值(1.67± 0.08)則顯著增加(P<0.05)。結論外用EGCG能有效抑制UVB誘導的皮膚色素沉著,其作用機制可能與抑制黑素小體轉運及促進黑素小體自噬有關。
多酚類;紫外線;自噬;黑素類;表沒食子兒茶素沒食子酸酯
黑素代謝包括黑素合成、轉運和降解。目前對于色素沉著機制研究大多集中在黑素合成和轉運,對黑素降解的研究較少。黑素降解是一個復雜而精細的過程,細胞自噬是其可能的降解機制[1?2],研究黑素的降解機制有助于探索新的治療方向。我們采用中波紫外線(UVB)照射小鼠誘導產生皮膚色素沉著模型,并外用茶多酚單體表沒食子兒茶素沒食子酸酯(EGCG)處理,觀察黑素轉運和降解變化,探討自噬在黑素降解中的作用機制,為茶多酚外用治療黃褐斑等色素沉著性皮膚病提供新的理論依據。
材料與方法
一、實驗動物、試劑及儀器
16只健康SPF級6~8周齡C57/BL6雌鼠由浙江中醫藥大學動物研究中心提供,合格證號2008001655143,實驗動物使用許可證號[SYXK(浙)2013?0184],體重(16.3 ± 0.87)g,于SPF級實驗動物屏障環境下飼養。紫外線光療儀SS?04B、UVB輻照度監視器來自上海希格瑪高科技有限公司,光源使用德國飛利浦公司寬波UVB紫外線低壓燈管。EGCG(美國Sigma公司),25%戊二醛溶液(美國Sigma?Aldrich公司),鼠抗Rab27a單克隆抗體、鼠抗蛋白酶活性受體2(PAR2)單克隆抗體及兔抗微管相關蛋白輕鏈3(LC3)多克隆抗體均來自美國Abcam公司。
二、實驗動物分組及處理
將16只C57/BL6雌性小鼠32只鼠耳用簡單隨機化方法隨機分為4組,每組8只鼠耳,①丙酮對照組:每日予以丙酮溶液外涂耳部皮膚;②EGCG組:每日予以10 g/L EGCG丙酮溶液外涂耳部皮膚;③UVB照射組:單次照射UVB,劑量500 mJ/cm2,照射2 h后每日外涂丙酮溶液;④UVB+EGCG組:單次500 mJ/cm2UVB照射2 h后,每日外涂EGCG丙酮溶液。如一只小鼠的兩只耳朵被分到非照射組和照射組,對非照射組耳朵則予以紙板遮擋。10 d后處死小鼠,收集耳部皮膚進行相應實驗。
三、透射電鏡觀察黑素小體及自噬體變化
常規取小鼠耳部皮膚,置于預冷2.5%戊二醛固定液中,1%鋨酸溶液固定,常規梯度乙醇脫水,丙酮浸透,包埋,聚合,超薄切片并染色。透射電鏡下觀察,拍照,每組選8個視野進行統計學分析。
四、免疫組化檢測PAR2及LC3表達
小鼠耳部皮膚常規處理,石蠟包埋、切片、脫蠟,3%過氧化氫溶液室溫孵育,加熱修復抗原,封閉液封閉。加入一抗鼠抗PAR2單克隆抗體及兔抗LC3多克隆抗體,4℃濕盒孵育過夜。用PBS浸洗3次,每次5 min,繼之滴加二抗羊抗鼠或羊抗兔IgG辣根過氧化物酶(HRP),PBS浸洗3次,3,3-二氨基聯苯胺(DAB)顯色,封片。顯微鏡下觀察,每張玻片采用簡單隨機方法隨機選3個視野拍照,圖像分析系統測定吸光度(A值),取均值作為蛋白表達水平。
五、免疫印跡檢測PAR2、Rab27a及自噬相關蛋白LC3表達
分離各組小鼠表皮組織,剪碎,液氮冷凍研磨,裂解液裂解,提取蛋白并進行定量。每孔加入相同量總蛋白30 μg進行垂直凝膠電泳,硝酸纖維素膜轉膜,5%脫脂牛奶室溫包被1 h。繼之分別加入鼠抗PAR2、Rab27a單克隆抗體及兔抗LC3多克隆抗體,4℃孵育過夜。TBST溶液洗膜3次,每次15 min。再加入HRP標記的羊抗鼠或羊抗兔IgG,室溫孵育1 h,TBST溶液洗膜3次。化學發光法檢測目的條帶并分析條帶灰度值,以目的蛋白/β肌動蛋白灰度比值代表蛋白表達水平,并設定丙酮對照組為1進行分析。
六、統計學處理
采用SPSS 19.0軟件進行統計分析,各組間PAR2、Rab27a與LC3的免疫印跡檢測結果通過單因素方差分析比較,并用SNK法進行兩兩比較。黑素小體及自噬體數量、PAR2與LC3的免疫組化檢測結果用Kruskal?WallisH檢驗,并用Mann?Whitney檢驗進行兩兩比較。P<0.05為差異有統計學意義。
結 果
一、UVB及EGCG處理后小鼠皮膚黑素小體變化
UVB照射組小鼠照光后第3天耳部皮膚開始出現明顯充血、紅斑、輕微脫屑及色素沉著,第10天出現明顯色素沉著,與UVB+EGCG組相比,肉眼觀察皮膚顏色未見顯著差異。見圖1。
透射電鏡觀察顯示,每組小鼠表皮角質形成細胞及黑素細胞中均可見清晰的黑素小體結構,表現為致密深黑色圓形或橢圓形顆粒樣結構,著色程度不同,散在或成簇分布在細胞質中。4組間黑素小體數量(表1)差異有統計學意義(P<0.05),與丙酮對照組相比,EGCG組小鼠皮膚黑素小體未見顯著變化(Z=0.081,P>0.05),UVB照射組顯著增加(Z=2.802,P<0.05);與UVB照射組比較,UVB+EGCG組黑素小體明顯減少,差異有統計學意義(Z=2.887,P<0.05)。見表1、圖2。
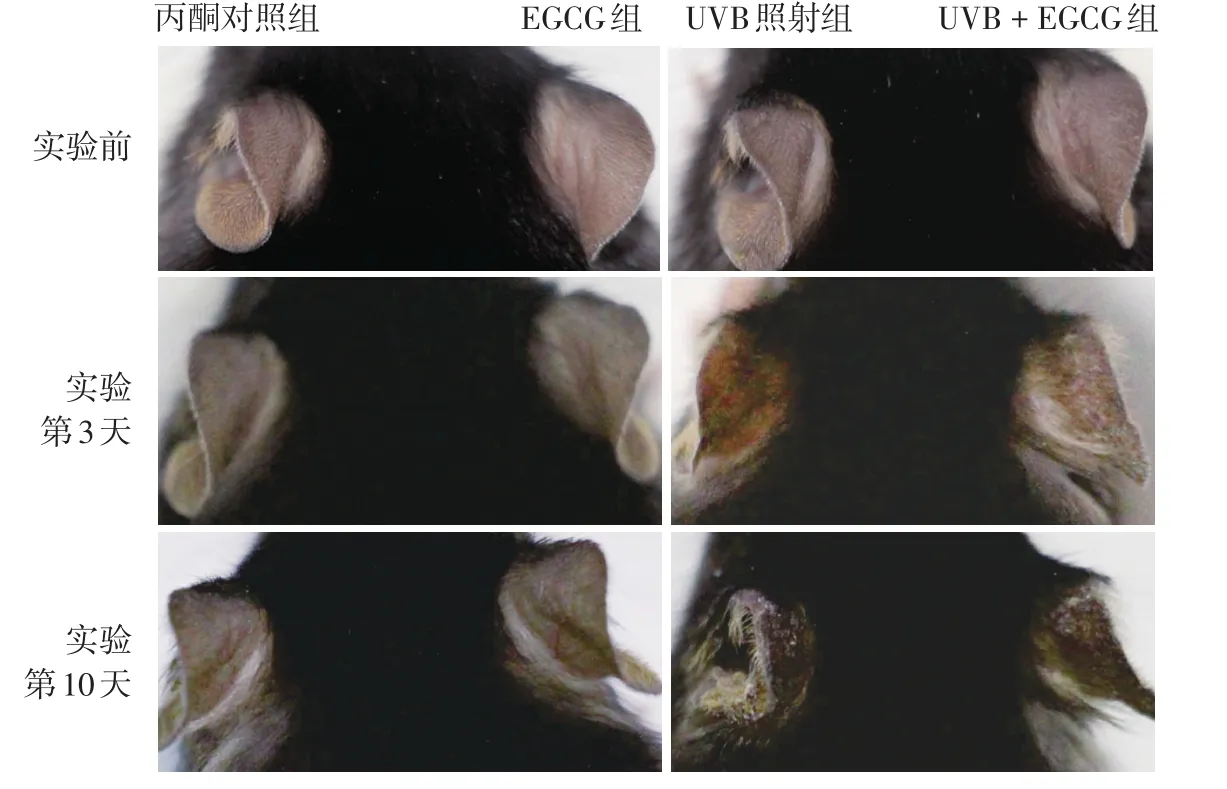
圖1 各組小鼠耳部皮膚情況 丙酮對照組肉眼觀察實驗前后耳部皮膚無明顯變化;EGCG組實驗前后耳部皮膚無明顯變化,實驗第10天與丙酮對照組相比,亦無明顯差異;UVB照射組實驗(照光后)第3天皮膚開始出現色素沉著,第10天更加顯著;UVB+EGCG組實驗(照光后)第10天與UVB照射組相比,皮膚色素沉著程度無明顯差異。EGCG:表沒食子兒茶素沒食子酸酯;UVB:中波紫外線
表1 中波紫外線(UVB)與表沒食子兒茶素沒食子兒酸酯(EGCG)處理后小鼠皮膚黑素小體、自噬體數量以及蛋白酶活性受體2(PAR2)與抗微管相關蛋白輕鏈3(LC3)等的表達(±s)
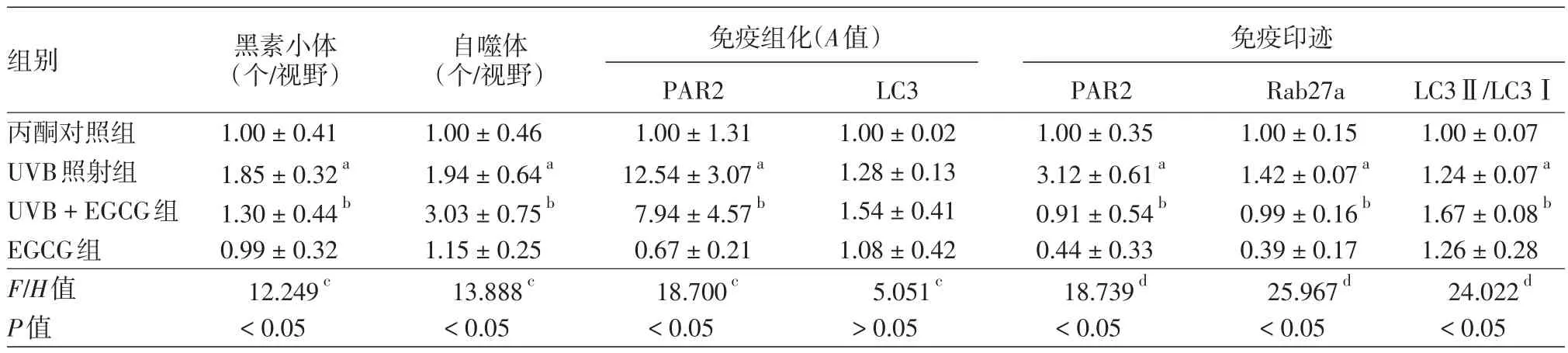
表1 中波紫外線(UVB)與表沒食子兒茶素沒食子兒酸酯(EGCG)處理后小鼠皮膚黑素小體、自噬體數量以及蛋白酶活性受體2(PAR2)與抗微管相關蛋白輕鏈3(LC3)等的表達(±s)
注:n=8。a與丙酮對照組相比,P <0.05;b與UVB照射組相比,P<0.05;cH值;dF值
組別丙酮對照組UVB照射組UVB+EGCG組EGCG組F/H值P值黑素小體(個/視野)1.00±0.41 1.85±0.32a 1.30±0.44b 0.99±0.32 12.249c<0.05自噬體(個/視野)1.00±0.46 1.94±0.64a 3.03±0.75b 1.15±0.25 13.888c<0.05免疫組化(A值)PAR2 1.00±1.31 12.54±3.07a 7.94±4.57b 0.67±0.21 18.700c<0.05 LC3 1.00±0.02 1.28±0.13 1.54±0.41 1.08±0.42 5.051c>0.05免疫印跡PAR2 1.00±0.35 3.12±0.61a 0.91±0.54b 0.44±0.33 18.739d<0.05 Rab27a 1.00±0.15 1.42±0.07a 0.99±0.16b 0.39±0.17 25.967d<0.05 LC3Ⅱ/LC3Ⅰ1.00±0.07 1.24±0.07a 1.67±0.08b 1.26±0.28 24.022d<0.05
二、UVB與EGCG處理后小鼠皮膚自噬體變化
透射電鏡觀察顯示,丙酮對照組小鼠表皮角質形成細胞內可見自噬溶酶體及溶酶體內的黑素小體集合體結構(圖3)。4組間自噬溶酶體數量差異有統計學意義(P<0.05)。見表1。與丙酮對照組相比,EGCG組小鼠角質形成細胞中自噬溶酶體增多,但差異無統計學意義;UVB照射組明顯增加,約為丙酮對照組的1.94倍,差異有統計學意義(Z=2.102,P<0.05),但黑素小體集合體未見增多。與UVB照射組比較,UVB+EGCG組小鼠角質形成細胞中自噬溶酶體增加更為顯著,約為丙酮對照組的3.03倍,且溶酶體內黑素小體集合體多見,差異有統計學意義(Z=1.991,P<0.05)。
三、PAR2與LC3免疫組化檢查結果
UVB照射組小鼠表皮呈反應性增生,UVB+EGCG組小鼠表皮亦明顯增厚。免疫組化結果顯示,4組小鼠表皮PAR2表達差異有統計學意義(P<0.05),丙酮對照組與EGCG組表達差異無統計學意義(Z=0.816,P>0.05);而UVB照射組表達顯著增加,約為丙酮對照組的12.54倍(Z=3.240,P<0.05),亦顯著高于UVB+EGCG組(Z=2.143,P<0.05)。見表1、圖4。
4組LC3在表皮表達不明顯,各組之間表達差異無統計學意義(P>0.05),見表1。
四、PAR2、Rab27a與LC3免疫印跡檢查結果
4組小鼠表皮PAR2表達差異有統計學意義(P<0.05),UVB照射組約為丙酮對照組的3.12倍(q=5.148,P<0.05),亦顯著高于UVB+EGCG組(q=4.642,P< 0.05)。見表1、圖5。
4組小鼠表皮Rab27a表達差異有統計學意義(P<0.05),UVB照射組約為丙酮對照組的1.42倍(q=4.483,P<0.05),亦顯著高于UVB+EGCG組(q=4.263,P< 0.05)。見表1、圖5。
4組小鼠表皮LC3Ⅱ/LC3Ⅰ比值差異有統計學意義(P<0.05),UVB照射組LC3Ⅱ/LC3Ⅰ比值約為丙酮對照組的1.24倍(q=4.072,P<0.05),但低于UVB+EGCG組(q=6.959,P<0.05)。見表1、圖5。
圖2 透射電鏡觀察中波紫外線(UVB)與表沒食子兒茶素沒食子酸酯(EGCG)處理后小鼠皮膚黑素小體(紅色箭頭)的變化 2A:丙酮對照組,細胞核旁可見少量黑素小體,散在分布;2B:UVB組,黑素小體明顯增多;2C:UVB+EGCG組,與UVB組相比黑素小體減少;2D:EGCG組,少量黑素小體分布于核周,數量與丙酮對照組無明顯差異
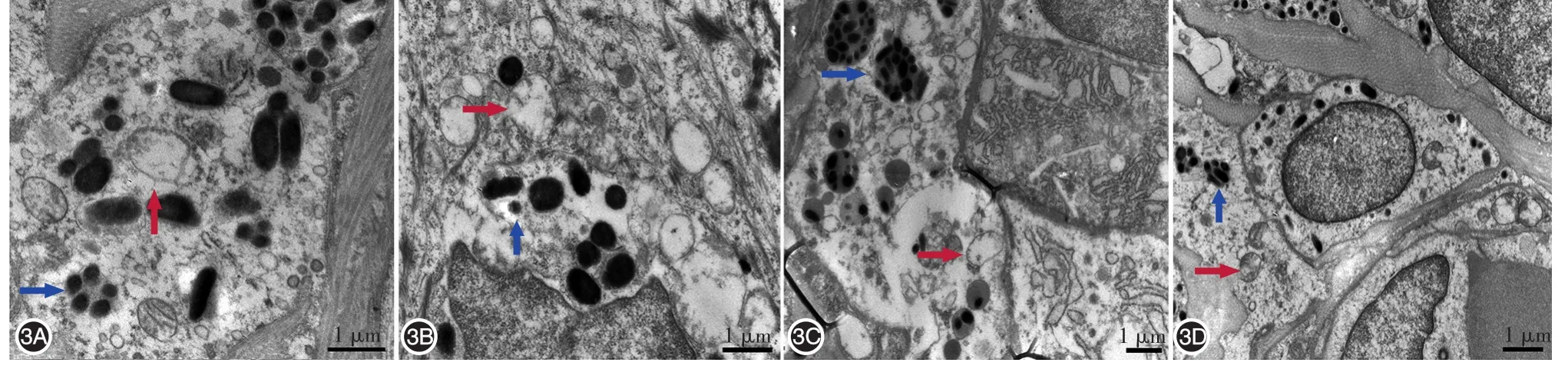
圖3 透射電鏡觀察中波紫外線(UVB)與表沒食子兒茶素沒食子酸酯(EGCG)處理后小鼠皮膚自噬體的變化 3A:丙酮對照組,可見膜結構狀自噬溶酶體及溶酶體內黑素小體集合體;3B:UVB組,自噬溶酶體明顯增多,并見少量溶酶體內黑素小體集合體;3C:UVB+EGCG組,自噬溶酶體明顯增加,且溶酶體內黑素小體集合體多見;3D:EGCG組,與對照組相比自噬體稍增多,可見少量溶酶體內黑素小體集合體。紅色箭頭示自噬溶酶體,藍色箭頭示溶酶體內黑素小體集合體
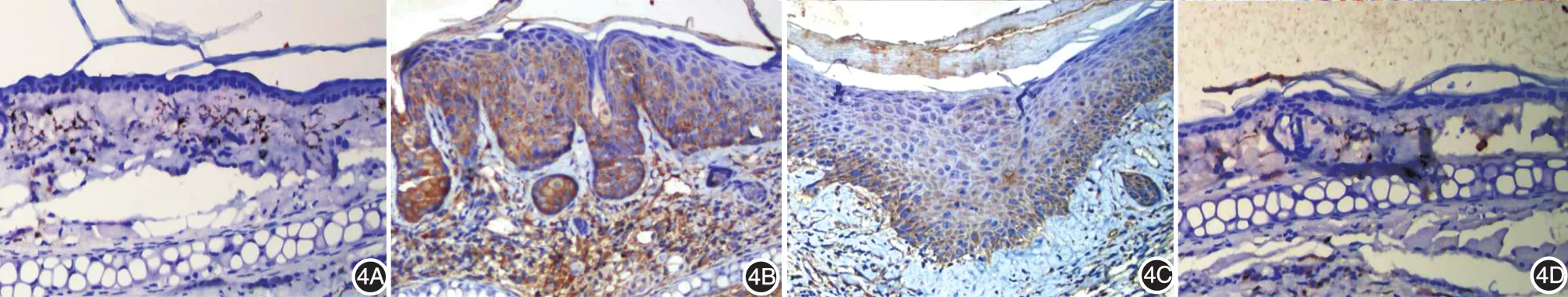
圖4 各組小鼠耳部皮膚蛋白酶活性受體2(PAR2)的表達變化(免疫組化×200) 4A:丙酮對照組,表皮無明顯變化,PAR2少量表達;4B:UVB組,表皮明顯增厚,PAR2表達增加;4C:UVB+EGCG組,表皮明顯增厚,與UVB組相比,PAR2表達減少;4D:EGCG組,表皮無明顯變化
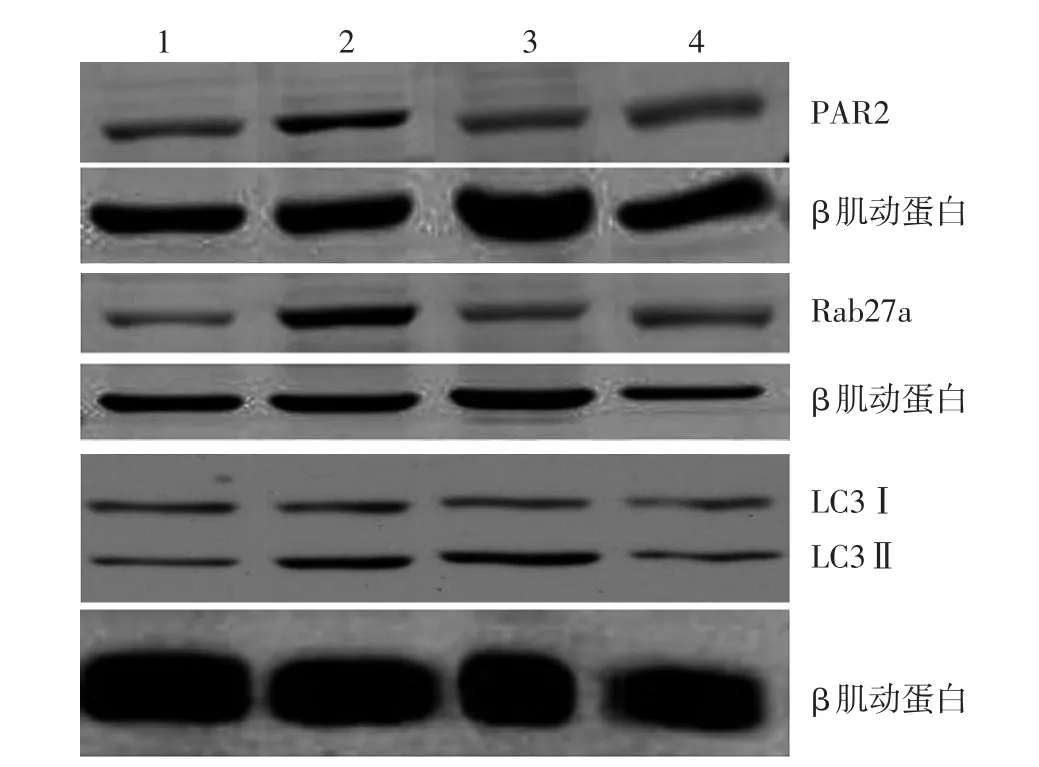
圖5 免疫印跡檢測轉運相關蛋白酶活性受體2(PAR2)、Rab27a與微管相關蛋白輕鏈3(LC3)的表達變化 1:丙酮對照組;2:中波紫外線(UVB)照射組;3:UVB+表沒食子兒茶素沒食子酸酯(EGCG)組;4:EGCG組
討 論
黃褐斑是臨床常見的色素增加性皮膚病,病理表現為表皮全層黑素顆粒增加,與黑素代謝異常有關[3]。在黑素代謝過程中,黑素小體在黑素細胞中合成后轉移入角質形成細胞并重新分布和降解,隨角質形成細胞不斷分化逐層上移,最后隨角質層脫落而排出[4]。黑素小體轉移至角質形成細胞并在其中降解的過程,對皮膚的色素代謝至關重要,其功能紊亂可導致皮膚色素沉著。
UVB照射可以促進黑素細胞增殖、黑素合成增加,也可以促進黑素小體向角質形成細胞中轉運增加[5]。Rab27a是一種組織特異性蛋白,Kukimoto?Niino等[6]研究發現,Rab27a可與其特異效應分子Slac2?a結合,定位到成熟黑素小體表面,介導黑素小體轉運。PAR2位于角質形成細胞膜表面,是跨膜G蛋白耦聯受體,可被絲氨酸蛋白酶剪切而活化,進一步介導黑素小體轉移[7]。本研究顯示,UVB照射后,小鼠皮膚黑素小體顯著增加,轉運相關蛋白Rab27a及PAR2表達明顯增多,表明UVB照射可以促進黑素小體轉運,其機制可能與促進Rab27a及PAR2表達增加有關。既往研究證實,EGCG能夠抑制黑素細胞小眼畸形相關轉錄因子(MITF)轉錄活性,抑制酪氨酸酶活性和蛋白表達,從而抑制黑素合成[8]。本研究中我們采用EGCG丙酮溶液外涂小鼠皮膚,結果顯示,EGCG可以抑制UVB照射誘導的Rab27a及PAR2表達,從而抑制黑素小體轉運和轉移;電鏡下發現,EGCG處理后小鼠皮膚角質形成細胞中黑素小體顯著減少,表明EGCG可以通過抑制黑素小體的轉運和轉移發揮美白作用。
黑素小體轉運至角質形成細胞后進行再分布與降解,其降解機制與細胞自噬相關。Murase等[1]研究發現,白種人角質形成細胞自噬活性比黑種人高,自噬可能通過促進角質形成細胞中黑素小體的降解而使皮膚顏色變白。進一步采用特異性siRNA抑制自噬相關基因ATG7表達可以顯著增加黑素小體PMEL17的表達,同時伴有自噬相關蛋白LC3Ⅱ蛋白表達減少,表明抑制自噬可以減少黑素小體降解。Kim等[9]研究發現,通過誘導細胞自噬反應,可以顯著抑制α促黑素細胞激素(α?MSH)引起的皮膚色素沉著。這些研究均證實,細胞自噬參與角質形成細胞內黑素小體降解。既往研究已經證實,UVB照射可以促進角質形成細胞的自噬活性[10?11],而EGCG也可以促進血管內皮細胞的自噬活性,減少脂質沉積[12]。電鏡下自噬溶酶體是溶酶體單層膜空泡樣結構,其內含吞噬的細胞器碎片;自噬體是經典的雙層膜結構;部分溶酶體內可見黑素小體集合體,認為是溶酶體包裹多個黑素小體形成的結構。由于自噬是動態的自噬流,因此電鏡可能難以捕捉到,本研究電鏡可能觀察到的是自噬溶酶體。本研究電鏡結果顯示,UVB照射后小鼠皮膚角質形成細胞自噬泡及自噬溶酶體明顯增加,但溶酶體內未見黑素小體集合體;EGCG處理后角質形成細胞中自噬泡及自噬溶酶體進一步增加,可能提示黑素小體降解增多。既往研究認為,黑素小體集合體是溶酶體包裹的黑素小體,通常在淺色皮膚中較易發現;黑素小體被溶酶體包裹后更易降解,從而導致皮膚顏色變淡[13?15]。黑素小體集合體可以是黑素細胞轉移而來,也可以是角質形成細胞內溶酶體吞噬形成,本研究中未用免疫電鏡標記,尚不能精確區分,但仍提示EGCG可能促進溶酶體吞噬黑素小體,加速黑素小體降解。本研究免疫組化結果未提示EGCG處理后表皮LC3表達增加,推測原因可能是表皮總LC3生成沒有顯著增加。但免疫印跡發現,EGCG處理后,UVB+EGCG組較UVB組小鼠表皮LC3Ⅱ/LC3Ⅰ比值顯著增加,推測其原因可能是EGCG通過增加LC3Ⅱ表達促進自噬發生。另外,EGCG也可以通過其他途徑促進自噬,如AKT/STAT3途徑等[16]。我們在今后研究中將進一步探討EGCG的其他促自噬機制。
本研究發現,EGCG能夠有效抑制UVB誘導皮膚色素沉著,作用機制可能與抑制黑素轉運及促進黑素降解有關。EGCG抑制黑素轉運的機制可能與抑制轉運相關蛋白Rab27a及PAR2表達有關,促進黑素降解的機制可能與促進自噬相關蛋白LC3Ⅱ/LC3Ⅰ比值和增加細胞自噬有關。提示可能通過促進細胞自噬誘導黑素小體降解。
[1]Murase D,Hachiya A,Takano K,et al.Autophagy has a significantrole in determining skin color by regulating melanosome degradation in keratinocytes[J].J Invest Dermatol,2013,133(10):2416?2424.DOI:10.1038/jid.2013.165.
[2]Ho H,Ganesan AK.The pleiotropic roles of autophagy regulators in melanogenesis[J].Pigment Cell Melanoma Res,2011,24(4):595?604.DOI:10.1111/j.1755?148X.2011.00889.x.
[3]Kang WH,Yoon KH,Lee ES,et al.Melasma:histopathological characteristics in 56 Korean patients[J].Br J Dermatol,2002,146(2):228?237.DOI:10.1046/j.0007?0963.2001.04556.x.
[4]Weiner L,Fu W,Chirico WJ,et al.Skin as a living coloring book:how epithelial cells create patterns of pigmentation[J].Pigment Cell Melanoma Res,2014,27(6):1014 ?1031.DOI:10.1111/pcmr.12301.
[5]Hachiya A,Sriwiriyanont P,Kaiho E,et al.Anin vivomouse model of human skin substitute containing spontaneously sorted melanocytesdemonstratesphysiologicalchangesafterUVB irradiation[J].J Invest Dermatol,2005,125(2):364?372.DOI:10.1111/j.0022?202X.2005.23832.x.
[6]Kukimoto?Niino M,Sakamoto A,Kanno E,et al.Structural basis for the exclusive specificity of Slac2?a/melanophilin for the Rab27 GTPases[J].Structure,2008,16(10):1478?1490.DOI:10.1016/j.str.2008.07.014.
[7]Seiberg M,Paine C,Sharlow E,et al.The protease?activated receptor 2 regulates pigmentation via keratinocyte?melanocyte interactions[J].Exp Cell Res,2000,254(1):25 ?32.DOI:10.1006/excr.1999.4692.
[8]Kim DS,Park SH,Kwon SB,et al.(?)?Epigallocatechin?3?gallate and hinokitiol reduce melanin synthesis via decreased MITF production[J].Arch Pharm Res,2004,27(3):334 ?339.DOI:10.1007/BF02980069.
[9]Kim ES,Chang H,Choi H,et al.Autophagy induced by resvera?trol suppresses α ?MSH ?induced melanogenesis[J].Exp Dermatol,2014,23(3):204?206.DOI:10.1111/exd.12337.
[10]黃丹,任發亮,陳旭,等.不同劑量中波紫外線照射對角質形成細胞增殖活力和自噬體表達影響的研究[J].中華皮膚科雜志,2013,46(12):881 ?884.DOI:10.3760/cma.j.issn.0412 ?4030.2013.12.010.
[11]金慧,陳旭,徐松,等.不同劑量中波紫外線對HaCaT細胞p62及自噬體形成關鍵基因Beclin?1、Atg12和Atg3的調控效應研究[J].中華皮膚科雜志,2014,47(4):233?236.DOI:10.3760/cma.j.issn.0412?4030.2014.04.001.
[12]Kim HS,Montana V,Jang HJ,et al.Epigallocatechin gallate(EGCG)stimulates autophagy in vascular endothelial cells:a potential role for reducing lipid accumulation[J].J Biol Chem,2013,288(31):22693?22705.DOI:10.1074/jbc.M113.477505.
[13]Ebanks JP,Koshoffer A,Wickett RR,et al.Epidermal kera?tinocytes from lightvs.dark skin exhibit differential degradation of melanosomes[J].J Invest Dermatol,2011,131(6):1226 ?1233.DOI:10.1038/jid.2011.22.
[14]Minwalla L,Zhao Y,Le PIC,et al.Keratinocytes play a role in regulating distribution patterns of recipient melanosomesin vitro[J].J Invest Dermatol,2001,117(2):341?347.DOI:10.1046/j.0022?202x.2001.01411.x.
[15]Thong HY,Jee SH,Sun CC,et al.The patterns of melanosome distribution in keratinocytes of human skin as one determining factor of skin colour[J].Br J Dermatol,2003,149(3):498?505.DOI:10.1046/j.1365?2133.2003.05473.x.
[16]Yuan CH,Horng CT,Lee CF,et al.Epigallocatechin gallate sensitizes cisplatin?resistant oral cancer CAR cell apoptosis and autophagy through stimulating AKT/STAT3 pathway and suppressing multidrug resistance 1 signaling[J].Environ Toxicol,2017,32(3):845?855.DOI:10.1002/tox.22284.
Effect of epigallocatechin gallate on ultraviolet B?induced transfer and degradation of melanosomes in mice
Jia Xiaoxiao,Hu Wenting,Wang Min,Hua You,Gao Yali,Geng Qingwei,Li Liuyu,Song Xiuzu
Department of Dermatology,Hangzhou Third Hospital,Zhejiang Chinese Medical University,Hangzhou 310009,China
Song Xiuzu,Email:songxiuzu@sina.com
ObjectiveTo evaluate the effect of tea polyphenol epigallocatechin gallate(EGCG)on ultraviolet B(UVB)?induced skin pigmentation,transfer and degradation of melanosomes in mice,and to explore the role of autophagy in the mechanism of melanosome degradation.MethodsA total of 32 ears from 16 female C57/BL6 mice were randomly and equally divided into 4 groups:acetone control group topically treated with acetone solution daily,EGCG group topically treated with 10 g/L EGCG acetone solution daily,UVB irradiation group irradiated with 500 mJ/cm2UVB once a day and 2 hours later topically treated with acetone solution,UVB+EGCG group irradiated with 500 mJ/cm2UVB once a day and 2 hours later topically treated with EGCG acetone solution.Ten days later,all the mice were sacrificed,and skin tissue samples were collected from the ears.Transmission electron microscopy was performed to observe ultrastructural changes of melanosomes and autophagosomes,immunohistochemical study to measure expression of protease?activated receptor 2(PAR2)and microtubule?associated protein light chain 3(LC3)in the epidermis,and Western blot analysis to determine the protein expression of PAR2,Ras?related protein Rab27a and LC3 in the epidermis.ResultsThere was a significant difference in the number of melanosomes and autophagosomes among the acetone control group,EGCG group,UVB irradiation group and UVB+EGCG group(H=12.249,13.888,respectively,bothP< 0.05).Compared with the acetone control group,the UVB irradiation group showed significantly increased number of melanosomes(1.85±0.32vs.1.00±0.41,P<0.05)and autophagosomes(1.94±0.64vs.1.00±0.46,P<0.05)in epidermal keratinocytes in mouse skin.Compared with the UVB irradiation group,the UVB+EGCG group showed significantly decreased number of melanosomes(1.30 ± 0.44,P< 0.05),but significantly increased number of autophagosomes(3.03 ± 0.75,P< 0.05).Immunohistochemical study showed a significant difference in the level of PAR2 in the epidermis among the 4 groups(H=18.700,P<0.05),and the expression of PAR2 was significantly lower in the UVB+EGCG group than in the UVB irradiation group(7.94±4.57vs.12.54±3.07,Z=2.143,P<0.05).However,the 4 groups all showed a low level of LC3,and there was no significant difference among the 4 groups(H=5.051,P> 0.05).Western blot analysis revealed significant differences in the protein expression of PAR2 and Rab27a,as well as in the LC3?Ⅱ/LC3?Ⅰratio,among the 4 groups(F=18.739,25.967,24.022,respectively,allP<0.05).Compared with the UVB irradiation group,the UVB+EGCG group showed significantly decreased expression of PAR2(0.91±0.54vs.3.12±0.61,P<0.05)and Rab27a(0.99±0.16vs.1.42±0.07,P<0.05),but significantly increased LC3?Ⅱ/LC3?Ⅰratio(1.67 ± 0.08vs.1.24 ± 0.07,P< 0.05).ConclusionTopical EGCG treatment can effectively suppress UVB?induced skin pigmentation,which may be related to the inhibition of melanosome transfer and promotion of melanosome autophagy.
Polyphenols;Ultraviolet rays;Autophagy;Melanins;Epigallocatechin gallate
Fund programs:National Natural Science Foundation of China(81000697);Hangzhou Science and Technology Development Program(20130733Q24)
宋秀祖,Email:songxiuzu@sina.com
10.3760/cma.j.issn.0412?4030.2017.12.001
國家自然科學基金(81000697);杭州市科技發展計劃項目(20130733Q24)
2016?10?13)
尚淑賢)

