二甲雙胍灌胃對(duì)支氣管哮喘小鼠氣道重塑的影響及機(jī)制探討
李小龍,王榮麗
(西南醫(yī)科大學(xué)附屬醫(yī)院,四川瀘州 646000)
二甲雙胍灌胃對(duì)支氣管哮喘小鼠氣道重塑的影響及機(jī)制探討
李小龍,王榮麗
(西南醫(yī)科大學(xué)附屬醫(yī)院,四川瀘州 646000)
目的觀察二甲雙胍灌胃對(duì)支氣管哮喘小鼠氣道重塑的影響,并探討其可能機(jī)制。方法將30只清潔級(jí)C57BL/6雌性小鼠隨機(jī)分為對(duì)照組、模型組、觀察組各10只。模型組及觀察組于實(shí)驗(yàn)第0、7、14天腹腔注射100 μg卵清蛋白(OVA)+2 mg氫氧化鋁致敏,并在第21~60 d采用50 μg OVA(3次/周)滴鼻激發(fā)建立支氣管哮喘模型;對(duì)照組以等量生理鹽水腹腔注射致敏及滴鼻激發(fā)。自第21天起,觀察組小鼠灌胃300 mg/(kg·d),模型組及對(duì)照組灌胃等量生理鹽水。行HE染色觀察肺組織病理情況,masson染色下利用Image-Pro Plus 6.0圖像分析系統(tǒng)測(cè)算氣道基底膜下膠原面積比及支氣管壁、平滑肌厚度,ELISA法檢測(cè)血清轉(zhuǎn)化生長因子β1(TGF-β1)、基質(zhì)金屬蛋白酶9(MMP-9)、基質(zhì)金屬蛋白酶抑制劑1(TIMP-1),RT-PCR法檢測(cè)肺組織MMP-9、TIMP-1 mRNA。結(jié)果對(duì)照組支氣管、肺泡等結(jié)構(gòu)相對(duì)完整;模型組小鼠見支氣管管壁增厚,氣道黏膜上皮增生,氣管內(nèi)黏液滲出,肺泡結(jié)構(gòu)破壞等明顯;觀察組上述改變較模型組明顯減輕。與對(duì)照組比較,模型組及觀察組氣道基底膜下膠原面積比、支氣管壁厚度、平滑肌細(xì)胞厚度增加,血清TGF-β1、MMP-9、TIMP-1水平及肺組織MMP-9、TIMP-1 mRNA表達(dá)升高(P均<0.05);與模型組比較,觀察組氣道基底膜下膠原面積比、支氣管壁厚度、平滑肌細(xì)胞厚度減少,血清TGF-β1、MMP-9、TIMP-1水平及肺組織MMP-9、TIMP-1 mRNA表達(dá)降低(P均<0.05)。結(jié)論二甲雙胍可改善支氣管哮喘氣道重塑,其機(jī)制可能為抑制TGF-β1、MMP-9、TIMP-1表達(dá)。
哮喘;二甲雙胍;氣道重塑;轉(zhuǎn)化生長因子β1;基質(zhì)金屬蛋白酶9;基質(zhì)金屬蛋白酶抑制劑1
哮喘也稱支氣管哮喘,是由多種細(xì)胞(氣道上皮細(xì)胞、平滑肌細(xì)胞、嗜酸性粒細(xì)胞、肥大細(xì)胞等)及細(xì)胞組分參與的慢性氣道炎癥性疾病,氣道高反應(yīng)性、氣道炎癥及氣道重塑被認(rèn)為是其主要疾病特征。研究表明,氣道平滑肌、氣道上皮組織、新血管生成及細(xì)胞外基質(zhì)(ECM)等參與了氣道重塑的發(fā)生發(fā)展。轉(zhuǎn)化生長因子β1(TGF-β1)作為致纖維化最強(qiáng)的一種細(xì)胞因子,其與基質(zhì)金屬蛋白酶9(MMP-9)、基質(zhì)金屬蛋白酶抑制劑1(TIMP-1)都參與了哮喘氣道重塑過程[1]。二甲雙胍屬雙胍類藥物,是一種常見的一線治療糖尿病類藥物,其在治療糖尿病方面發(fā)揮重要作用。而近年研究[2,3]發(fā)現(xiàn),二甲雙胍不僅在治療糖尿病方面發(fā)揮作用,其在抑制氣道炎癥方面也發(fā)揮重要作用。Li等[4]發(fā)現(xiàn),使用二甲雙胍的哮喘患者住院治療率及急性加重率均較未使用者低。除氣道炎癥外,氣道重塑也被認(rèn)為是支氣管哮喘的另一大疾病特征。那么二甲雙胍在治療哮喘中是否對(duì)氣道重塑也產(chǎn)生影響目前尚不明確。本研究觀察了二甲雙胍對(duì)支氣管哮喘小鼠氣道重塑的影響,并探討其可能機(jī)制。
1 材料與方法
1.1 材料 清潔級(jí)C57BL/6雌性小鼠30只(重慶騰鑫比爾實(shí)驗(yàn)動(dòng)物銷售有限公司),6~8周齡,體質(zhì)量18~20 g。生理鹽水,卵清蛋白(OVA),氫氧化鋁[AL(OH)3];鹽酸二甲雙胍片(0.85 g/片);小鼠血清TGF-β1、MMP-9、TIMP-1 ELISA試劑盒;PCR儀;熒光定量PCR儀;Image-Pro Plus 6.0圖像分析系統(tǒng)。
1.2 實(shí)驗(yàn)動(dòng)物分組、支氣管哮喘模型制備及二甲雙胍給予方法 將30只C57BL/6雌性小鼠隨機(jī)分為對(duì)照組、模型組、觀察組各10只。參照Koh等[5]的方法建立支氣管哮喘模型,模型組與觀察組分別于第0、7、14天腹腔注射200 μL致敏液[100 μg OVA+2 mg AL(OH)3溶于200 μL生理鹽水],對(duì)照組腹腔注射等量生理鹽水。自第21~60天,每次在用1%戊巴比妥鈉50 mg/kg腹腔麻醉后,模型組及觀察組給予50 μL激發(fā)液(50 μg OVA溶于50 μL生理鹽水中)經(jīng)鼻滴入,每周3次滴鼻,共計(jì)18次;對(duì)照組則以等量生理鹽水滴鼻激發(fā),滴鼻頻率與模型組及觀察組相同。自第21天起,觀察組灌胃300 mg/(kg·d)二甲雙胍[2],對(duì)照組及模型組灌胃等量生理鹽水。
1.3 肺組織病理組織學(xué)觀察 在末次激發(fā)24 h內(nèi),所有小鼠均以眼球摘除取血法處死。處死小鼠后,暴露肺組織,分離并取出左肺上葉,將左肺上葉組織再行脫水、包埋、切片,后行HE染色,光鏡下觀察肺組織形態(tài)、氣道重塑、肺泡損傷及炎癥細(xì)胞浸潤等情況。
1.4 氣道基底膜下膠原面積比、支氣管壁厚度、平滑肌厚度測(cè)算 在光鏡下(10×20)同一樣本隨機(jī)選取3個(gè)視野,測(cè)算膠原面積比,采用Image-Pro Plus測(cè)量膠原面積、整個(gè)圖像總面積,計(jì)算膠原面積比,膠原面積比(%)=(膠原面積/整個(gè)圖像總面積)×100%。光鏡下(10×20)下選取單個(gè)完整的肺支氣管橫截面,每個(gè)標(biāo)本隨機(jī)選取3個(gè)直徑在100~200 μm完整的氣道橫截面進(jìn)行測(cè)量分析,用Image-Pro Plus(6.0)測(cè)量肺完整支氣管基底膜周徑(Pbm)、支氣管總面積(Wat1)、支氣管管腔面積(Wat2)、平滑肌外緣內(nèi)氣管面積(Warm1)、平滑肌內(nèi)緣內(nèi)氣管面積(Warm2),同時(shí)用Pbm將測(cè)量值標(biāo)準(zhǔn)化,標(biāo)準(zhǔn)化平滑肌厚度(warn)=(Warm1-Warm2)/Pbm,標(biāo)準(zhǔn)化總管壁厚度(Wat)=(Wat1-Wat2)/Pbm。
1.5 血清TGF-β1、MMP-9、TIMP-1檢測(cè) 實(shí)驗(yàn)小鼠均以眼球摘除取血法處死,摘除眼球時(shí),分別取小鼠血液。血液在3 500 r/min條件下離心10 min,取血清,將收集的血清在-80 ℃環(huán)境下保存?zhèn)溆谩2捎肊LISA法檢測(cè)血清TGF-β1、MMP-9、TIMP-1,按照ELISA試劑盒說明操作。
1.6 肺組織MMP-9、TIMP-1 mRNA檢測(cè) 處死小鼠后,取出右肺組織,-80 ℃保存,用已經(jīng)消毒的工具于冰上取約100 mg肺組織,通過TRIzol法充分溶解提取組織總RNA。在逆轉(zhuǎn)錄酶的作用下進(jìn)行反轉(zhuǎn)錄,之后再以cDNA(互補(bǔ)脫氧核糖核苷酸)為模板行PCR擴(kuò)增。PCR擴(kuò)增引物:GAPDH上游引物:5′-TGAAGGGTGGAGCCAAAAG-3′,GAPDH下游引物:5′-AGTCTTCTGGGTGGCAGTGAT-3′;MMP-9上游引物:5′-AAGG GTACAGCCTGTTCCTGGT-3′,MMP-9下游引物:5′-CTGGATGCCGTCTATGTCGTCT-3′;TIMP-1上游引物:5′-CCAGAAATCATCGAGACCACC-3′,TIMP-1下游引物:5′-ATTTCCGTTCCTTAAACGGC-3′。反應(yīng)體系:10 μL反應(yīng)體系中含有2×qPCR Mix 5.0 μL、引物工作液(2.5 μmol/L)1.0 μL、模板1.0 μL、蒸餾水2.8 μL、Rox參比染料0.2 μL。反應(yīng)程序:預(yù)變性95 ℃、1 min;然后95 ℃、15 s→58 ℃、20 s→72 ℃、45 s(共循環(huán)40次);熔解曲線60 ℃→95 ℃,每20 s升溫1 ℃。結(jié)束PCR后,計(jì)算目的基因與相對(duì)應(yīng)的內(nèi)參GAPDH的ΔCt(Ct值之差),采用ΔΔCT法來計(jì)算目的基因的相對(duì)表達(dá)量。
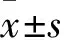
2 結(jié)果
2.1 各組肺組織病理學(xué)變化 對(duì)照組可見支氣管、氣道黏膜上皮、肺泡結(jié)構(gòu)完整,氣管內(nèi)未見明顯黏液。模型組可見支氣管管壁明顯增厚,氣道黏膜上皮增生,氣管內(nèi)黏液滲出明顯,肺泡結(jié)構(gòu)破壞,并伴有大量的炎性細(xì)胞浸潤。觀察組可見支氣管及肺泡結(jié)構(gòu)稍完整,支氣管管壁稍增厚,炎性細(xì)胞滲出較少,同時(shí)管腔內(nèi)黏液滲出不明顯。
2.2 各組氣道膠原面積比、支氣管壁厚度、平滑肌厚度比較 結(jié)果見表1。
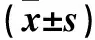
表1 各組氣道膠原面積比、支氣管壁厚度、平滑肌厚度比較
注:與對(duì)照組比較,*P<0.05;與模型組比較,#P<0.05。
2.3 各組血清TGF-β1、MMP-9、TIMP-1水平比較 結(jié)果見表2。

表2 各組血清TGF-β1、MMP-9、TIMP-1水平比較
注:與對(duì)照組比較,*P<0.05;與模型組比較,#P<0.05。
2.4 各組肺組織MMP-9、TIMP-1 mRNA相對(duì)表達(dá)量比較 結(jié)果見表3。

表3 各組肺組織MMP-9、TIMP-1 mRNA相對(duì)表達(dá)量比較
注:與對(duì)照組比較,*P<0.05;與模型組比較,#P<0.05。
3 討論
哮喘是一種以氣道慢性炎癥為主要特征的疾病,支氣管哮喘可引起肺功能進(jìn)行性損傷及下降,最終導(dǎo)致氣道可逆或不可逆的氣道阻塞,這些變化則被稱為氣道重塑。氣道重塑作為一種重要的病理特征,其在支氣管哮喘的發(fā)生發(fā)展過程中起重要作用。而氣道上皮損傷,氣道上皮下纖維化,平滑肌細(xì)胞肥大、增生,基底膜下纖維蛋白沉積,基底膜及氣道壁增厚,杯狀細(xì)胞和黏膜下腺體肥大是氣道重塑的主要特征[6]。
TGF-β作為一種具有多種功能的調(diào)節(jié)性細(xì)胞因子,主要由肺組織內(nèi)的上皮細(xì)胞、肺巨噬細(xì)胞及肺組織外的內(nèi)皮細(xì)胞、巨噬細(xì)胞及血小板分泌。TGF-β家族中主要包括TGF-β1、TGF-β2、TGF-β3,其中對(duì)TGF-β1的研究最為廣泛。經(jīng)過多年研究及實(shí)驗(yàn)證實(shí),TGF-β1是具有多種功能的調(diào)節(jié)性細(xì)胞因子,不僅參與了哮喘的慢性氣道炎癥,同時(shí)還在氣道重塑中起重要作用。TGF-β1一方面可直接或通過絲裂原激活蛋白酶、結(jié)締組織生長因子等信號(hào)通路刺激成纖維細(xì)胞的增殖,另一方面還能夠促進(jìn)成纖維細(xì)胞合成分泌ECM,促進(jìn)氣道膠原沉積及纖維化[7,8]。
MMP-9作為一種糖化蛋白酶,屬于基金屬蛋白酶家族中的成員,其主要由巨噬細(xì)胞、中性粒細(xì)胞、嗜酸性粒細(xì)胞等分泌。作為基金屬蛋白酶家族中的成員之一,由于其與支氣管哮喘密切相關(guān)而受到大家關(guān)注。研究發(fā)現(xiàn),MMP-9與哮喘氣道炎癥密切相關(guān);另研究表明,在敲除MMP-9相關(guān)基因的小鼠哮喘模型與未敲除的小鼠哮喘模型相比較,發(fā)現(xiàn)在暴露于變應(yīng)原后,敲除MMP-9基因小鼠氣管周圍炎癥細(xì)胞的浸潤及肺泡灌洗液中的炎癥細(xì)胞均較未敲MMP-9基因小鼠減少,提示MMP-9密切參與了支氣管哮喘氣道炎癥過程[9,10]。除此之外,MMP-9作為調(diào)節(jié)ECM降解的主要限速酶,還參與了支氣管哮喘氣道重塑過程。一方面,MMP-9能夠降解以Ⅳ型膠原纖維蛋白為主的ECM,從而促進(jìn)炎性細(xì)胞及氣道平滑肌細(xì)胞(ASM)等細(xì)胞遷移,并促進(jìn)ASM增生、肥大。另一方面,ASM也能產(chǎn)生相當(dāng)數(shù)量的MMP-9,進(jìn)而形成惡性循環(huán)[11]。增生肥大的ASM產(chǎn)生更多的ECM,進(jìn)而加速支氣管哮喘氣道重塑的進(jìn)程。而MMP-9在哮喘氣道血管重塑中同樣發(fā)揮重要作用,其促使平滑肌細(xì)胞移至血管基質(zhì),使血管表面積增加,促使新血管生成,而上述作用是因?yàn)镸MP-9能夠降解血管中的膠原成分所導(dǎo)致。另外,MMP-9還能夠通過促進(jìn)血管內(nèi)皮生長因子釋放,促進(jìn)氣道基底膜下新生血管形成[12,13]。TIMP-1作為MMP-9特異性的內(nèi)源性抑制劑,其水平升高可能是機(jī)體的一種內(nèi)源性保護(hù)機(jī)制,其可抑制MMP-9降解ECM。但抑制MMP-9的活性最終導(dǎo)致基底膜下ECM的增加,從而參與哮喘的氣道重塑。
二甲雙胍是傳統(tǒng)的一線治療糖尿病藥物,不僅在治療糖尿病方面起重要作用,還在心血管疾病、哮喘等多方面發(fā)揮重要作用[4,14]。二甲雙胍藥理作用的主要分子機(jī)制是通過激活腺苷酸活化蛋白激酶(AMPK)發(fā)揮作用。本研究顯示,與模型組比較,觀察組氣道重塑也得到明顯改善,血清TGF-β1水平降低,提示二甲雙胍可能通過調(diào)節(jié)TGF-β1從而發(fā)揮作用。根據(jù)目前研究來看,二甲雙胍可能是通過smad2/3通路及PKM2相關(guān)mTOR/p70s6k信號(hào)通路參與負(fù)性調(diào)節(jié)TGF-β1,從而參與哮喘氣道重塑[15~17]。本研究還發(fā)現(xiàn),與模型組比較,觀察組氣道膠原面積比、支氣管壁厚度、平滑肌厚度減小,血清MMP-9、TIMP-1水平及肺組織MMP-9、TIMP-1 mRNA表達(dá)降低,提示二甲雙胍在參與支氣管哮喘氣道重塑的過程中,不僅依賴TGF-β1發(fā)揮作用,還通過調(diào)節(jié)MMP-9、TIMP-1的表達(dá)參與氣道重塑。二甲雙胍降低MMP-9的表達(dá)可能是通過AMPK/mTOR信號(hào)通路及ERK/INK介導(dǎo)的NF-κB依賴途徑而產(chǎn)生作用[18,19]。至于TIMP-1,由于目前缺乏二甲雙胍與TIMP-1之間的相關(guān)研究,因而目前在哮喘氣道重塑中,二甲雙胍與TIMP-1之間的聯(lián)系尚未明確。
總之,二甲雙胍可改善支氣管哮喘氣道重塑,其機(jī)制可能為抑制TGF-β1、MMP-9、TIMP-1表達(dá)。
[1] Calikoglu M, Unlu A, Tamer L, et al. MMP-9 and TIMP-1 levels in the sputum of patients with chronic obstructive pulmonary disease and asthma[J]. Tuberk Toraks, 2006,54(2):114-121.
[2] Calixto MC, Lintomen L, Andre DM, et al. Metformin attenuates the exacerbation of the allergic eosinophilic inflammation in high fat-diet-induced obesity in mice[J]. PLoS One, 2013,8(10):767-786.
[3] Park CS, Bang BR, Kwon HS, et al. Metformin reduces airway inflammation and remodeling via activation of AMP-activated protein kinase[J]. Biochem Pharmacol, 2012,84(12):1660-1670.
[4] Li CY, Erickson SR, Wu CH. Metformin use and asthma outcomes among patients with concurrent asthma and diabetes[J]. Respirology, 2016,21(7):1210-1218.
[5] Koh YI, Shim JU, Lee JH, et al. Natural killer T cells are dispensable in the development of allergen-induced airway hyperresponsiveness, inflammation and remodelling in a mouse model of chronic asthma[J]. Clin Exp Immunol, 2010,161(1):159-170.
[6] Gras D, Bourdin A, Chanez P, et al. Airway remodeling in asthma: clinical and functional correlates[J]. Med Sci (Paris), 2011,27(11):959-965.
[7] Schaafsma D, McNeill KD, Mutawe MM, et al. Simvastatin inhibits TGFbeta1-induced fibronectin in human airway fibroblasts[J]. Respir Res, 2011,24(12):113-123.
[8] Makinde T, Murphy RF, Agrawal DK. The regulatory role of TGF-beta in airway remodeling in asthma[J]. Immunol Cell Biol, 2007,85(5):348-356.
[9] Cataldo DD, Tournoy KG, Vermaelen K, et al. Matrix metalloproteinase-9 deficiency impairs cellular infiltration and bronchial hyperresponsiveness during allergen-induced airway inflammation[J]. Am J Pathol, 2002,161(2):491-498.
[10] Ma HP, Li W, Liu XM. Matrix metalloproteinase 9 is involved in airway inflammation in cough variant asthma[J]. Exp Ther Med, 2014,8(4):1197-1200.
[11] Elshaw SR, Henderson N, Knox AJ, et al. Matrix metalloproteinase expression and activity in human airway smooth muscle cells[J]. Br J Pharmacol, 2004,142(8):1318-1324.
[12] Lee KS, Min KH, Kim SR, et al. Vascular endothelial growth factor modulates matrix metalloproteinase-9 expression in asthma[J]. Am J Respir Crit Care Med, 2006,174(2):161-170.
[13] Yuksel H, Yilmaz O, Karaman M, et al. Role of vascular endothelial growth factor antagonism on airway remodeling in asthma[J]. Ann Allergy Asthma Immunol, 2013,110(3):150-155.
[14] Xiao H, Zhang J, Xu Z, et al. Metformin is a novel suppressor for transforming growth factor(TGF)-beta1[J]. Sci Rep, 2016,6(10):285-297.
[15] Fan K, Wu K, Lin L, et al. Metformin mitigates carbon tetrachloride-induced TGF-beta1/Smad3 signaling and liver fibrosis in mice[J]. Biomed Pharmacother, 2017,90(12):421-442.
[16] Cheng K, Hao M. Metformin inhibits TGF-beta1-induced epithelial-to-mesenchymal transition via PKM2 relative-mTOR/p70s6k signaling pathway in cervical carcinoma cells[J]. Int J Mol Sci, 2016,17(12):2000-2015.
[17] Park IH, Um JY, Hong SM, et al. Metformin reduces TGF-beta1-induced extracellular matrix production in nasal polyp-derived fibroblasts[J]. Otolaryngol Head Neck Surg, 2014,150(1):148-153.
[18] Li WD, Li NP, Song DD, et al. Metformin inhibits endothelial progenitor cell migration by decreasing matrix metalloproteinases, MMP-2 and MMP-9, via the AMPK/mTOR/autophagy pathway[J]. Int J Mol Med, 2017,29(12):1262-1268.
[19] Hsieh SC, Tsai JP, Yang SF, et al. Metformin inhibits the invasion of human hepatocellular carcinoma cells and enhances the chemosensitivity to sorafenib through a downregulation of the ERK/JNK-mediated NF-kappaB-dependent pathway that reduces uPA and MMP-9 expression[J]. Amino Acids, 2014,46(12):2809-2822.
10.3969/j.issn.1002-266X.2017.47.011
R562.2
A
1002-266X(2017)47-0038-04
王榮麗(E-mail: scybwrl@sina.com)
2017-07-04)

