去甲腎上腺素對人肝癌細胞HepG2和人正常肝細胞L-02增殖、凋亡的影響
施媛萍,羅光華,鄭璐,魏江,于洋
(1蘇州大學附屬第三醫(yī)院,江蘇常州 213003;2常州市第一人民醫(yī)院)
去甲腎上腺素對人肝癌細胞HepG2和人正常肝細胞L-02增殖、凋亡的影響
施媛萍1,2,羅光華1,2,鄭璐1,2,魏江1,2,于洋1,2
(1蘇州大學附屬第三醫(yī)院,江蘇常州 213003;2常州市第一人民醫(yī)院)
目的觀察去甲腎上腺素(NE)對人肝癌細胞HepG2和人正常肝細胞L-02增殖、凋亡的影響。方法體外培養(yǎng)HepG2細胞和L-02細胞,分別加入不同濃度NE處理,繼續(xù)培養(yǎng),采用MTT法觀察細胞增殖情況,HE染色和Annexin V-FITC/PI染色法觀察細胞形態(tài)學變化,流式細胞術觀察細胞凋亡情況。結果經0.1、1、10、50 μmol/L NE處理24、48 h,HepG2細胞OD值顯著下降(P均<0.05),L-02細胞OD值無明顯變化。10 μmol/L NE作用于HepG2細胞可見典型的凋亡形態(tài)學改變,胞質收縮、深染,核染色質濃縮;L-02細胞在NE作用前后形態(tài)學均無明顯改變。HepG2細胞加入10 μmol/L NE后部分細胞呈綠色(為早期凋亡表現(xiàn)),加入50 μmol/L NE后部分細胞膜呈綠色,細胞核呈紅色(為晚期凋亡表現(xiàn));L-02細胞均未顯示有熒光。0.1、1、10 μmol/L NE作用于HepG2細胞24 h后,其凋亡率均顯著高于對照組(0 μmol/L NE),且呈劑量依賴關系(P均<0.05);而上述濃度NE作用于L-02細胞24 h后,其凋亡率較對照組先增高后降低(P均<0.05)。結論NE可以抑制HepG2細胞增殖并誘導其凋亡,而對L-02細胞增殖和凋亡沒有影響,提示其在特定類型肝癌臨床治療中具有潛在價值。
去甲腎上腺素;人肝癌細胞HepG2;人正常肝細胞L-02;細胞增殖;細胞凋亡
在我國原發(fā)性肝癌的發(fā)病率、病死率分別占惡性腫瘤的第3位和第2位,由于其發(fā)展快、轉移早、預后差、生存期短,故化療仍然是中晚期肝癌治療的主要手段[1,2]。誘導腫瘤細胞凋亡是多年來醫(yī)學界一直關注的課題之一,尋找高效低毒的誘導腫瘤細胞凋亡的藥物是重中之重。去甲腎上腺素(NE)是交感神經的神經遞質,在機體內主要調節(jié)心血管和呼吸等內臟活動,也參與體溫調節(jié)、免疫調節(jié)和應激反應等生理過程。近年來研究表明,NE與肝星狀細胞及腫瘤細胞的增殖、凋亡有著密切聯(lián)系。本研究觀察了NE對人肝癌細胞HepG2和人正常肝細胞L-02增殖、凋亡的影響,旨在為NE在肝癌治療中的應用提供參考。
1 材料與方法
1.1 細胞、試劑與儀器 HepG2細胞和L-02細胞均購自中科院上海細胞庫。RPMI1640培養(yǎng)基和胎牛血清(美國Gibco公司),NE、MTT和二甲基亞砜(美國Sigma公司),ANNEXIN V-FITC APOPTOSIS試劑盒(美國Biouniquer公司)。EPICS XL流式細胞儀(美國Beckman-Coulter公司),酶聯(lián)免疫檢測儀(美國Bio-Rad公司),倒置相差顯微鏡(日本Olympus公司)。
1.2 HepG2細胞和L-02細胞培養(yǎng) HepG2細胞和L-02細胞均在標準條件下(5%CO2、37 ℃)用內含10%胎牛血清、青霉素(100 U/mL)及鏈霉素(100 μg/mL)的RPMI1640培養(yǎng)基培養(yǎng),每3天傳代1次。
1.3 NE對HepG2細胞和L-02細胞增殖的影響觀察 采用MTT法。HepG2細胞和L-02細胞(分別計為HepG2細胞組和L-02細胞組)分別接種于96孔培養(yǎng)板,每孔5×103個細胞,每孔體積100 μL,培養(yǎng)24 h后,吸棄上清,各加入含有不同濃度(0、0.1、1、10、50 μmol/L)NE的培養(yǎng)基200 μL,繼續(xù)培養(yǎng)24、48 h。每孔加入MTT溶液(5 mg/mL)20 μL,37 ℃繼續(xù)孵育4 h,小心吸棄上清,每孔加入150 μL的二甲基亞砜,振蕩10 min,在酶聯(lián)免疫檢測儀波長490 nm下檢測每孔的OD值,以僅加細胞培養(yǎng)液孔作為空白孔調零,取各組OD值的均數(shù)表示細胞的增殖情況。
1.4 NE對HepG2細胞和L-02細胞形態(tài)學的影響觀察 分別采用HE染色和Annexin V-FITC/PI染色法觀察細胞形態(tài)學變化。①HE染色法:HepG2細胞和L-02細胞(分別計為HepG2細胞組和L-02細胞組)接種于6孔培養(yǎng)板中(孔中提前放入經預處理蓋玻片),細胞融合生長到50%~70%。在開始實驗前,用磷酸鹽緩沖液(PBS)洗2次細胞(2 mL/孔),再用無血清的RPMI1640洗1次(2 mL/孔),然后加入含有0、10 μmol/L NE的培養(yǎng)基3 mL/孔,于37 ℃繼續(xù)培養(yǎng)24 h。將鋪有細胞的蓋玻片浸入95%酒精固定15 min,進行常規(guī)細胞HE染色,觀察胞質和細胞核的形態(tài)。②ANNEXIN V-FITC/PI染色法:HepG2和L-02細胞(分別計為HepG2細胞組和L-02細胞組)接種于6孔培養(yǎng)板中(每孔接種細胞數(shù)為1×105個,培養(yǎng)液為3 mL),培養(yǎng)24 h后,用PBS洗細胞2次(2 mL/孔),再用無血清的RPMI1640洗1次(2 mL/孔),然后加入含有不同濃度(0、10、50 μmol/L)NE的培養(yǎng)基3 mL/孔,于37 ℃繼續(xù)培養(yǎng)24 h。用PBS洗滌細胞1次,在500 μL Annexin V Binding Buffer中加入5 μL Annexin V-FITC和5 μL Propidium Iodide,混勻加入培養(yǎng)板中,避光、室溫反應10 min,于熒光顯微鏡下觀察。早期凋亡細胞Annexin V-FITC陽性呈綠色,晚期凋亡細胞Annexin V-FITC和Propidium Iodide均陽性,細胞膜呈綠色,細胞核呈紅色。
1.5 NE對HepG2細胞和L-02細胞凋亡的影響觀察 采用ANNEXIN V-FITC/PI染色法。HepG2細胞和L-02細胞(分別計為HepG2細胞組和L-02細胞組)接種于6孔培養(yǎng)板中(每孔接種細胞數(shù)為1×105個,培養(yǎng)液為3 mL),培養(yǎng)24 h后,用PBS洗細胞2次(2 mL/孔),再用無血清的RPMI1640洗1次(2 mL/孔),然后加入含有不同濃度(0、0.1、1、10 μmol/L)NE的培養(yǎng)基3 mL/孔,于37 ℃繼續(xù)培養(yǎng)24 h。0.25%胰酶消化細胞,用PBS洗滌細胞2次(離心2 000 r/min,5 min),收集細胞,加入500 μL Annexin V Binding Buffer懸浮細胞,后加入5 μL Annexin V-FITC混勻,加入5 μL Propidium Iodide,混勻,避光、室溫反應10 min,流式細胞儀檢測凋亡率。以FITC和PI熒光信號作雙參數(shù)散點圖,將細胞分為4個區(qū),分別為活細胞(Annexin V-FITC-/PI-)、早期凋亡細胞(Annexin V-FITC+/PI-)、機械損傷細胞(Annexin V-FITC-/PI+)和凋亡晚期或壞死細胞(Annexin V-FITC+/PI+)。凋亡細胞率=早期凋亡細胞數(shù)/總細胞數(shù)×100%。
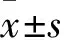
2 結果
2.1 兩組細胞增殖情況比較 結果見表1。由表1可知,經過NE處理24、48 h,HepG2細胞組OD值顯著下降,且呈濃度依賴性(P均<0.05);而L-02細胞組OD值無明顯變化(P均>0.05)。
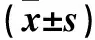
表1 NE處理24、48 h時兩組細胞OD值比較
2.2 兩組細胞形態(tài)學變化 ①HepG2細胞組加入0 μmol/L NE后細胞呈多角形致密單層貼壁生長,增殖旺盛;加入10 μmol/L NE后細胞可見典型的凋亡形態(tài)學改變,胞質收縮、深染,核染色質濃縮,聚集于核膜下呈境界分明的顆粒塊狀小體,細胞形態(tài)完整。L-02細胞組在NE作用前后形態(tài)學均無明顯改變。②HepG2細胞組加入0 μmol/L NE后細胞大部分無熒光;加入10 μmol/L NE后部分細胞呈綠色(為早期凋亡表現(xiàn));加入50 μmol/L NE后部分細胞膜呈綠色,細胞核呈紅色(為晚期凋亡表現(xiàn))。L-02細胞組在各濃度NE作用前后形態(tài)學均無明顯改變,細胞均未顯示有熒光。
2.3 兩組細胞凋亡情況比較 0.1、1、10 μmol/L NE作用于HepG2細胞組24 h后,其凋亡率分別為3.5%±0.4%、12.4%±3.2%、21.7%±6.2%,均高于0 μmol/L NE處理的凋亡率(0.9%±0.2%),且呈劑量依賴性(P均<0.05)。0.1、1、10 μmol/L NE作用于L-02細胞組24 h后,其凋亡率分別為26.7%±1.6%、25.1%±1.1%、17.4%±1.1%,較0 μmol/L NE處理的凋亡率(21.2%±1.6%)先增高后降低(P均<0.05)。
3 討論
原發(fā)性肝癌是指自肝細胞或肝內膽管細胞發(fā)生的癌癥,是常見的惡性腫瘤之一,病死率在消化系統(tǒng)惡性腫瘤中列第3位,僅次于胃癌和食管癌[3,4]。肝癌起病隱匿,早期缺乏典型癥狀,表現(xiàn)出明顯癥狀的就診者中約1/3已屬晚期,亟需為其早期診斷篩查尋找新型有效的靶點[5~7]。研究[8~10]發(fā)現(xiàn),肝癌的發(fā)病機理與細胞生長的異常調節(jié)相關,比如凋亡途徑缺陷,Bcl-2、Survivin等抗凋亡蛋白上調,Caspase-3凋亡前體蛋白下調等。目前,絕大多數(shù)研究聚焦于藥物對于肝癌細胞增殖及凋亡的作用,而對于其在正常肝細胞中所起的作用研究甚少。
NE是交感神經的神經遞質,主要由去甲腎上腺素能神經末梢釋放,也可由腎上腺髓質少量分泌。NE在機體內主要調節(jié)心血管和呼吸等內臟活動,也參與體溫調節(jié)、免疫調節(jié)和應激反應等生理過程。細胞凋亡亦稱程序性細胞死亡,是由細胞內外環(huán)境變化或死亡信號激發(fā),并在基因調控下所引起的細胞主動死亡過程,也可通過藥物或輻射等外因誘導。細胞凋亡是多種基因參與的過程,同時也是機體自身免疫調節(jié)的過程[11]。目前,國內外研究較多集中在NE誘導正常細胞的凋亡上,諸多體內外實驗都證實了NE能誘導心肌細胞、肺泡上皮細胞凋亡[12~14],并呈明顯的時間和劑量依賴的關系,部分實驗并對其機制進行了初步研究[15,16]。根據(jù)NE對心肌細胞和肺泡上皮細胞的作用機制,國外學者已經成功將NE應用于心衰和肺水腫等疾病的治療,并取得較令人滿意的結果。Mamani-Matsuda等[17]嘗試用長效腎上腺素類藥物福莫特羅和沙美特羅治療B細胞性慢性粒細胞白血病(B-CLL),結果證實不同濃度的福莫特羅和沙美特羅均可有效減少B-CLL細胞數(shù)量,并呈濃度依賴性,而對正常的人B細胞沒有類似的作用。
本研究MTT結果顯示,經0.1、1、10、50 μmol/L NE處理24、48 h,HepG2細胞OD值顯著下降,L-02細胞OD值無明顯變化。HE染色顯示,10 μmol/L NE作用于HepG2細胞可見典型的凋亡形態(tài)學改變,胞質收縮、深染,核染色質濃縮;L-02細胞在各濃度NE作用前后形態(tài)學均無明顯改變。Annexin V-FITC/PI染色形態(tài)學觀察發(fā)現(xiàn)HepG2細胞加入10 μmol/L NE作用后部分細胞呈綠色(為早期凋亡表現(xiàn)),加入50 μmol/L NE后部分細胞膜呈綠色,細胞核呈紅色(為晚期凋亡表現(xiàn));L-02細胞均未顯示有熒光。流式細胞術顯示,0.1、1、10 μmol/L NE作用于HepG2細胞24 h后,其凋亡率均顯著高于對照組(0 μmol/L NE),且呈劑量依賴關系;而上述濃度NE作用于L-02細胞24 h后,其凋亡率較對照組(0 μmol/L NE)先增高后降低。由此可見,NE可抑制HepG2細胞增殖,并誘導其發(fā)生明顯凋亡;而L-02細胞在低濃度NE的作用下無明顯改變,在較高濃度NE的作用下反而凋亡下降。即NE在體外既能誘導肝癌細胞凋亡又能提高人正常肝細胞的活力,但具體機制不明,有待進一步實驗探索。此結果與楊大鵬等[18]近期研究得出NE促進肝癌細胞增殖結果不同,但其使用的肝癌細胞株為Huh7和PLC,與本研究組不同。據(jù)美國模式菌種收集中心和中國科學院細胞庫記載3株細胞的建株來源和特性均不同,其中HepG2細胞來源于15歲的白人男性肝癌患者,不攜帶乙肝病毒基因組;PLC細胞來源于人肝癌亞力山大細胞,分泌乙肝病毒表面抗原;Huh7來源于人男性肝癌細胞,分泌甲胎蛋白,胰酶α抗體等。這可為國際上提出的NE對于腫瘤作用的爭論提供依據(jù)。2009年,F(xiàn)itzgerald[19]提出假設NE是某些腫瘤的致病因素,通過降低NE水平或阻斷其受體可預防腫瘤的發(fā)生;而2011年,F(xiàn)riedman等[20]通過流行病學調查研究得到的數(shù)據(jù)并不支持藥物性阻斷NE信號途徑可以預防多種腫瘤的假設,由此推斷NE對于腫瘤細胞的作用可能與其濃度及腫瘤的來源類型有關,NE在體外既能誘導肝癌細胞HepG2凋亡又不影響人正常肝細胞L-02的增殖凋亡,選擇合適的劑量并應用于正確類型的肝癌是NE應用于肝癌治療的關鍵。
總之,NE可以抑制HepG2細胞增殖并誘導其凋亡,而對L-02細胞增殖和凋亡沒有影響,拓展了NE在臨床原發(fā)性肝癌治療中的應用價值。我們將進一步探索NE與抗肝癌藥物的協(xié)同抗腫瘤作用以及其抗腫瘤作用的深層機制,為原發(fā)性肝癌治療提供新的實驗依據(jù)和研究思路。
[1] Tran DDH, Koch A, Allister A, et al. Treatment with Mapkap2 (Mk2) inhibitor and DNA methylation inhibitor, 5-Aza Dc, synergistically triggers apoptosis in hepatocellular carcinoma (HCC) Via Tristetraprolin (TTP)[J]. Cell Signal, 2016,28(12):1872-1880
[2] 相迪,戴建國.原發(fā)性肝癌的綜合治療研究進展[J].山東醫(yī)藥,2017,57(20):111-113.
[3] Bruix J, Sherman M, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma: an update[J]. Hepatology, 2011,53(3):1020-1022.
[4] Marquardt JU, Galle PR, Teufel A. Molecular diagnosis and therapy of hepatocellular carcinoma(HCC): an emerging field for advanced technologies[J]. J Hepatol, 2012,56(1):267-275.
[5] Nakao K, Miyaaki H, Ichikawa T. Antitumor function of microrna-122 against hepatocellular carcinoma [J]. J Gastroenterol, 2014,49(4):589-593.
[6] Rautou PE, Mansouri A, Lebrec D, et al. Autophagy in liver diseases[J]. J Hepatol, 2010,53(6):1123-1134.
[7] Wang C, Guo K, Gao D, et al. Identification of transaldolase as a novel serum biomarker for hepatocellular carcinoma metastasis using xenografted mouse model and clinic samples [J]. Cancer Lett, 2011,313(2):154-166.
[8] Eichenmuller M, von Schweinitz D, Kappler R. Betulinic acid treatment promotes apoptosis in hepatoblastoma cells[J]. Int J Oncol, 2009,35(4):873-879.
[9] Mu R, Lu N, Wang J, et al. An oxidative analogue of gambogic acid-induced apoptosis of human hepatocellular carcinoma cell line hepg2 is involved in its anticancer activity in vitro[J]. Eur J Cancer Prev, 2010,19(1):61-67.
[10] Peroukides S, Bravou V, Alexopoulos A, et al. Survivin overexpression in HCC and liver cirrhosis differentially correlates with P-Stat3 and E-Cadherin [J]. Histol Histopathol, 2010,25(3):299-307.
[11] 寧厚法.肝癌細胞凋亡調控基因的研究進展[J].國際醫(yī)學放射學雜志,2003,26(4):235-238。
[12] Communal C, Singh K, Pimentel DR, et al. Norepinephrine stimulates apoptosis in adult rat ventricular myocytes by activation of the beta-adrenergic pathway[J]. Circulation, 1998,98(13):1329-1334.
[13] Dincer HE, Gangopadhyay N, Wang R, et al. Norepinephrine induces alveolar epithelial apoptosis mediated by alpha-, beta-, and angiotensin receptor activation [J]. Am J Physiol Lung Cell Mol Physiol, 2001,281(3):624-630.
[14] Fu YC, Chi CS, Yin SC, et al. Norepinephrine induces apoptosis in neonatal rat endothelial cells via down-regulation of Bcl-2 and activation of beta-adrenergic and Caspase-2 pathways[J]. Cardiovasc Res, 2004,61(1):143-151.
[15] Fu YC, Yin SC, Chi CS, et al. Norepinephrine induces apoptosis in neonatal rat endothelial cells via a ros-dependent jnk activation pathway[J]. Apoptosis, 2006,11(11):2053-2063.
[16] Iwai-Kanai E, Hasegawa K. Intracellular signaling pathways for norepinephrine- and endothelin-1-mediated regulation of myocardial cell apoptosis[J]. Mol Cell Biochem, 2004,259(1-2):163-168.
[17] Mamani-Matsuda M, Moynet D, Molimard M, et al. Long-Acting beta2-adrenergic formoterol and salmeterol induce the apoptosis of b-chronic lymphocytic leukaemia cells[J]. Br J Haematol, 2004,124(2):141-150.
[18] 楊大鵬,宦洪波,張亮,等.去甲腎上腺素通過pi3k/Akt信號通路上調sox4表達促進肝癌細胞增殖[J].第三軍醫(yī)大學學報,2017,39(9):821-826.
[19] Fitzgerald PJ. Is norepinephrine an etiological factor in some types of cancer[J]. Int J Cancer, 2009,124(2):257-263.
[20] Friedman GD, Udaltsova N, Habel LA. Norepinephrine antagonists and cancer risk [J]. Int J Cancer, 2011,128(3):737-738.
EffectsofnorepinephrineonproliferationandapoptosisofhumanHepG2andL-02cellsinvitro
SHIYuanping1,LUOGuanghua,ZHENGLu,WEIJiang,YUYang
(1TheThirdAffiliatedHospitalofSoochowUniversity,Changzhou213003,China)
ObjectiveTo observe the effects of norepinephrine (NE) on the proliferation and apoptosis of human hepatocellular carcinoma cell line HepG2 and human normal liver cell line L-02.MethodsHepG2 and L-02 cells were cultured in vitro and were treated with different concentrations of NE. Cell proliferation and apoptosis were examined by MTT assay and flow cytometry, respectively. Cell morphology was observed by HE staining and Annexin V-FITC/PI staining.ResultsAfter treatment with 0.1, 1, 10, and 50 μmol/L NE for 24 and 48 h, the OD value of HepG2 cells decreased significantly (allP<0.05), while the OD value of L-02 cells had no significant change. HepG2 cells treated with 10 μmol/L NE showed obvious apoptotic morphology: there was contracted and stained cytoplasm, as well as condensed chromatin. L-02 cells had no significant changes in morphology before and after NE treatment. After adding 10 μmol/L NE to HepG2 cells, the cells showed a green color (early apoptosis). After addition of 50 μmol/L NE, some of the cells showed a green membrane and a red nucleus (which is a sign of late apoptosis). No fluorescence was observed in the L-02 cells. The apoptotic rates of HepG2 cells treated with 0.1, 1, and 10 μmol/L NE for 24 h were significantly higher than those of the control group (0 μmol/L NE) with a dose-dependent manner (allP<0.05). However, the apoptosis rate of L-02 cells treated with the above concentrations of NE for 24 h increased first and then decreased (allP<0.05).ConclusionNE inhibits the proliferation and induces apoptosis of HepG2 cells, but has no effect on the proliferation and apoptosis of L-02 cells, suggesting that it may have potential value in the clinical treatment of specific types of hepatic carcinoma.
norepinephrine; human hepatocellular carcinoma cell line HepG2; human normal liver cell line L-02; cell proliferation; apoptosis
10.3969/j.issn.1002-266X.2017.47.002
R735.7
A
1002-266X(2017)47-0005-04
江蘇省常州市國際科技合作項目(CZ20160013);常州市衛(wèi)生局指導性科技項目(WZ200901);江蘇省青年醫(yī)學人才(QNRC2016282)。
施媛萍(1982-),女,碩士,副研究員,主要研究方向為醫(yī)學基礎研究。E-mail: luhao64@163.com
羅光華(1972-),男,博士,研究員,主要研究方向為醫(yī)學基礎研究。E-mail: shineroar@163.com
2017-09-10)

