腎臟血管母細胞瘤1例并文獻復習
賈 夢,姚 敏,孫平麗,許傳杰,高洪文
(吉林大學第二醫院 病理科,吉林 長春130041)
腎臟血管母細胞瘤1例并文獻復習
賈 夢,姚 敏,孫平麗,許傳杰,高洪文*
(吉林大學第二醫院 病理科,吉林 長春130041)
1 臨床資料
患者,男性,60歲,體檢行CT檢查發現左腎腫瘤,于2017年2月入我院泌尿外科診治。患者無明顯臨床癥狀。入院后,實驗室檢查腎功能:血尿素氮7.57 mmol/L(正常值1.79 mmol/L-7.14 mmol/L)、血肌酐117.0 μmol/L(正常值44.0 μmol/L-106.0 μmol/L)、血尿酸580 μmol/L(正常值90 μmol/L-410 μmol/L)均有不同程度升高;血常規:白細胞總數、淋巴細胞計數和血小板壓積有升高,紅細胞計數無增多;尿常規:尿比重1.010(正常值1.015-1.025)下降,尿紅細胞計數正常。既往患者有高血壓及心衰病史。B超檢查示“左腎下極探及5.0 cm×4.1 cm略低回聲光團,內部回聲不均”,外院CT檢查示“左腎下極占位,考慮腎癌,腎動脈粥樣硬化”。臨床診斷為腎癌,患者行左側腎臟根治手術。
病理標本大體檢查:切除左側腎臟,體積11 cm×8 cm×5cm,于腎下極見一圓形腫物(圖略),直徑約3.5 cm,境界清楚,無包膜;腫物切面實性,灰紅灰黃色,局部有出血,未見壞死及囊性變。腫物累及腎被膜,但未侵犯腎盂及腎周脂肪組織。
組織學檢查:腫瘤與周圍腎實質分界清,局部腫瘤成分緊鄰周圍腎小管。腫瘤由富于細胞區和寡細胞區構成(圖 1-A)。在富于細胞區,腫瘤細胞呈片狀、巢狀或小梁狀排列,其間穿插豐富的薄壁毛細血管網(圖 1-B)。腫瘤細胞呈多角形或卵圓形。胞漿淡染或嗜酸,胞質內可見透明空泡(圖1-B)。細胞核有輕到中度多形性,偶見核仁及核內假包涵體,未見核分裂象。在寡細胞區可見有玻璃樣變纖維化的間質,局灶有粘液變及鈣化,其間散在分布粗大的厚壁血管,腫瘤細胞稀少。另外,在富于細胞區和寡細胞區局灶均可見有含鐵血黃素顆粒。腫物周圍腎實質腎小管有萎縮,腎小球纖維化,同時見有慢性炎細胞浸潤。
免疫組化染色結果:腫瘤細胞彌漫表達α-inhibin(圖2-A)、Vimentin、S-100(圖2-B)和NSE(圖2-C),局灶表達PAX-8、EMA和CD10,不表達HMB45。極少數腫瘤細胞中CK(AE1/AE3)呈現弱陽性。毛細血管網CD31(圖2-D)、CD34和ERG陽性。Ki67增殖指數為3%-4%。
病理診斷:腎臟血管母細胞瘤。
術后患者恢復良好,隨訪6個月無復發和轉移。
2 討論
血管母細胞瘤是主要發生于中樞神經系統的腫瘤。中樞神經系統的血管母細胞瘤多為散發性病變,而約25%的病變與von Hippel-Lindau (VHL)病相關[1]。除中樞神經系統外,血管母細胞瘤也可發生于身體其他部位,例如肝臟[2]、肺[3]、胰腺[4]、后腹膜[5]、軟組織[6]、皮膚[7]等,這些中樞神經系統外的血管母細胞瘤與VHL病相關的可能性更大[8]。

圖1腎臟血管母細胞瘤形態特征(A-B,HE染色)A:腫瘤由富于細胞區和寡細胞區構成(40×);B:腫瘤細胞(箭頭所示)位于豐富的薄壁毛細血管網之間,胞漿透明、空泡狀(200×)
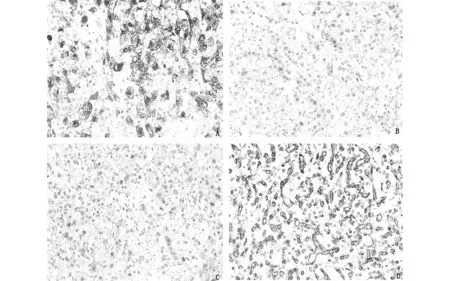
圖2腎臟血管母細胞瘤免疫組化染色(A-D,200×)A:腫瘤細胞顯示α-inhibin胞漿陽性;B:腫瘤細胞顯示S-100胞漿及胞核陽性;C:腫瘤細胞顯示NSE胞漿陽性;D:CD31顯示豐富的毛細血管網
腎臟血管母細胞瘤罕見,目前國內外有報道20余篇,大部分病例與VHL病無關。查閱文獻,在英文文獻中共有11篇文獻詳細描述了16例腎臟血管母細胞瘤[9-19]。這些病例中,患者年齡從16歲到71歲不等(中位年齡53歲,平均年齡46.7歲)。右腎發生率高于左腎(右腎11例,左腎5例)。男性患者多于女性(男性患者10例,女性患者6例)。多數病例無明顯癥狀,但也有少數病例報道患者出現肉眼血尿(2例)[10, 12]和背部下方疼痛(3例)[10, 12, 17],1例患者血紅細胞計數有增多[10]。所有被報道病例經手術治療后隨訪3個月到9年不等,均無復發和轉移。
大體上,腫瘤直徑從1.2 cm到6.8 cm不等。腫瘤與周圍組織分界清楚,切面灰紅或灰黃色,部分病例可見有出血和囊性變區域。另外,多中心病例也有(1例)報道[8]。鏡下,該腫瘤均由富于細胞區和寡細胞區構成。富于細胞區腫瘤細胞呈片狀或巢狀排列,其間穿插豐富的薄壁毛細血管網,而在寡細胞區,腫瘤細胞稀少,間質顯著玻璃樣變纖維化。在既往被報道過的病例中,3例富于細胞區可見有大小不一的嗜酸性透明小球[10, 17, 18],1例有砂礫體[17]。更少見的情況是,腫瘤細胞呈現橫紋肌樣改變,具體表現為細胞增大、胞質顯著嗜酸以及細胞核偏位[14]。可出現壞死和核分裂象。免疫組化染色結果:大部分病例腫瘤細胞表達α-inhibin、S-100、Vimentin和NSE。少部分病例中,腫瘤細胞EMA(4例)、CA9(3例)、CD10(3例)、EGFR(3例)、PAX-8(2例)和PAX-2(2例)呈陽性或局灶陽性。其他抗體包括AE1/AE3[17]、GLUT1[10]和HIF-1α[15]僅在單個個案中被報道呈陽性或局灶陽性。本例形態學特征及免疫組化染色結果均與文獻報道一致,診斷為腎臟血管母細胞瘤明確。
腎臟血管母細胞瘤易與其他腫瘤混淆,如:腎透明細胞癌、腎上腺皮質癌、嗜鉻細胞瘤等,其中最易混淆的是腎透明細胞癌。由于血管母細胞瘤腫瘤細胞胞漿淡染或嗜酸,胞質內可見有透明空泡,且具有豐富的毛細血管網,與透明細胞癌腫瘤細胞十分相似,因而有時在形態學上很難區分。免疫組織化學染色對區分這兩種腫瘤有幫助。腎血管母細胞瘤腫瘤細胞α-inhibin、S-100、Vimentin和NSE陽性,而上皮標志物CK(AE1/AE3)和EMA常為陰性或僅局灶陽性,而腎透明細胞癌CK(AE1/AE3)和EMA通常為陽性。
腎臟血管母細胞瘤在2016版WHO腫瘤分類中為生物學行為不確定的腫瘤[20]。從文獻報道來看,該腫瘤預后普遍較好,至今無復發和轉移的報道。然而,由于病例數量有限,對于該腫瘤的生物學行為還需進一步隨訪觀察。
腎臟血管母細胞瘤的組織來源至今不明。目前普遍認為腫瘤細胞來源于間充質器官特異性多能細胞,理由是腎血管母細胞瘤腫瘤細胞表達某些器官特異性抗原,如CD10、PAX-2和PAX-8,這些抗原在中樞神經系統血管母細胞瘤腫瘤細胞中均不表達[9, 14, 15, 17]。對于腫瘤內豐富的毛細血管網,一些學者認為其來源于反應性過程而非腫瘤本身,理由是中樞神經系統內的血管內皮細胞通常表達GLUT1而外周組織血管內皮細胞不表達,同時,中樞神經系統血管母細胞瘤的毛細血管網呈現GLUT1陽性而腎血管母細胞瘤血管內皮GLUT1陰性[10]。對于該腫瘤的發病機制目前尚無結論。不同于中樞神經系統血管母細胞瘤,腎臟血管母細胞瘤似乎與VHL基因改變無關[10,13,15,18,19]。另外,雖然曾有報道腎血管母細胞瘤腫瘤細胞EGFR免疫組化染色陽性,但卻并未檢測到EGFR基因突變[18]。關于這一腫瘤的發病機制,還有待進一步研究。
腫物周圍腎實質腎小管萎縮、腎小球纖維化,同時見有慢性炎細胞浸潤,這些特征在既往文獻中未曾報道。我們尚不清楚周圍腎實質的這種變化與腫瘤本身是否有關系。雖然腎實質的改變可以來自于腫瘤生長對周圍腎臟的擠壓,但是我們不能排除其他更深在的原因。例如,慢性炎癥的刺激可能會活化間充質器官特異性多能細胞,從而導致腫瘤的發生。對于這種變化與腫瘤的關系,未來還需繼續探索。
綜上所述,腎臟血管母細胞瘤是一種罕見的腫瘤,該腫瘤有著獨特的臨床病理學特征,目前發現經手術切除后一般預后較好。在日常診治工作中,醫師應加強對該腫瘤的認識,避免將其誤診為惡性腫瘤從而導致不必要的治療。
[1]Boughey AM, Fletcher NA, Harding AE. Central nervous system haemangioblastoma: a clinical and genetic study of 52 cases[J].J Neurol Neurosurg Psychiatry,1990,53(8):644.
[2]Rojiani AM, Owen DA, Berry K, et al. Hepatic hemangioblastoma. An unusual presentation in a patient with von Hippel-Lindau disease[J]. Am J Surg Pathol,1991,15(1):81.
[3]McGrath FP,Gibney RG,Morris DC,et al.Case report:multiple hepatic and pulmonary haemangioblastomas-a new manifestation of von Hippel-Lindau disease[J].Clin Radiol,1992,45(1):37.
[4]Bird AV, Mendelow H. Lindau's disease in a South African family:a report on three further cases[J]. Br J Surg,1959,47:173.
[5]Fanburg-Smith JC, Gyure KA, Michal M, et al. Retroperitoneal peripheral hemangioblastoma: a case report and review of the literature[J]. Ann Diagn Pathol,2000,4(2):81.
[6]Patton KT, Satcher RL, Jr.Laskin WB. Capillary hemangioblastoma of soft tissue: report of a case and review of the literature[J]. Hum Pathol,2005,36(10):1135.
[7]Boyd AS, Zhang J. Hemangioblastoma arising in the skin[J]. Am J Dermatopathol,2001,23(5):482.
[8]Doyle LA, Fletcher CD. Peripheral hemangioblastoma: clinicopathologic characterization in a series of 22 cases[J]. Am J Surg Pathol. 2014,38(1):119.
[9]Nonaka D, Rodriguez J, Rosai J. Extraneural hemangioblastoma: a report of 5 cases[J]. Am J Surg Pathol,2007,31(10):1545.
[10]Ip YT, Yuan JQ,Cheung H,et al.Sporadic hemangioblastoma of the kidney: an underrecognized pseudomalignant tumor[J]. Am J Surg Pathol,2010,34(11):1695.
[11]Verine J, Sandid W, Miquel C, et al. Sporadic hemangioblastoma of the kidney: an underrecognized pseudomalignant tumor[J].Am J Surg Pathol,2011,35(4):623.
[12]Liu Y, Qiu XS, Wang EH. Sporadic hemangioblastoma of the kidney: a rare renal tumor[J]. Diagn Pathol,2012,7:49.
[13]Wang CC, Wang SM, Liau JY. Sporadic Hemangioblastoma of the Kidney in a 29-Year-Old Man[J]. Int J Surg Pathol,2012,20(5):519.
[14]Yin WH, Li J, Chan JK. Sporadic haemangioblastoma of the kidney with rhabdoid features and focal CD10 expression: report of a case and literature review[J]. Diagn Pathol,2012,7:39.
[15]Jiang JG, Rao Q, Xia QY, et al. Sporadic hemangioblastoma of the kidney with PAX2 and focal CD10 expression: report of a case[J]. Int J Clin Exp Pathol,2013,6(9):1953.
[16]Wang Y, Wei C, Mou L, et al. Sporadic renal haemangioblastoma: Case report and review of the literature[J]. Oncol Lett,2013,5(1):360.
[17]Zhao M, Williamson SR, Yu J, et al. PAX8 expression in sporadic hemangioblastoma of the kidney supports a primary renal cell lineage: implications for differential diagnosis[J]. Hum Pathol,2013,44(10):2247.
[18]Kuroda N, Agatsuma Y, Tamura M, et al. Sporadic renal hemangioblastoma with CA9, PAX2 and PAX8 expression: diagnostic pitfall in the differential diagnosis from clear cell renal cell carcinoma[J]. Int J Clin Exp Pathol,2015,8(2):2131.
[19]Wu Y, Wang T, Zhang P-P, et al. Extraneural hemangioblastoma of the kidney: the challenge for clinicopathological diagnosis[J]. J Clin Pathol,2015,68(12):1020.
[20]Moch H, Humphrey PA, Ulbright TM, et al. WHO Classification of Tumours of the Urinary System and Male Genital Organs[M]. Lyon: IARC Press,2016:67.
*通訊作者
1007-4287(2017)12-2197-03
2017-04-23)

