蛋白質氧化對烏鱧在凍藏過程中保水性的影響
,,,,
(石河子大學食品學院,新疆石河子 832000)
蛋白質氧化對烏鱧在凍藏過程中保水性的影響
秦軍委,王漢玲,于雪慧,朱新榮,張建*
(石河子大學食品學院,新疆石河子 832000)
烏鱧是一種營養和經濟價值都很高的魚類,但在貯藏過程容易出現品質劣變的問題。本實驗通過羥自由基氧化體系對烏鱧進行氧化后置于-4 ℃凍藏,研究了烏鱧肌肉保水性的相關變化。結果顯示:烏鱧經羥自由基氧化后變化明顯,在第10 d,氧化組(A組)的解凍失水率、加壓失水率、蒸煮損失率比未氧化組(B組)分別高出7.51%、14.74%、10.65%;蛋白羰基含量、硫代巴比妥酸值(TBARS)、肌原纖維小片化指數(MFI)升高,肌原纖維裂解,保水性降低。在相關性分析中,氧化樣品的肌原纖維蛋白結構變化中的羰基含量、TBARS、MFI均與解凍失水率、加壓失水率、蒸煮損失率等保水性指標呈極顯著相關(p<0.01),且MFI與pH呈顯著相關性(p<0.05)。結果表明,羥自由基氧化系統能使烏鱧肌肉肌原纖維遭到破壞,蛋白質氧化變性,導致其保水性降低。
烏鱧,羥自由基氧化,凍藏,保水性
烏鱧俗稱黑魚、才魚、烏魚等,屬鱸形總目鱸形目,攀鱸亞目,鱧科,鱧屬,廣泛分布于我國南北水域,是經濟價值較高的名貴淡水魚類,其肉質鮮嫩,骨刺少,營養全面。據報道,每100 g烏鱧肉中含蛋白質19.80 g,脂肪1.49 g,碳水化合物1.20 g,并含有人體所需的鈣、磷、鐵、鋅等營養元素,營養價值高[1-3]。因此,烏鱧被廣大消費者所喜愛。
魚體因肌纖維較短、蛋白質組織松散,水分含量高、內源酶活性強等特點,在死后低溫貯藏過程中容易發生肌肉軟化和蛋白質、脂肪氧化等問題,致使魚肉品質下降[4-5]。研究發現,造成魚肉軟化的原因主要是由內源酶引起的肌原纖維蛋白的降解[6],而肌原纖維蛋白降解對肌肉保持原有水分與添加水分的能力有一定影響。同時,蛋白質氧化是導致肌肉宰后品質下降的另一個重要影響因素,在貯藏過程中氧化不僅降低了肌肉的顏色、風味、多汁性和嫩度等食用品質,還會導致蛋白質功能的喪失,如凝膠性和保水性等[7]。目前,關于魚肉保水性的研究主要在新型保水劑的探索和不同處理方式下保水性的提高等方面,如王金路等[8]分析了草魚內臟蛋白水解液對鱸魚魚肉保水性的影響,試圖尋找新型水產品保水劑;尚校蘭,劉安軍[9]研究了超高壓處理對海鱸魚保水性的影響,從微觀角度闡述了超高壓處理對海鱸魚保水性的機理;李莎莎等[10]研究了堿性鹽對冷凍魚糜保水性的影響,以開發替代復合磷酸鹽的無磷保水劑,而羥自由基氧化對肌肉保水性的影響等方面的報道較少。
本實驗以烏鱧肌肉為研究對象,通過羥自由基氧化系統對肌肉蛋白進行氧化,分析了氧化對烏鱧肌肉蛋白保水性相關指標以及肌原纖維蛋白結構變化的影響,為烏鱧在凍藏過程中通過抑制或適當控制氧化,提高肌肉保水性提供參考依據。
1 材料與方法
1.1 材料與儀器
烏鱧 石河子市中心農貿市場(重約1.2 kg,體長約28 cm);Na2HPO4、NaH2PO4、抗壞血酸 天津市福晨化學試劑廠;乙酸乙酯、三氯乙酸、無水乙醇 成都市科龍化工試劑廠;FeCl3、KCl、CaCl2、2-硫代巴比妥酸 天津市永晟精細化工有限公司;2,4-二硝基苯肼 北京化工廠;鹽酸胍、EGTA 北京博奧托達科技有限公司;所有試劑均為分析純。
XB3200C電子天平 上海公緊密儀器儀表有限公司;PHS-3C pH計 上海儀電科學股份有限公司;Multifuge X1R高速冷凍離心機 賽默飛世爾科技有限公司;紫外可見分光光度計(Cary 50 spectrophotometer) 美國Varian 公司;DK-8D數顯恒溫水浴鍋 金壇市醫療儀器廠;78-1磁力加熱攪拌器 江蘇金怡儀器科技有限公司;應變式無側限壓縮儀 南京土壤儀器有限公司。
1.2 實驗方法
1.2.1 樣品的制備
1.2.1.1 魚肉樣品制備 鮮活烏鱧(10尾)敲暈致死后,去鱗、去內臟、去頭、去尾,去皮,洗凈取背部的脊背肉,切成塊狀(約2 cm×2 cm×1.5 cm),每尾約10塊,處理好的樣品隨機分成4份(每份約25塊),一份進入氧化體系,記為A組,另外3份作為對照,對照分為三組:第一組將魚塊放入培養皿中,不加任何試劑,記為B組;第二組加入與氧化體系等量的蒸餾水,記為C組;第三組加入與氧化體系等量的磷酸鹽緩沖溶液(50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,pH6.0),記為D組,以排除魚肉自身、蒸餾水及磷酸鹽緩沖溶液的影響。所有處理組同時放置5 h,瀝干后裝袋,放入冰箱,采用微凍貯藏,溫度為-4 ℃。
1.2.1.2 肌原纖維蛋白的制備 肌原纖維蛋白的提取參考Chin[11]和Jiang[12]的方法。具體做法為:準確稱量1.5 g魚樣,加入15 mL預冷的磷酸鹽緩沖溶液A(50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,pH7.5),均質1 min,8000 r/min離心15 min,溫控4 ℃,棄上清,沉淀中加入15 mL的磷酸鹽緩沖溶液A,重復以上的操作,所得沉淀中加入30 mL磷酸鹽緩沖溶液B(50 mmol/L Na2HPO4,50 mmol/L NaH2PO4,0.6 mol/L NaCl,pH7.5),均質1 min,5000 r/min離心15 min,溫控4 ℃,重復操作1次,將2次離心后的上清液合并,即為肌原纖維蛋白。
1.2.2 氧化體系的制備 該體系[13]由FeCl3、抗壞血酸(Asc)和H2O2通過鐵的氧化還原反應而產生自由基,由1 mmol/L FeCl3、1 mmol/L Asc、20 mmol/L H2O2、磷酸鹽緩沖溶液(50 mmol/L Na2HPO4與50 mmol/L NaH2PO4混和,pH6.0)組成。在4 ℃下,將魚肉塊(10±1 g)浸泡在氧化體系中5 h,氧化后加入EDTA二鈉溶液(使其最終濃度為1 mmol/L)終止氧化。
1.2.3 理化指標的測定方法
1.2.3.1 pH的測定 采用pH計進行測定,準確稱取5 g肉樣,充分研磨搗碎,加入45 mL蒸餾水并混勻,用pH計進行測定,每個樣品平行5次。
1.2.3.2 解凍失水率的測定 樣品分別在解凍前(Wa)和解凍后(Wb)稱重,按照下面的公式計算:
解凍汁液流失率(%)=(Wa-Wb)/Wa×100
式(1)
1.2.3.3 加壓失水率測定 采用Farouk等[14]人的加壓濾紙法測定,并作適當修改。測定剁碎肉樣在35 kg壓力下保持5 min的水分的損失量,記錄加壓前重量(Wa)和加壓后重量(Wb),加壓條件下的保水性可以用加壓失水率來表示,用下式計算:
加壓失水率(%)=(Wa-Wb)/Wa×100
式(2)
1.2.3.4 蒸煮損失率的測定 一定大小的肉樣在85 ℃水浴鍋中蒸煮20 min,蒸煮前稱重(Wa),蒸煮后冷卻到室溫,用吸水紙吸干水分,再次稱重(Wb)。用以下公式計算:
蒸煮損失率(%)=(Wa-Wb)/Wa×100
式(3)
1.2.3.5 羰基含量的測定 羰基含量的測定參照Oliver等[15]的方法并適當修改,具體做法如下:取1 mL 1 mg/mL的肌原纖維蛋白,每管中加入1 mL 10 mmol/L 2,4-二硝基苯肼,室溫下反應1 h(每10 min旋渦振蕩一次)后添加1 mL 20%三氯乙醇( TCA),8000 r/min離心5 min,溫控為4 ℃,棄上清液,用1 mL乙酸乙酯∶乙醇(1∶1)清洗沉淀3次以除去未反應的試劑,加3 mL 6 mol/L鹽酸胍溶液后置于37 ℃條件下水浴15 min使沉淀溶解,再將反應液8000 r/min離心3 min除去不溶物質,所得上清液在370 nm處測吸光值,使用分子吸光系數22000 L/(mol·cm)計算羰基含量,羰基含量表示為nmol/mg。公式:
A=ε×b×c
式(4)
其中:ε為分子吸光系數L/(mol·cm);b為比色皿的寬度,cm;c為濃度,mol/L。
1.2.3.6 脂質過氧化值(TBARS)的測定 TBARS的測定參照Vyncke[16]的方法,并適當修改。稱取10 g魚肉樣品,加入50 mL 7.5%的TCA,均質后6500 r/min離心10 min,溫控4 ℃。取3 mL上清液加入3 mL 0.02 mol/L 2-硫代巴比妥酸,90 ℃水浴40 min,室溫冷卻,分別在532 nm和600 nm處進行比色測定,用公式計算TBARS值,結果以每kg魚肉中丙二醛的毫克數表示(mg MDA/kg)。
TBARS值(或TBA值)=(A532-A600)/155×(1/10)×72.6×1000
式(5)
1.2.3.7 肌原纖維小片化指數(MFI) MFI的測定參考Culler等[17]的方法并稍作調整。將樣品充分剪切,除去任何可視脂肪和結締組織,2 g剪切好的背肌肉,在10倍體積的分離介質中(100 mmol/L KCl,20 mmol/L K3PO4,0.1 mmol/L EDTA,1 mmol/L CaCl2,用HCl調pH=7.0)用磁力攪拌器攪拌30 min。勻漿在1000 r/min離心15 min,溫控為4 ℃,棄上清,沉淀又在10倍體積分離介質中均質后,1000 r/min離心15 min。沉淀在2.5倍體積的分離介質中制成懸液,通過2層濾布以除去結締組織和碎片,再加2.5倍體積分離介質使肌原纖維通過篩孔。合并濾液所得的懸浮液在540 nm測吸光值,將所得結果乘以200,得到MFI值。
1.3 數據統計分析方法
使用Origin 8.5軟件進行數據處理,并用SAS 9.0統計軟件進行差異顯著性分析(p<0.05)。
2 結果與分析
2.1 蛋白質氧化對魚肉pH變化的影響
從圖1中可以看出,隨著貯藏時間的延長,氧化與未氧化樣品的pH均呈現先下降后上升的趨勢。pH下降可能是魚體僵直期磷酸和乳酸的產生造成的,并在第2 d后達到僵硬高峰,隨后開始進入解僵期,可能產生堿性物質,pH開始上升[18]。
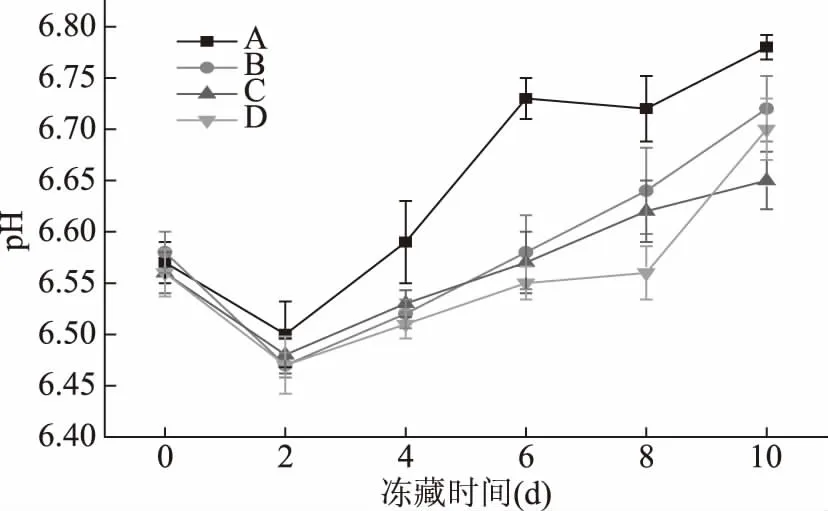
圖1 烏鱧在不同處理方式凍藏過程中pH的變化Fig.1 The change of pH of the samples with different processing
氧化樣品A組在前2 d與對照組B組、C組、D組變化并不明顯,從第2 d之后,A組的pH的增長趨勢比未氧化的B組、C組、D組高,存在顯著性差異(p<0.05)。第4 d到第6 d,氧化后的pH從6.59升到6.73,增加了0.14;而未氧化B組只從6.52升到6.58,增加了0.06,C組和D組樣品pH增長均沒有A組快。這說明蛋白質氧化對pH在貯藏期間的升高有促進作用,使pH升高更快。這可能是羥自由基氧化使得蛋白質分解加快,生成氨與胺類等小分子腐敗物質,同時在微生物的作用下加快pH的升高[19]。
2.2 蛋白質氧化對解凍失水率的影響
肉的保水性是評價肉品質的重要指標之一,保水性的高低對肉的品質有很大的影響,可直接影響肉的風味、顏色、質地、嫩度和凝膠性等[20]。解凍失水率可作為評價肌肉保水性能力強弱的指標之一。不同方式處理后凍藏烏鱧肌肉的自然解凍失水率如圖2所示,隨著貯藏時加的延長,氧化組A組和對照組B組、C組、D組的解凍失水率均呈現上升趨勢。在前4 d,氧化組A組的流失率與對照組B組、C組、D組有相同的上升趨勢,并且,B組在第2~4 d解凍流失率還略高于A組,但是前4 d差異不顯著(p>0.05)。氧化組A組在第4 d后開始快速上升,最終達到18.31%,而未氧化組在第4~10 d失水率上升趨勢平穩,B組增長趨勢最平緩,最終失水率也只有10.8%,在第10 d時,A組與B組兩者解凍失水率相差為7.51%,差異極顯著(p<0.01)。原因可能是蛋白質氧化加快了烏鱧肌肉中肌原纖維的裂解,肌原纖維小片化升高,破壞了肌肉組織的穩定性,使得肌肉固定內部水分的能力下降,從而解凍失水率升高。此結果與劉澤龍等[21]研究的結果一致。
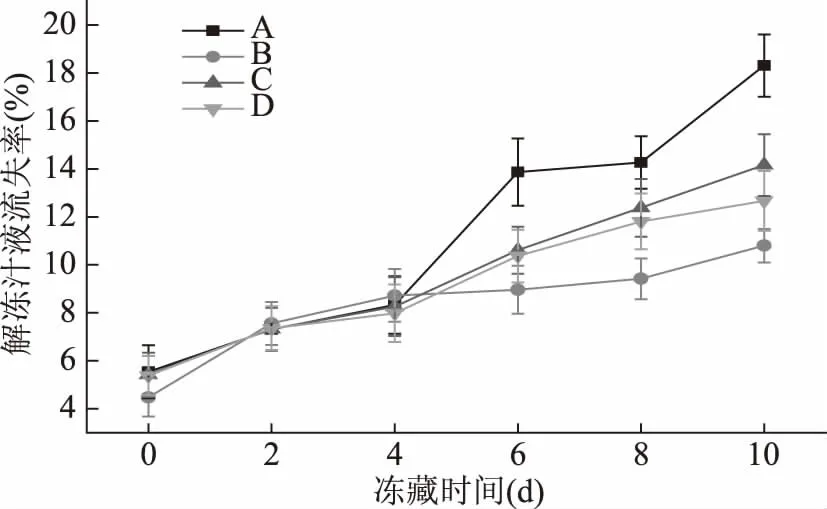
圖2 烏鱧在不同處理方式凍藏過程中解凍失水率的變化Fig.2 Changes of drip loss rate in snakehead after thawing with different processing
2.3 蛋白質氧化對加壓失水率的影響
加壓失水率能反映冷凍處理過程中胞內冰晶形成的數量及其對肌肉纖維的破壞作用。大多數保水性蛋白如肌原纖維蛋白、肌漿蛋白等都存在于肌細胞內部,這些蛋白對水具有一定的結合力,在解凍后胞內冰晶的水分不能輕易地流出來。在外界壓力的作用下,這些水分則能從胞內流到胞外,從而反映胞內冰晶形成的狀況[22]。不同方式處理下,烏鱧在凍藏過程中加壓失水率的變化如圖3所示,氧化組和未氧化組在凍藏期間加壓失水率都呈現上升趨勢,其中,在相同的凍藏時間,氧化組的加壓失水率均比未氧化組的高,在第10 d A組與D組兩組之差達到最大,為5.32%。氧化組A組加壓失水率第0 d為24.35%,第10 d為36.14%,增加了36.62%;B組加壓失水率第0 d是16.43%,第10 d為32.11%,增加了48.83%。結果顯示,氧化組A組有較高的初始加壓失水率,而對照B組有著最高的增長率。B組在前6 d的加壓失水率較低,可能是因為B組樣品只是暴露于空氣中,沒有被蒸餾水或者其他溶液浸泡,表面水分較少,凍藏初期表面形成冰晶的含量較少,樣品溫度下降較A組、C組、D組緩慢,胞內冰晶形成的數量少,對肌肉纖維破壞小,因此前6 d加壓失水率較低。
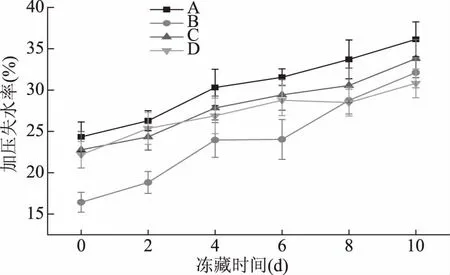
圖3 烏鱧在不同處理方式凍藏過程中加壓失水率的變化Fig.3 Changes of drip loss in snakehead after forcing with different processing
2.4 蛋白質氧化對蒸煮損失率的影響
蒸煮損失也是肌肉保水能力強弱的指標之一,烏鱧在-4 ℃凍藏過程中,用不同方式處理蒸煮損失率的變化如圖4所示。各組樣品的蒸煮損失率都隨著貯藏時間的延長而增加,且增加的幅度都較大。如氧化組A組的蒸煮損失率從第0 d的23.81%增加到第10 d的35.78%,增加了11.97%;對照組B組的蒸煮損失率從第0 d的13.28%增加到第10 d的25.13%,增加了11.85%。四組樣品蒸煮損失率的不同,主要表現在經過氧化的樣品在相同的凍藏時間內的蒸煮損失率比對照組要高,平均高出20%左右。A組蒸煮損失率較高的原因可能是蛋白質氧化使肌肉纖維蛋白變性,并造成肌肉的收縮,致使肉的嫩度下降,結合水的能力下降,加上蒸煮時間和溫度的影響,汁液流失嚴重,所以初始蒸煮損失率較高且隨著貯藏時間的增加不斷升高。
2.5 蛋白質氧化對蛋白羰基含量變化的影響
蛋白羰基的產生是蛋白氧化的標志之一,一般可由蛋白發生α-酰胺化或者谷氨酰側鏈的氧化而裂解形成多肽,并在其N端形成α-酮酯酰衍生物。也可由氨基酸側鏈殘基直接氧化生成,或者與脂類過氧化產生的醛類物質或還原糖氧化生成的羰基衍生物反應生成[23]。烏鱧在-4 ℃凍藏過程中,用不同方式處理羰基含量的變化如圖5所示。各組樣品的羰基含量隨著貯藏時間的延長而增加,且氧化組A組在相同時間內的蛋白羰基含量一般比對照組的高,氧化組A組與對照組B組相比,氧化組A組的羰基含量比B組最高多1.61 nmol/mg;其中A組和B組在第2~4 d的增長幅度最大,分別增長了22.34%、31.96%,但對照組B組在第6~8 d增長迅速,達到與A組相近的水平,而C組、D組增長沒有B組快,這可能是由于初始條件設定時,B組只是單純地暴露于空氣中,C組添加蒸餾水,D組添加磷酸鹽緩沖溶液造成的,從而說明將魚肉暴露空氣中一段時間后再凍藏,在儲存后期魚肉羰基含量的增長速度會有所提升。
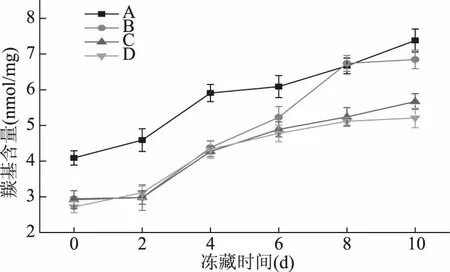
圖5 烏鱧在不同處理方式凍藏過程中蛋白羰基含量的變化Fig.5 Changes of protein carbonyl contents in snakehead with different processing
2.6 蛋白質氧化對TBARS的影響
脂質過氧化過程能引起脂質過氧化反應形成脂質過氧化產物(Lipid PerOxide,LPO)如丙二醛(Malonaldehyde,MDA)和4-羥基壬烯酸(4-hydroxynonenal,HNE),從而改變細胞膜的流動性和通透性,導致細胞結構和功能的改變[24]。TBARS法是測定脂質過氧化反應的一些醛類產物,已被廣泛用作診斷組織傷害和脂過氧化程度的指標。烏鱧在-4 ℃凍藏過程中,用不同方式處理羰基含量的變化如圖6所示。四組樣品的羰基含量均隨貯藏時間的延長而增加,氧化組A組從第0~10 d羰基含量增加53.53%,對照組中B組從第0~10 d羰基含量增加32.93%,但對照組B、C、D組在第6、8、10 d增加平穩,氧化組A組增長趨勢依舊很高。原因可能是蛋白質氧化破壞了組織結構的完整性,使得蛋白質和脂質暴露,氧化速度加快。胡玥等[25]認為在貯藏過程中冰晶的形成對細胞產生了破壞作用,使得魚肉脂肪更容易氧化,同時還認為貯藏溫度對TBARS值也有一定的影響。
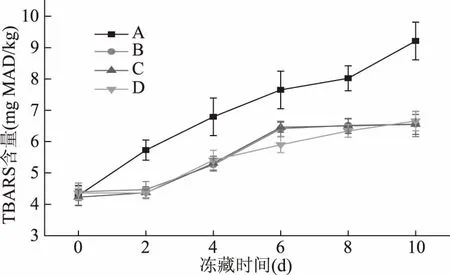
圖6 烏鱧在不同處理方式凍藏過程中TBARS含量的變化Fig.6 Changes of TBARS in snakehead with different processing
2.7 蛋白質氧化對MFI的影響
MFI表示肌原纖維的分解程度,是用來表征肌原纖維內部結構和衡量宰后肌肉成熟速度的一個指標,MFI越大,說明肌原纖維內部結構受到的破壞的程度越大[26]。烏鱧在-4 ℃凍藏過程中,用不同方式處理MFI的變化如圖7所示,氧化組與未氧化組的MFI隨貯藏時間的延長均增加,在相同貯藏時間內,氧化組A組的MFI均比未氧化各組的高,以與B組相比為例,在第10 d兩者之差達到最大,為37.06。氧化組A組在第6、8、10 d增長幅度較大(p<0.05),而B組的增長幅度較平緩,而對照組B組、C組和D組之間無顯著差異(p>0.05)。MFI值能反映肌細胞內部肌原纖維的完整性,同時也能反映骨架蛋白的破壞程度,與肉嫩度顯著相關[27],可做為評價肌肉嫩度的指標。MFI升高說明氧化體系破壞了肌原纖維和蛋白質結構的完整性,蛋白質變性,肌原纖維間隙變大,暴露于氧的機會更多,從而加劇了小片化的速率。
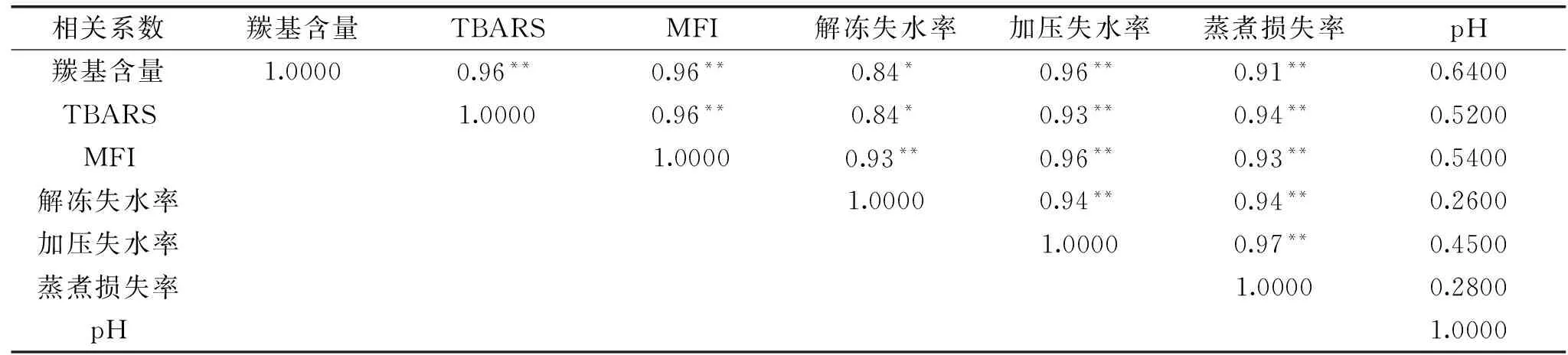
表1 未氧化樣品理化指標的相關性分析Table 1 Correlation analysis of physical and chemical index of oxidation sample
注:*(p<0.05);**(p<0.01);表2同。
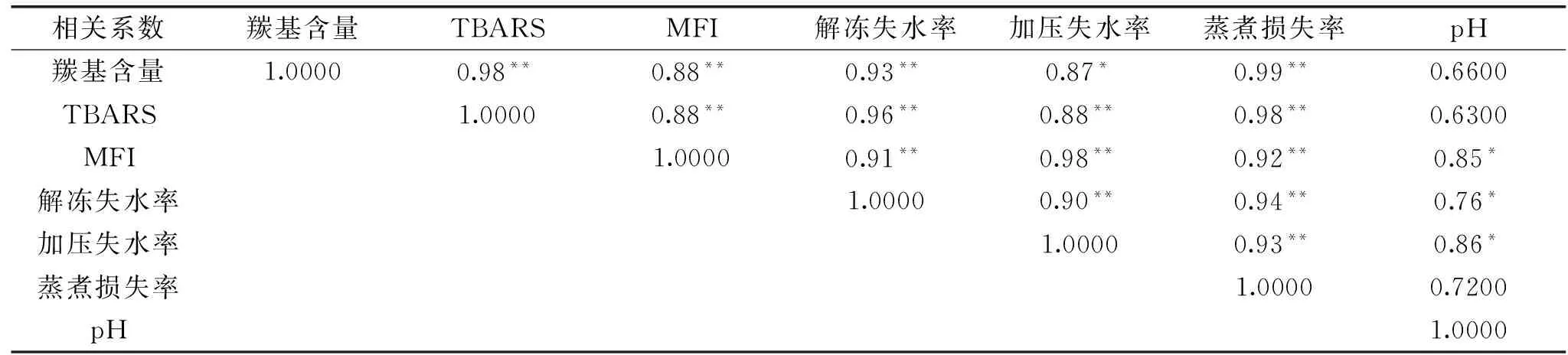
表2 氧化樣品理化指標的相關性分析Table 2 Correlation analysis of physical and chemical index of oxidation sample
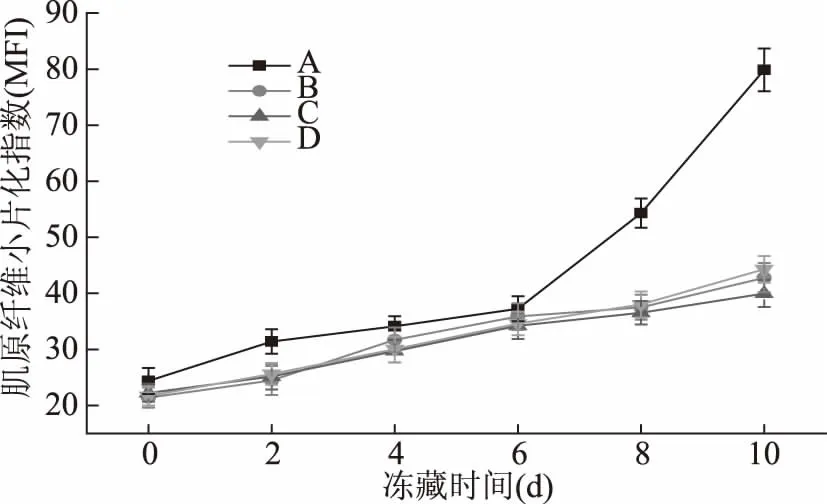
圖7 烏鱧在不同處理方式凍藏過程中MFI的變化Fig.7 Changes of MFI in snakehead with different processing
2.8 肌原纖維蛋白結構變化與保水性指標的相關性分析
氧化樣品為A組,未氧化樣品選取B組做各生化指標相關性分析,結果如下:
未氧化樣品肌原纖維蛋白結構變化中羰基含量、TBARS、MFI等指標與氧化引起的肌肉保水性變化指標中pH、解凍失水率、加壓損失率、蒸煮損失率等理化指標的相關性分析如表1所示。未氧化樣品中羰基含量與加壓失水率、蒸煮損失率差異極顯著(p<0.01),與解凍失水率差異顯著(p<0.05),且在未氧化樣品中肌肉結構指標分析與保水性指標分析與pH的相關性差異不顯著(p>0.05)。
氧化樣品肌原纖維蛋白結構變化中羰基含量、TBARS、MFI等指標與氧化引起的肌肉保水性變化指標中pH、解凍失水率、加壓損失率、蒸煮損失率等理化指標的相關性分析如表2所示。羰基含量與解凍失水率、蒸煮損失率具有極顯著相關性(p<0.01),與加壓失水率具有顯著相關性(p<0.05);TBARS和MFI與解凍失水率、加壓失水率、蒸煮損失率均具有極顯著相關性(p<0.01);羰基含量、TBARS與pH相關性不顯著(p>0.05),只有MFI與pH顯著相關(p<0.05)。
研究顯示,若環境中存在有自由基及其相關氧化物,蛋白質中某些氨基酸殘基會發生氧化反應,從而改變蛋白質物理結構致使蛋白質的功能發生變化,這會讓蛋白質對氧化物的親和力增加,使蛋白質更加容易發生例如水解、聚合、交聯等反應,損害細胞的功能嚴重的甚至會導致細胞死亡[28]。最初,研究者對食品中的脂質過氧化做了較多的研究,并認為脂質過氧化是造成食品品質下降的主要原因之一。近年來不少學者研究了蛋白質氧化和脂質氧化之間的關系,發現蛋白質氧化和脂質氧化之間存在相互促進的關系,陸玉芹[29]與Baron[30]均發現,魚肉中的羰基含量和硫代巴比妥酸反應物含量隨著貯藏時間的增長而增加,脂質氧化產生的氫過氧化物可誘導魚肉蛋白質羰基含量増加。另外,鄧敏[31]研究發現魚肉經過凍藏后,肌纖維組織結構會發生明顯變化,凍藏時間越長,形成的冰晶越多,且由于冰晶升華等作用引起的蛋白質變性和脂肪氧化越強,導致肌纖維結構改變,從而對肌肉保水性產生影響。
大多數的肉品在凍藏過程中品質是逐漸變壞的,肌肉保水性主要取決于蛋白質表面水合作用和肌纖維晶格的毛細管效應,有研究表明宰后蛋白氧化會使肌肉蛋白質疏水性殘基暴露,蛋白水合面下降,親水性降低,導致肌肉保水性下降[32]。劉澤龍[21]發現在強氧化條件下,FC&D Blue No.1示蹤實驗顯示氧化溶液能夠更快速的深入到肌肉內部,并且氧化也提高了肉腌制后吸收外源水分的能力。但是也由于肌原纖維蛋白的氧化而降低了肌肉本身的持水力和蒸煮后的系水能力;李儒仁等[33]]發現凍藏條件下,牦牛肉氧化狀態的改變使蛋白質容易發生羰基化反應、羧化作用以及形成希夫堿,進而影響蛋白質空間結構以及蛋白質與水分子的相互作用,最終影響肌肉的保水性。
3 結論
烏鱧經羥自由基氧化系統氧化后,其解凍失水率、加壓失水率、蒸煮損失率等均隨著貯藏時間有所升高,其中,解凍失水率在第4 d開始快速上升,明顯高于對照組,加壓失水率和蒸煮損失率初始值較高,并且在隨后的貯藏中一直高于對照組;烏鱧肌肉氧化后其羰基含量、TBARS、MFI等均高于對照組,MFI從第6 d開始有明顯的升高,這些結果表明,羥自由基氧化引起肌纖維結構變化,完整性遭到破壞,氧化也造成了蛋白質的變性,引起蛋白功能性質的降低,使其保水能力降低,影響了魚肉制品的品質特性、加工性能和食用特性,所以在魚類制品的加工、貯藏和運輸過程中盡量控制氧化。
[1]余紅有. 鄱陽湖烏鱧生物學及其人工繁殖技術的研究[D].南昌:南昌大學,2007.
[2]Lam T J. Fish culture in southeast Asia[J]. Canadian Journal of Fisheries and Aquatic Sciences,1982,39(1):138-142.
[3]聶國興,張浩. 烏鱧肌肉營養成分分析[J]. 淡水漁業,2002,32(2):46-47.
[4]黃明,黃峰,黃繼超,等. 內源性蛋白酶對宰后肌肉嫩化機制研究進展[J]. 中國農業科學,2011,44(15):3214-3222.
[5]Babakhani A,Farvin K H S,Jacobsen C. Antioxidative effect of seaweed extracts in chilled storage of minced Atlantic mackerel(Scomberscombrus):effect on lipid and protein oxidation[J]. Food and Bioprocess Technology,2016,9(2):352-364.
[6]王誠. 膠原蛋白酶在鯉魚肌肉軟化過程中的作用及機理研究[D]. 廈門:集美大學,2013.
[7]LundMN,Heinonen M,BaronC P,et al. Protein oxidationin muscle foods:A review[J]. Molecular Nutrition & FoodResearch,2011,55(1):83-95
[8]王金路,儀淑敏,勵建榮,等. 草魚內臟水解蛋白對鱸魚肉保水性的影響[J]. 食品工業科技,2015,(24):315-320,333.
[9]尚校蘭,劉安軍. 超高壓處理與添加復合磷酸鹽對海鱸魚保水性的比較[J]. 食品科學,2013(6):56-59.
[10]李莎莎,安玥琦,丁玉琴,等. 堿性鹽對冷凍魚糜保水性的影響[J]. 食品科學,2012,(21):68-72.
[11]Chin K B,Go M Y,Xiong Y L. Konjac flour improved textural and water retention properties of transglutaminase-mediated,heat-induced porcine myofibrillar protein gel:effect of salt level and transglutaminaseincubation[J]. Meat Science,2009,81(3):565.
[12]Jiang X J,Zhang Z J,Cai H N,et al. The effect of soybean trypsin inhibitor on the degradation of myofibrillar proteins by an endogenous serine proteinase of cruciancarp[J]. Food Chemistry,2006,94(4):498-503.
[13]Li Y,Kong B,Xia X,et al. Structural changes of the myofibrillar proteins in common carp(Cyprinuscarpio)muscle exposed to a hydroxyl radical-generating system[J]. Process Biochemistry,2013,48(5):863-870.
[14]Farouk M M,Wieliczko K J,Merts I. Ultra-fast freezing and low storage temperatures are not necessary to maintain the functional properties of manufacturing beef[J]. Meat Science,2004,66(1):171-179.
[15]Oliver C N,Ahn B W,Moerman E J,et al. Age-related changes in oxidized proteins[J]. Journal of Biological Chemistry,1987,262(12):5488-5491.
[16]Vyncke W. Evaluation of the direct thiobarbituric acid extraction method for determining oxidative rancidity in mackerel(ScomberscombrusL.)[J]. European Journal of Lipid Science and Technology,1975,77(6):239-240.
[17]Culler R D,Smith G C,Cross H R. Relationship of myofibril fragmentation index to certain chemical,physical and sensory characteristics of bovine longissimusmuscle[J]. Journal of Food Science,1978,43(4):1177-1180.
[18]孟彤,劉源,仇春泱,等. 蛋白質氧化及對肉品品質影響[J]. 中國食品學報,2015,01:173-181.
[19]闕婷婷. 不同低溫保鮮方法對烏鱧魚肉理化性質以及組織結構的影響[D].杭州:浙江大學,2014
[20]郭園園,孔保華,夏秀芳,等. 冷凍-解凍循環對鯉魚肉物理化學特性的影響[J]. 食品科學,2011,32(13):125-130.
[21]劉澤龍. 蛋白質氧化對肉及肉制品持水與水合特性的影響機理研究[D].無錫:江南大學,2012.
[22]Zhu S,Ramaswamy H S,Simpson B K. Effect of high-pressure versus conventional thawing on color,drip loss and texture of Atlantic salmon frozen by different methods[J]. LWT-Food Science and Technology,2004,37(3):291-299.
[23]Stadtman,E. R. Protein oxidation and aging[J]. Free Radic Res,2006,40(12):1250-1258.
[24]Liu Z,Xiong Y L,Chen J. Protein oxidation enhanceshydration but suppresses water-holding capacity in porcine longissimusmuscle[J]. Journal of Agricultural and Food Chemistry,2010,58(19):10697-10704.
[25]胡玥,楊水兵,余海霞,等. 微凍保鮮方法對帶魚品質及組織結構的影響[J]. 食品科學,2016,37(18):290-297.
[26]黃明,周光宏,徐幸蓮,等. 不同注射處理對牛肉剪切力和肌原纖維小片化指數的影響[J]. 食品科學,2005,26(2):68-70.
[27]Geensink G H,R G Taylor,A E D Bekhit,et al. Evidenceagainistthenon-enzymatic calciumtheory of tenderization[J].MeatScience,2001,59:417-422
[28]朱衛星,王遠亮,李宗軍. 蛋白質氧化機制及其評價技術研究進展[J]. 食品工業科技,2011(11):483-486.
[29]陸玉芹. 磷酸鹽處理對羅非魚片蛋白質和脂質氧化及品質的影響[D]. 南寧:廣西大學,2015.
[30]Baron C P,Kj?rsg?rd I V H,Jessen F,et al. Protein and lipid oxidation during frozen storage of rainbow trout(Oncorhynchusmykiss)[J]. Journal of Agricultural and Food Chemistry,2007,55(20):8118-8125.
[31]鄧敏. 浸漬凍結流速及凍藏對草魚塊品質影響的研究[D]. 廣州:華南理工大學,2013.
[32]Xia X,Kong B,Xiong Y,et al. Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J]. Meat Science,2010,85(85):481-486.
[33]李儒仁,韓玲,余群力,等. 凍藏對牦牛肉蛋白質、脂質氧化和保水性的影響[J]. 農業機械學報,2015,46(6):218-225.
Effectsofwaterholdingcapacityofsnakeheadinducedbyproteinoxidationduringfrozenstorage
QINJun-wei,WANGHan-ling,YUXue-hui,ZHUXin-rong,ZHANGJian*
(Food College,Shihezi University,Shihezi 832000,China)
Snakehead is a kind of fish and its nutritional and economic value is very high,but it is easy to deterioration and lead to the quality problem during the storage. The water retention-related indicators of snakehead fillets were studied after the fillets were oxidized by oxidation system and frozen at -4 ℃,this experiment studied the changes of snakehead muscle water holding capacity. The results showed that there were obvious changes after frozen storage at -4 ℃,thawing loss rate,pH,pressing loss rate,cooking loss rate of oxidized snakehead fillets(group A)were higher than those of unoxidized snakehead fillets(group B). On the 10th day,the thawing loss rate,pressing loss rate,cooking loss rate of group A was 7.51%,14.74% and 10.65% higher than that of group B,respectively. Protein carbonyl content,Thiobarbituric acid value(TBARS)and myofibril fragmentation index(MFI)increased significantly,demonstrating the water holding capacity dropped. In the correlation analysis,the carbonyl content,TBARS and MFI of oxidized samples with myofibrillar protein structural were significantly correlated with thawing loss rate,pressing loss rate and cooking loss rate,respectively(p<0.01),and MFI were correlated with pH(p<0.05).These results showed that the hydroxyl radical oxidation system coulddamage the structure of myofibrillar proteins and make the proteins oxidative degradation in snakehead,leading to a decline in its water holding capacity.
snakehead;protein oxidation;frozenstorage;water holding capacity
2017-05-05
秦軍委(1990-),男,碩士研究生,研究方向:食品生物化學,E-mail:qjw0217@163.com。
*通訊作者:張建(1979- ),男,博士,教授,研究方向:食品生物化學,E-mail:zhangjian0411@163.com。
石河子大學重大科技攻關計劃項目(gxjs2015-zdgg06)。
TS254.4
A
1002-0306(2017)23-0029-07
10.13386/j.issn1002-0306.2017.23.007

