如何促進反應原理核心概念的形成
王福成

“化學反應限度”是中學化學的一個教學難點。國內外的研究表明,學生對化學反應限度的認識一直存在較多誤區。例如,學生把可逆反應達到化學反應限度時的化學平衡與日常生活中的平衡等同起來,認為所謂的平衡就是指靜止的、不變的狀態[1],而非動態平衡。學生不是把平衡混合物看作一個整體,而是認為化學平衡的兩邊各自獨立進行,在逆反應開始之前,反應先往正方向進行且達到完全,接著反應又朝著逆方向進行,如此反復交替,如同鐘擺運動[2][3]。
新課標中明確要求應設計實驗證明某些化學反應的可逆性,而教師在處理方法上多以問題引導,直指問題核心—理解化學平衡的建立過程與本質特征,缺乏實驗根基。從教學目標來看,如果簡單地將“化學反應限度”內容定位于“通過實驗認識化學反應的限度”,就會失去一次幫助學生建構化學反應原理核心概念的契機。
一、核心概念分析及教學目標確定
“化學反應限度”屬于化學熱力學研究的范疇,是中學化學的重要概念之一。它是中學化學涉及的溶解平衡、電離平衡和水解平衡等知識的核心,對學生研究物質在水溶液中的行為起著極其重要的指導作用。“化學反應限度”是理解化學反應的一個重要維度,是建立“平衡觀”的起點,是選修“化學反應原理”的必要基礎。
熱力學認為,與一切自然過程一樣,一定條件下進行的化學反應受到來自能量和熵的兩個方向的推動:一方面傾向于達到能量的最低狀態,另一方面又力求實現熵的最大狀態。兩種推動的效果正好相反,而又同時存在。“相同條件”“同時進行”和“自發地趨向于平衡”,是一切可逆反應的共同特征。當可逆反應達到平衡狀態時,基本特征是體系中的所有組分的濃度不再繼續隨時間而改變。由于反應物和生成物共存,到達平衡狀態時正逆反應不會停止,其實質是動態平衡,宏觀表現為正逆反應速率相等。此時,可逆反應在該條件下達到最大程度,即反應限度。當條件改變時,這種動態平衡就會被破壞,直至達到新的平衡,反應限度也隨之改變。因此,本節課的核心概念為可逆反應在給定條件下有一定的限度,改變反應條件可以在一定程度上改變反應限度,即改變該反應的化學平衡狀態。因此,通過調控反應條件,可使反應更好地符合人們預期的結果(見圖1)。
基于以上分析,本節課的教學重點和難點為:理解可逆反應的特征;認識化學平衡狀態的特征和實質。
二、挖掘實驗教學功能,促進核心概念形成
1.科學史話激疑,引入可逆反應概念
傅鷹先生說過:“化學可以給人以知識,化學史更可以給人以智慧。”用化學史料創設問題情境,可以充分反映人們在認識自然界過程中的科學態度和科學思想,有利于學生學到形成和運用知識的科學方法,養成嚴謹求實的科學態度。
例如,鋼鐵生產是17世紀從英國開始的第一次產業革命的兩大支柱之一。但煉制1t生鐵所需焦炭的實際用量,遠高于按照化學反應方程式計算所需的量,且從高爐頂端出來的氣體中總含有沒被充分利用的CO氣體。起初,煉鐵工程師認為是CO與鐵礦石接觸不夠充分之故,于是設法增加高爐的高度。然而令人吃驚的是,高爐增高后,高爐尾氣中CO的比例竟然沒有改變。這時教師就可以提問學生:你能揭開煉鐵工程師的困惑嗎?
2.自主實驗探究,建構可逆反應概念
教師要善于發現和提出有探究價值的化學問題,引導學生依據探究目的,設計并優化實驗方案,完成實驗操作,對觀察記錄的實驗信息(證據)進行加工并獲得結論,培養學生敢于質疑和批判的創新精神。
【問題1】將0.01mol/L的FeCl3溶液與0.01mol/L的KI溶液混合,會發生怎樣的反應?說出你的依據。
【設計說明】調研發現,學生尚未形成認識化學反應的一般思路,即性質決定反應,反應是性質的體現。他們雖然形成了認識物質性質的三個視角—氧化還原、類別和元素周期律(表),但不會自覺地將三者有機結合,為此,教師設計了問題1。Fe3+具有較強的氧化性,I-還原性如何?根據元素周期律,碘元素的非金屬性較弱,推知碘單質的氧化性較弱,則I-還原性較強,因此,Fe3+和I-之間可能會發生氧化還原反應。
【學生活動1】設計實驗證明反應:2Fe3++2I-→2Fe2++I2
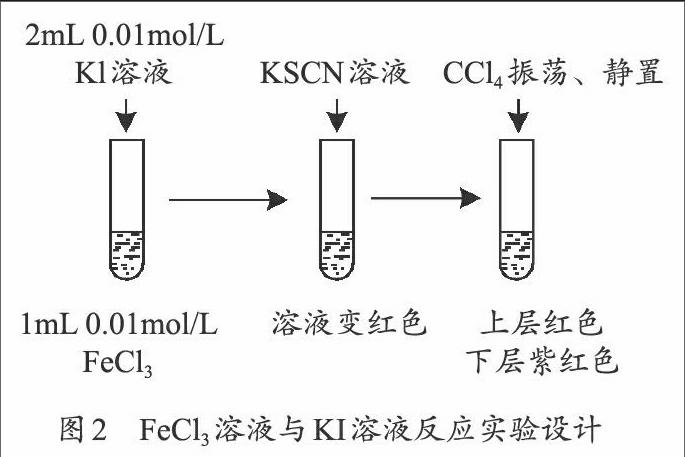
試劑:0.01mol/L的KI溶液、0.01mol/L的FeCl3溶液、0.1mol/L的KSCN溶液和CCl4。
【設計說明】用氯化鐵與碘化鉀證明化學反應有一定限度,一些教師提出還可用“CCl4—K4Fe(CN)6法”“淀粉—KSCN法”[4]。
實驗設計見圖2。
【問題2】你認為可能是哪些原因,使Fe3+不能全部消耗?
【設計說明】將少量FeCl3溶液與過量KI溶液混合后,Fe3+仍然有剩余,說明正向反應沒有完全進行到底,即反應有一定限度嗎?不能。Fe3+不能全部消耗,可能存在以下三個原因:從體系內考慮,還原性強的Fe2+可能會被氧化性較弱的I2氧化;氧化還原型離子反應普遍比復分解型反應速率慢;從環境因素看,可能是空氣中的氧氣將Fe2+氧化。
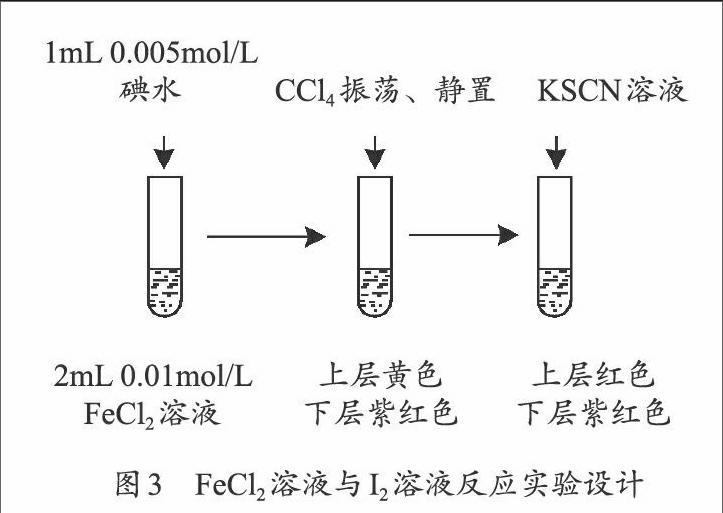
【學生活動2】設計實驗證明反應:2Fe2++I2 →2Fe3++2I-
試劑:0.005mol/L碘水、0.01mol/L FeCl2溶液、0.1mol/LKSCN溶液和CCl4。
【設計說明】Fe3+與I-反應速率慢,是一個不可忽略的因素,需要在相同條件下證明逆反應的存在,實驗設計見圖3。
基于以上實驗事實得出結論:相同條件下,反應2Fe3++2I-2Fe2++I2是可逆的。
3.深挖實驗素材,建構反應限度概念
基于實驗信息(證據)進行分析推理,認識化學現象與數學模型之間的聯系,由宏觀到微觀,由微觀再走向宏觀,是促進學生形成科學概念的重要手段。
【學生活動3】若在t1時刻溶液顏色不再變化,請學生在圖4中畫出I2濃度隨時間變化的曲線。endprint
【問題3】從t1時刻開始,反應“停止”了嗎?為什么?
【設計說明】引導學生由定性到定量認識化學平衡狀態的基本特征,是反應物和生產物濃度不再改變;之所以反應沒有“停止”,是由于反應物和生成物微粒共存于同一體系,微粒間的相互作用仍然存在。
【學生活動4】判斷圖4中A、B、C、D四點用Fe3+表示的正逆反應速率大小,在圖5中畫出v(Fe3+)—t曲線。
【設計說明】認識到化學平衡的實質是動態平衡,宏觀表現為正逆反應速率相等。A點時正反應c(Fe3+)最大,正反應速率最大;逆反應生成的c(Fe3+)是0,逆反應速率為0。B點時正反應消耗的c(Fe3+)減小,正反應速率減小;逆反應生成的c(Fe3+)增大,逆反應速率增大,v正(Fe3+)>v逆(Fe3+),因此仍然表現為c(Fe3+)減小。從C點到D點,正反應消耗的c(Fe3+)與逆反應生成的c(Fe3+)相等,v正(Fe3+)=v逆(Fe3+),表現為c(Fe3+)不再發生變化。這時教師要總結化學平衡狀態和化學反應限度及其特征。
4.完善實驗探究,形成核心概念
無論是對學生還是科學家,科學活動和科學思維的目的都是為了理解世界,通過實驗探究,可以使學生體會完整的科學探究過程,優化實驗教學設計,建構合理的知識結構,從而有利于形成核心概念。例如,如果向圖2實驗中繼續加入0.1mol/L的KI溶液,振蕩,上層紅色變淺,由此你會得出什么結論?你怎樣認識可逆反應、化學平衡和化學反應限度間的關系?
通過演示實驗,學生可以認識到可逆反應在一定條件下建立的化學平衡狀態是可以改變的,從而形成本節課的核心概念:可逆反應在給定條件下有一定的限度,改變反應條件可以在一定程度上改變反應限度,即改變該反應的化學平衡狀態。
三、反思
核心概念的形成需要大量的實證,運用分類與比較、宏觀與微觀、定性與定量相結合等化學思想方法,抽象概括出事物的關鍵特征。在教學過程中,實證越豐富,關鍵特征越明顯,越有利于核心概念的理解。化學實驗是獲得實證的常用方式,學生需要根據實驗目的設計實驗,通過觀察并記錄實驗數據獲得實證。實踐表明,深入挖掘實驗教學功能,有助于促進核心概念的形成,提高學生的學科素養。
參考文獻:
[1]Maskill,R.,Cachapuz,A.F.C.,Learning about the Chemistry Topic of Equilibrium[C].The Use of Word Association Tests to Detect Developing Conceptualizations. International Journal of Science Education,1989,11(1).
[2]Vanessa Barker.Beyond Appearances:StudentsMisconceptions about Basic Chemical Ideas[R].A Report Prepared for the Royal Society of Chemistry.
[3]Bergquist,W.,Heikkinen,H.,StudentsIdeasregarding Chemical Equilibrium[J]. Journal of Chemical Education,1990,67(12).
[4]朱正德.氯化鐵溶液與碘化鉀溶液反應限度實驗的設計[J].化學教學,2012(4).
責任編輯:孫建輝endprint

