IKCa1通道對HeLa細胞遷移、侵襲及miRNA表達譜的影響
程慧,高蘭陽,詹平,毛熙光
( 西南醫科大學附屬醫院,四川瀘州 646000)
IKCa1通道對HeLa細胞遷移、侵襲及miRNA表達譜的影響
程慧,高蘭陽,詹平,毛熙光
( 西南醫科大學附屬醫院,四川瀘州 646000)
目的探討鈣激活鉀離子(IKCa1)通道對宮頸癌HeLa細胞遷移、侵襲及miRNA表達譜的影響。方法取生長期HeLa細胞,隨機分為觀察1~5組及DMSO組,分別給予0、10.0、20.0、30.0、40.0 μmol/L TRAM-34及等體積DMSO(TRAM-34溶劑)處理24、48和72 h,用劃痕實驗檢測HeLa細胞遷移特性;用Transwell侵襲實驗檢測48 h細胞侵襲特性。用高通量測序法檢測IKCa1通道阻斷前后miRNA 表達譜的差異,并用qRT-PCR法對部分差異表達miRNAs進行驗證。運用miRanda軟件預測差異miRNA可能調控的靶基因,并對這些靶基因進行通路富集分析。結果劃痕實驗,TRAM-34干預后HeLa細胞遷移受抑制,隨著TRAM-34濃度增加及作用時間延長,抑制遷移作用越明顯(Plt; 0.001)。Transwell侵襲實驗顯示,HeLa細胞的侵襲率隨TRAM-34濃度增加呈遞減趨勢(F=384.050,Plt;0.001)。通過高通量測序篩選出15個差異有統計學意義而表達上調的miRNA,5個表達下調的miRNA。qRT-PCR結果顯示差異性miRNA 的表達趨勢與測序結果一致。生物信息學分析發現,hsa-miR-143-5p的靶基因在癌癥相關通路、p53基因信號通路及MAPK信號通路上出現聚集; 而hsa-miR-421的靶基因在腫瘤蛋白多糖、Rap1信號通路和Wnt信號通路出現聚集。結論阻斷IKCa1通道可抑制HeLa細胞遷移和侵襲,影響miRNAs表達譜。
宮頸腫瘤;HeLa細胞;IKCa1通道;細胞遷移;侵襲;微小RNA
宮頸癌發病率僅次于乳腺癌,近年發病呈年輕化趨勢[1]。鈣激活鉀通道(IKCa1)在人體廣泛分布,通過影響細胞內鈣離子濃度和細胞膜電位,參與細胞間信號傳遞、基因表達與調控,其異常高表達與腫瘤發生發展相關。目前證實IKCa1在乳腺癌、子宮內膜癌、前列腺癌和肝細胞癌等惡性腫瘤組織中高表達[2,3],參與腫瘤細胞的增殖和轉移[4]。我們前期研究發現,IKCa1通道在宮頸癌組織及細胞中呈高表達,且與宮頸癌細胞增殖、細胞周期有關[5],但IKCa1通道是否與宮頸癌細胞遷移和侵襲相關,目前尚未見報道。微小RNA(miRNA)是一類高度保守的非編碼小RNA,在轉錄后水平調節靶基因表達。2016年4~10月,我們探索IKCa1通道對HeLa細胞遷移、侵襲及miRNA表達譜的影響。現將結果報告如下。
1 材料與方法
1.1 材料 人宮頸癌 HeLa 細胞株(醫學實驗中心,西南醫科大學);胎牛血清(四季青,杭州);PMI1640、DMEM(Gibco,美國):IKCa1通道的特性阻斷劑TRAM-34(Sigma,美國);Transwell小室 (Corning,美國)、Matrigel膠(Bamp;D Biosciences,美國),TRIzol試劑(Invitrogen,美國),Dnase I(Qiagen,德國),SYBR PrimeScript miRNA RT- PCR(Takara,日本),Small RNA Smaple Prep 文庫構建試劑盒(Illumina,美國),RNA提取試劑盒、dNTP mix(天根,北京);M-MLV逆轉錄酶購于TOYOBO;RNase inhibitor(Thermo Scientific,美國);iQTM SYBR?Green Supermix(Bio-Rad,美國);常規生物化學試劑(Corning,美國)。
1.2 HeLa細胞分組及遷移實驗 設置觀察1、2、3、4、5組及DMSO組,觀察1、2、3、4、5組分別給予0、10.0、20.0、30.0、40.0 μmol/L TRAM-34,DMSO組給予等體積的DMSO(TRAM-34溶劑),分別配置培養基。取對數期HeLa細胞接種于6孔板內,約1.0×105/mL,細胞貼壁生長24 h后鋪滿培養孔底部。用無菌200 μL槍頭在6孔板內等距劃3條平行線,去除原培養基,加入配好上述6個組培養基,每組設置 3個復孔,置于恒溫箱中培養。在干預的第0、24、48和72小時分別取出各組細胞進行拍照、測量劃痕距離,并計算實際遷移距離。
1.3 細胞侵襲實驗 HeLa細胞帖壁生長后更換為1.2中6組培養基培養48 h,消化,用DMEM重懸為2×105/mL的單細胞懸液。小室鋪好Matrigel基質膠后,上室加入細胞懸液100 μL,下室加入500 μL 2%胎牛血清的DMEM培養基,整個過程在冰上操作。置于37 ℃、5% CO2孵箱中培養48 h后取出細胞。用棉簽擦去濾膜上表面未穿透的細胞,對已穿透的細胞進行伊紅染色。倒置差顯微鏡觀察、拍照并計數。每個樣本均計數5個200倍高倍鏡視野。以各組細胞穿過Transwell小室的數量作為評價其侵襲能力的指標。
1.4 樣本總RNA提取、分離、測序文庫的構建及測序 根據1.2及1.3中6組的劃痕實驗及Transwell實驗結果,取對數生長期的HeLa細胞,分別加入觀察1組和觀察4組的TRAM-34處理細胞48 h,TRIzol法提取標本總RNA,所有步驟嚴格按說明書操作。提取的總RNA進行質檢,總RNA的OD260 /OD280值接近2∶1,OD260 /OD230值gt;1.8。說明制備RNA純度較高。樣本總RNA提取電泳結果顯示28 S和18 S條帶清晰可見,說明所提取的RNA無明顯降解,樣品檢測合格。每例樣本取2 μg總RNA進行15%尿素聚丙烯酰胺凝膠電泳,電泳后對18~35 nt片段進行切割、洗脫、純化回收。采用Illumina公司的Small RNASample Prep Kit 構建小RNA文庫。利用Small RNA的3′及5′端特殊結構,以total RNA為起始樣品,直接將Small RNA兩端加上接頭,然后反轉錄合成cDNA后經過PCR擴增,PAGE膠電泳分離目標DNA片段。原始序列經過處理后,觀察1組和4組所獲得的可用于分析的小RNA序列數量分別為10 355 783和11 680 732條。所獲得的序列長度主要集中于22~24 nt,說明測序獲得的序列質量較高,可用于后續的生物信息學分析。
1.5 小RNA數據處理和miRNA差異表達分析 測序所得長度為51 nt的小RNA序列通過去接頭、去除低質量和污染序列,最終獲得22~24 nt的高質量小RNA序列。采用Bowtie軟件將所得小RNA序列與參考基因組進行比對分析,再將匹配序列分別與RepBase18.07數據庫進行對比,篩選出miRNA序列并分類注釋,將樣本中的miRNA表達量標準化為 TPM,應用DEGseq軟件對2組樣本已知miRNA差異表達進行分析統計。差異miRNA篩選條件:將差異倍數≥1.5且Plt;0.05的miRNA定義差異表達的miRNA。
1.6 差異表達 miRNA 的驗證 應用qRT-PCR對5個顯著性差異表達的miRNA進行檢測,驗證高通量測序結果的可信性。rRNA U6作為內參,miRNA檢測用的正向特異性引物由廣州銳博生物科技有限公司合成,反向引物為試劑盒中特有。擴增條件:95 ℃ 20 s;95 ℃ 10 s; 60 ℃ 30 s;70 ℃ 1 s;讀板;40 個循環。PCR結果采用2-ΔΔCt法計算相對表達值。實驗重復3次。
1.7 靶基因生物信息學分析 用靶基因預測軟件miRanda對hsa-mi-451a、hsa-miR-143-5P、hsa-miR-122-5P、hsa-miR-421的靶基因進行預測及靶點確認。挑選的數據庫分別為miRanda、Pictar、PITA、TargetScan。根據miRNA與其靶基因間的對應關系,挑選hsa-miR-143-5P和hsa-miR-421作為差異顯著miRNA上調和下調的代表。通過 KEGG 數據庫對其預測靶基因的信號通路進行富集分析,以U6為內參。
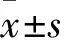
2 結果
2.1 各組不同時點HeLa細胞遷移實際距離比較 不同濃度TRAM-34作用后HeLa細胞遷移受到抑制,在一定范圍內呈時間和濃度依賴關系(Plt;0.05)。見表1。

表1 TRAM-34對HeLa細胞遷移的影響
注:與DMSO組相比,*Plt;0.001。
2.2 各組HeLa細胞侵襲能力比較 培養48 h后,細胞侵襲率隨TRAM-34濃度增加呈遞減趨勢。DMSO組、觀察1~5組穿過Transwell小室基底膜的細胞數分別為(127±4.40)、(130±3.58)、(100+4.40)、(83±6.26)、(56±3.10)、(44±5.05)個/HP,觀察2~5組培養48 h后穿過Transwell小室基底膜的細胞數相對于觀察1組及DMSO組明顯減少,且隨濃度增加,穿過的細胞數逐漸減少,差異有統計學意義(F=384.05,Plt;0.01);觀察1組及DMSO組間差異無統計學意義(Pgt;0.05)。
2.3 差異性表達 miRNAs 分析 加藥組(觀察4組)共得1 057個 miRNAs成熟體序列,觀察1組共得1 039個miRNAs成熟體序列。兩組871種 miRNAs共同表達,本實驗對miRNA差異表達的判斷標準為Plt;0.05,通過校正后的觀察4組與觀察1組樣品間表達倍數gt;1.5( 表達上調) 、lt;-1.5(表達下調)。進一步分析結果顯示20個miRNAs呈顯著性差異表達。在差異性表達的miRNAs中,15種miRNAs表達上調,包括hsa-miR-148a-3p、hsa-miR-22-3p、hsa-miR-582-3p、hsa-miR-126-3p、hsa-miR-19b-3p、hsa-miR-32-5p、hsa-miR-223-3p、hsa-miR-451a、hsa-miR-24-2-5p、hsa-miR-143-3p、hsa-miR-122-5p、hsa-miR-3591-3p、hsa-miR-139-5p、hsa-miR-19a-3p、hsa-miR-378d,5種miRNAs表達下調,包括hsa-miR-3529-3p、hsa-miR-7-5p、hsa-miR-4521、hsa-miR-421、hsa-miR-27b-5p。
2.4 qRT-PCR 驗證 qRT-PCR對4個上調表達的miRNAs(hsa-miR-451a、hsa-miR-122-5P、hsa-miR-143-3P、hsa-miR-223-3P)和1個下調的hsa-miR-421進行驗證。結果顯示hsa-miR-451a、hsa-miR-122-5P、hsa-miR-143-3P、hsa-miR-223-3P、hsa-miR-421相對表達量分別為1.128±0.121、1.178±0.063、1.261±0.228、0.906±0.194、0.737±0.124,變化趨勢與高通量測序的結果基本一致(P均lt;0.05),進一步證實高通量測序結果的準確性。
2.5 hsa-miR-143-5P和hsa-miR-421靶基因生物信息學預測 hsa-miR-143-5P和hsa-miR-421作為顯著差異miRNA表達上調和下調的代表,應用在線靶基因預測軟件miRanda對其可能的靶基因進行預測后,對這些基因進行信號通路分析,發現hsa-miR-143--5P靶基因在腫瘤蛋白多糖(4個基因)、癌癥相關通路(53個基因)、p53基因信號通路(18個基因)及MAPK信號通路( 10 個基因)上出現聚集;而hsa-miR-421靶基因在腫瘤蛋白多糖(23個基因) 、Rap1信號通路 (99個基因)和 Wnt 信號通路(70個基因)出現聚集。
3 討論
人類miRNA控制著約60%的蛋白編碼基因表達,而且編碼的基因一半以上均位于已知腫瘤相關的基因缺失、擴增、轉位的高發區域或脆性位點[6]。miRNA具有腫瘤抑癌基因及癌基因的作用,一個miRNA可調節多個靶基因,一個靶基因可受多個miRNA的調節。部分蛋白及轉錄因子會負向調控miRNA,參與腫瘤的細胞分化成熟障礙、增殖、侵襲轉移、細胞永生化等惡性轉化過程。
IKCa1是鈣激活鉀通道家族中的重要成員之一,在調節細胞生理功能和細胞分子信號轉導通路中發揮重要作用。近年來研究證實,IKCa1參與多種惡性腫瘤發生發展過程。Haren等[7]發現,IKCa1在乳腺癌組織和乳腺癌細胞中高表達,與乳腺癌分期、分化程度及轉移密切相關。Zhang等[8]用TRAM-34阻斷IKCa1通道后抑制子宮內膜癌細胞遷移和侵襲。我們前期研究中不僅證實IKCa1通道在宮頸癌組織中高表達,與宮頸癌細胞增殖、細胞周期及凋亡有關[5],而且還證實miR-497-5p是IKCa1通道的靶基因,miR-497-5p可能通過下調IKCa1通道表達抑制HeLa細胞增殖[9]。IKCa1通道是否與宮頸癌HeLa細胞遷移、侵襲有關及其相關機制鮮見報道。
本研究結果顯示,IKCa1通道活性狀態與宮頸癌HeLa細胞遷移有關,且呈劑量-時間效應關系;當TRAM-34濃度達到30.0 μmol/L時,在24、48和72 h HeLa細胞的遷移能力出現抑制,差異有統計學意義。表明當TRAM-34處理濃度達到30.0 μmol/L時,細胞侵襲能力抑制效果最明顯。我們選擇TRAM-34 30 μmol/L、處理時間48 h作為高通量測序的處理條件,觀察IKCa1通道阻斷前后miRNAs表達譜變化。qRT-PCR驗證基本證實高通量測序的準確性。在IKCa1通道相關的差異表達miRNAs中,has-miR-143-3p和has-miR-421與腫瘤發生發展有關。Zhang 等[10]發現宮頸癌中miRNA-143低表達可增強HeLa細胞的侵襲、遷移和改變Vimentin和E-cadherin表達。Li 等[11]發現通過miR-421高表達下調腫瘤抑制因子而促進神經母細胞瘤的增殖和遷移。而本次實驗中發現阻斷IKCa1通道后has-miR-143-3p顯著上調,has-miR-421顯著下調,而對照組中則相反。推測miR-143-3p在宮頸癌發生發展中扮演抑癌基因,而miR-421則扮演癌基因角色。這些差異表達的miRNA與IKCa1通道活性狀態密切相關。
本研究進一步應用KEGG數據庫對miR-143-3p和miR-421靶基因信號通路進行富集分析。miR-143-5P靶基因在腫瘤蛋白多糖、癌癥相關通路、p53基因信號通路及MAPK信號通路上出現聚集;而miR-421靶基因在腫瘤蛋白多糖、Rap1信號通路和Wnt信號通路出現聚集。其中MAPK信號通路在細胞凋亡、增殖、基因表達調控和細胞質功能活動中發揮關鍵作用。Li等[12]發現低溫等離子可通過抑制MAPK通路及抑制MMP9表達來抑制宮頸癌HeLa細胞的侵襲。Lan等[13]現SRX通過激活Wnt/β-Catenin 信號通路促進宮頸癌細胞轉移。我們所篩選的miR-143-3p及miR-421在MAPK/Wnt信號通路中富集有統計學差異。本實驗中IKCa1通道阻斷后引起miR-143-3p明顯上調及miR-421明顯下調,推測miR-143-3p及miR-421可能參與IKCa1通道高表達引起宮頸癌HeLa細胞轉移和侵襲的一種或多種信號通路中,但其調控的確切靶基因及其生物學功能尚有待進一步研究證實。
綜上所述,IKCa1通道能促進HeLa細胞的遷移和侵襲,并改變細胞內miRNAs的表達譜。
[1] Zhang L, Xie F, Wang X, et al. Previous cervical cytology and high-risk human papillomavirus testing in a cohort of patients with invasive cervical carcinoma in Shandong Province, China[J]. PLoS One, 2017,12(6):e0180618.
[2] Lallet-Daher H, Roudbaraki M, Bavencoffe A, et al. Intermediate conductance Ca2+-activated K+channels ( ikca1) regulate human prostate cancer cell proliferation through a close control of calcium entry[J]. Oncogene, 2009,28(15):1792-1806.
[3] Yang XW, Liu JW, Zhang RC, et al. Inhibitory effects of blockage of intermediate conductance Ca2+-activated K+channels on prolif eration of hepatocellular carcinoma cells[J]. Huazhong Univ Sci Technolog Med Sci, 2013,33(1):86-89.
[4] Rabjerg M, Olivan-Viguera A, Hansen LK, et al. High expression of KCa3.1 in patients with clear cell renal carcinoma predicts high metastatic risk and poor survival[J]. PLoS One, 2015,10(4):0122992.
[5] Liu L, Zhan P, Nie D, et al. Intermediate-Conductance-Ca2-Activated K Channel IKCa1 Is Upregulated and Promotes Cell Proliferation in Cervical Cancer[J]. Med Sci Monit Basic Res, 2017,23:45-57.
[6] Calin GA, Sevignani C, Dumitru CD, et al. Human microRNA frequently located at fragile sites and genomic regions involved[J]. Proc Natl Acad Sci U S A, 2004,101(9):2999-3004.
[7] Abdullaev IF, Rudkouskaya A, Mongin AA, et al. Calci-um-activated potassium channels BK and IK1 are func-tionally expressed in human gliomas but do not regulatecell proliferation[J]. PLoS One, 2010,5(8):e12304.
[8] Zhang Y, Feng Y, Chen L, et al. Effects of intermediate-conductance Ca2+-activated K+channels on human endometrial carcinoma cells[J]. Cell Biochem Biophys, 2015,72(2):515-525.
[9] 張君,詹平,毛熙光等miR-497-5p對人宮頸癌細胞增殖的抑制作用及機制[J].山東醫藥,2017,57(5):15-18.
[10] Zhang L, Niyazi HE, Zhao HR, et al. Effects of miRNA-143 and the non-coding RNA MALAT1 on the pathogenesis and metastasis of HeLa cells[J]. Genet Mol Res, 2017,16(1):1-9.
[11] Li Y, Li W, Zhang JG, et al. Downregulation of tumor suppressor menin by miR-421 promotes proliferation and migration of neuroblastoma[J]. Tumour Biol, 2014,35(10):10011-10017.
[12] Li W, Yu KN, Bao L, et al. Non-thermal plasma inhibits human cervical cancer HeLa cells invasiveness by suppressing theMAPK pathway and decreasing matrix metalloproteinase-9 expression[J]. J Sci Rep, 2016,6:19720.
[13] Lan K, Zhao Y, Fan Y, et al. Sulfiredoxin May Promote Cervical Cancer Metastasis via Wnt/β-Catenin Signaling Pathway[J]. Int J Mol Sci, 2017,18(5):917.
EffectsofIKCa1channelsonmigration,invasion,andmiRNAexpressionprofileofhumancervicalcancerHeLacells
CHENGhui,GAOLanyang,ZHANPing,MAOXiguang
(TheAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China)
ObjectiveTo investigate the effects of IKCa1 channels on the migration, invasion, and miRNA expression profile of cervical cancer HeLa cells.MethodsHeLa cells in the logarithmic phase were randomly divided into the observation groups 1-5 and the DMSO group, which were then treated with 0, 10.0, 20.0, 30.0, and 40.0 umol/L TRAM-34 (a characteristic inhibitor of IKCa1 channel), and equal volume of DMSO (TRAM-34 solvent), respectively, for 24, 48 and 72 h. The migration characteristics of HeLa cells were detected by Scratch test. Transwell invasion assay was used to detect invasive properties. The miRNA expression profile of IKCa1 channel was detected by high-throughput sequencing, and some differentially expressed miRNAs were verified by qRT-PCR. The miRanda software was used to predict the target genes that could differentiate miRNAs and underwent signal pathway enrichment analysis.ResultsScratch test suggested that TRAM-34 inhibited the migration of HeLa cells, with a concentration- and time-dependent manner (Plt;0.001). Transwell invasion showed that the invasion rate of HeLa cells decreased with the increase of TRAM-34 concentrations (F=384.050,Plt;0.001). High-throughput sequencing revealed 15 differentially expressed and up-regulated miRNAs and 5 down-regulated miRNAs. The results of qRT-PCR showed that the differential expression of miRNAs was consistent with the sequencing results. Bioinformatics analysis showed that the target gene of hsa-miR-143-5p aggregated in the cancer-related pathways, p53 gene pathway, and MAPK signal pathway, while the target gene of hsa-miR-421 aggregated in the tumor proteoglycans, Rap1 signal pathway, and Wnt signaling pathway.ConclusionBlocking IKCa1 channel can inhibit the migration and invasion of HeLa cells and influence the miRNAs expression profile.
cervical neoplasms; HeLa cells; IKCa1 channel; migration; invasion; microRNA
10.3969/j.issn.1002-266X.2017.41.007
R737.33
A
1002-266X(2017)41-0024-04
四川省衛生廳科研課題(110373)。
程慧(1991-),女,碩士研究生,主要研究方向為婦科腫瘤。E-mail:1624590966@qq.com
2017-07-25)

