非小細(xì)胞肺癌組織中DNMT1表達(dá)和hMLH1、hMSH2甲基化狀態(tài)的變化及意義
劉俊,孫宇,王延寧,劉文洲,周華富
(1廣西醫(yī)科大學(xué)第一附屬醫(yī)院,南寧 530021;2廣西醫(yī)科大學(xué)第二附屬醫(yī)院)
非小細(xì)胞肺癌組織中DNMT1表達(dá)和hMLH1、hMSH2甲基化狀態(tài)的變化及意義
劉俊1,孫宇2,王延寧1,劉文洲2,周華富1
(1廣西醫(yī)科大學(xué)第一附屬醫(yī)院,南寧 530021;2廣西醫(yī)科大學(xué)第二附屬醫(yī)院)
目的探討非小細(xì)胞肺癌(NSCLC)癌及癌旁組織中DNMT1表達(dá)和hMLH1、hMSH2基因甲基化狀態(tài)的變化及意義。方法通過(guò)實(shí)時(shí)熒光定量PCR法檢測(cè)52例肺癌及癌旁組織中DNMT1表達(dá),同時(shí)用甲基化特異性PCR(MSP)法檢測(cè)hMLH1、hMSH2基因啟動(dòng)子區(qū)甲基化狀態(tài)。DNMT1表達(dá)與hMLH1、hMSH2啟動(dòng)子區(qū)甲基化水平相關(guān)性用Spearman相關(guān)分析。結(jié)果52例NSCLC患者癌及癌旁組織中DNMT1 mRNA相對(duì)表達(dá)量分別為3.162 3±0.512 5、2.873 1±0.370 6,Plt;0.01;癌及癌旁組織中hMLH1基因啟動(dòng)子區(qū)甲基化陽(yáng)性率分別為53.8%(28/52)、32.7%(17/52),差異有統(tǒng)計(jì)學(xué)意義(χ2=4.740,Plt;0.05);癌及癌旁組織中hMSH2基因啟動(dòng)子區(qū)甲基化陽(yáng)性率分別為57.7%(30/52)、34.6%(18/52),差異有統(tǒng)計(jì)學(xué)意義(χ2=5.571,Plt;0.05)。hMLH1、hMSH2啟動(dòng)子區(qū)甲基化水平與患者性別、年齡、腫瘤大小、病理學(xué)類型、淋巴結(jié)轉(zhuǎn)移、侵犯周圍組織等無(wú)關(guān)(P均gt;0.05)。DNMT1表達(dá)與hMLH1、hMSH2啟動(dòng)子區(qū)甲基化水平呈顯著正相關(guān)(r分別為0.479、0.528,P均lt;0.05)。結(jié)論NSCLC癌組織中DNMT1呈高表達(dá),DNMT1表達(dá)與hMLH1、hMSH2基因啟動(dòng)子區(qū)甲基化水平呈正相關(guān)性;三者表達(dá)與NSCLC患者臨床病理特征無(wú)關(guān)。
癌,非小細(xì)胞肺;DNA甲基化轉(zhuǎn)移酶1;hMLH1基因;hMSH2基因;甲基化
近年來(lái),肺癌發(fā)病率、病死率呈急劇上升趨勢(shì)[1],NSCLC的發(fā)生發(fā)展是多基因表達(dá)調(diào)控失衡的共同結(jié)果,研究認(rèn)為抑癌基因異常甲基化是其發(fā)展的重要因素,DNA甲基轉(zhuǎn)移酶(DNMT)具有胞嘧啶甲基轉(zhuǎn)移活性,可通過(guò)調(diào)節(jié)細(xì)胞內(nèi)甲基化過(guò)程而參與腫瘤的發(fā)生發(fā)展[2],其中DNMT1是催化基因甲基化的關(guān)鍵酶;而抑癌基因hMLH1、hMSH2對(duì)基因錯(cuò)配修復(fù)起重要作用。2016年9月,我們通過(guò)熒光定量PCR及甲基化特異性PCR(MSP)檢測(cè)DNMT1的表達(dá)和hMLH1、hMSH2基因啟動(dòng)子區(qū)甲基化狀態(tài),并進(jìn)一步探討其意義,從而為肺癌標(biāo)志物篩選及早期診斷提供幫助。
1 資料與方法
1.1 臨床資料 收集廣西醫(yī)科大學(xué)第一附屬醫(yī)院胸外科2015年11月~2016年6月接受手術(shù)切除且經(jīng)病理確診的52例非小細(xì)胞肺癌患者,男30例、女22例,年齡38~75(58.7±8.2)歲。癌組織取自手術(shù)切除腫塊中心非壞死組織,癌旁組織取自距腫塊邊緣至少5 cm處,組織離體后均于30 min內(nèi)置-80 ℃冰箱保存,患者術(shù)前均未行放化療且無(wú)其他部位腫瘤病史,均經(jīng)術(shù)后常規(guī)病理檢查。患者均簽署知情同意書。
1.2 DNMT1在肺癌及癌旁組織中的表達(dá)檢測(cè) 采用Real-time PCR法。總RNA提取:應(yīng)用TRIzol試劑從肺癌及癌旁組織中提取總RNA,提取的基因組RNA應(yīng)用紫外分光光度法測(cè)定RNA濃度和純度,隨后立即行反轉(zhuǎn)錄反應(yīng)。Real-time PCR:逆轉(zhuǎn)錄反應(yīng)采用Takara公司的PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time),按照試劑盒說(shuō)明書進(jìn)行操作,cDNA第一鏈合成后-20 ℃保存?zhèn)溆谩晒舛繒r(shí)取100 ng的cDNA行熒光定量PCR。同時(shí)在反應(yīng)體系中加入GAPDH引物作為內(nèi)參照。DNMT1正向引物:5′-TGGAGATCAAGCTTTGTATGTTGG-3′,反向引物:5′-CACATGTGAACGGACAGATTGAC-3′,擴(kuò)增產(chǎn)物長(zhǎng)度178 bp。GAPDH正向引物:5′-GCACCGTCAAGGCTG AGAAC-3′,反向引物:5′-TGGTGAAGACGCCAGTGGA-3′,擴(kuò)增產(chǎn)物長(zhǎng)度129 bp。反應(yīng)體系為20 μL,含有10 μL的SYBR?Premix Ex Taq Ⅱ (Tli RNaseH Plus) (2×)、0.8 μL的PCR Forward Primer(10 μmol/L)、0.8 μL的PCR Reverse Primer(10 μmol/L)、cDNA模板2 μL、0.4 μL的ROX Reference Dye Ⅱ(50×)、加ddH2O補(bǔ)齊至20 μL。PCR條件:預(yù)變性 95 ℃ 30 s;95 ℃ 3 s ,60 ℃ 34 s ,40個(gè)循環(huán);熔解曲線95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。DNMT1相對(duì)表達(dá)量用2-△△Ct表示。
1.3 hMLH1、hMSH2基因啟動(dòng)子區(qū)甲基化狀態(tài)檢測(cè) 采用MSP法。組織DNA提取:應(yīng)用天根生化科技有限公司組織基因組DNA提取試劑盒,按試劑盒說(shuō)明書進(jìn)行操作,提取的基因組DNA,應(yīng)用紫外分光光度法測(cè)定DNA濃度和純度,置于-80 ℃冰箱保存?zhèn)溆谩<谆禺愋訮CR:取1 μg DNA 行亞硫酸氫鹽修飾,-80 ℃保存,時(shí)間不超過(guò)1個(gè)月。參考相關(guān)文獻(xiàn)合成hMLH1、hMSH2基因甲基化和非甲基化引物,參照Herman等[3]的方法行MSP。hMLH1甲基化引物:正向引物:5′-ACGTAACGTTTTATTAGGGTCGC-3′,反向引物:5′-CCTCATCGTAACTACCCGCG-3′,擴(kuò)增產(chǎn)物長(zhǎng)度115 bp。hMLH1非甲基化引物:正向引物:5′-TTTTGATGTAGATGTTTTATTAGGGTTG-3′,反向引物:5′-ACCACCTCATCATAACTACCCACA-3′,擴(kuò)增產(chǎn)物長(zhǎng)度124 bp。hMSH2甲基化引物:正向引物:5′-TCGTGGTCGGACGTCGTTC-3′,反向引物:5′-CAACGTCTCCTTCGACTACACCG-3′,擴(kuò)增產(chǎn)物長(zhǎng)度132 bp。hMSH2非甲基化引物:正向引物:5′- GGTTGTTGTGGTTGGATGTTGTTT-3′,反向引物:5′-CAACTACAACATCTCCTTCAACTACACCA-3′,擴(kuò)增產(chǎn)物長(zhǎng)度143 bp。PCR反應(yīng)體系內(nèi)含MSP DNA Polymerase(2.5 U/μL) 1 U、dNTPs(2.5 mmol/L) 1.6 μL、10×MSP PCR Buffer 2 μL、正反向引物各 1 μL(10 μmol/L)和模板DNA 2 μL,以去離子水補(bǔ)足至20 μL。循環(huán)參數(shù):95 ℃ 5 min;94 ℃ 20 s,60 ℃ 30 s,72 ℃ 20 s,35個(gè)循環(huán);72 ℃ 5 min。每例標(biāo)本設(shè)3個(gè)復(fù)孔。以經(jīng)CpG甲基轉(zhuǎn)移酶處理后行亞硫酸氫鹽修飾的肺組織DNA作為甲基化陽(yáng)性對(duì)照,以經(jīng)亞硫酸氫鹽修飾的正常人肺組織DNA作為甲基化陰性對(duì)照,用水代替模板DNA作為空白對(duì)照。取9 μL MSP產(chǎn)物,加入1 μL 10×Loading Buffer,于含0.5 mg/L溴化乙錠的2.5%瓊脂糖凝膠上電泳,凝膠成像系統(tǒng)拍照觀察。如hMLH1基因啟動(dòng)子區(qū)的CpG島完全甲基化,則只有甲基化引物能擴(kuò)增出目的條帶;如完全未甲基化,則只有非甲基化引物能擴(kuò)增出目的條帶;如為部分甲基化,則兩對(duì)引物均能擴(kuò)增出目的條帶。部分甲基化歸為甲基化范疇。
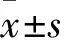
2 結(jié)果
2.1 DNMT1 mRNA在癌和癌旁組織中的表達(dá)比較 DNMT1基因擴(kuò)增曲線和溶解曲線表明Real-time PCR擴(kuò)增產(chǎn)物具有特異性。癌組織與癌旁組織中DNMT1 mRNA相對(duì)表達(dá)量分別為3.162 3±0.512 5、2.873 1±0.370 6,P=0.001;DNMT1 mRNA表達(dá)與患者性別、年齡、腫瘤大小、病理學(xué)類型、淋巴結(jié)轉(zhuǎn)移、侵犯周圍組織等臨床病理特征無(wú)關(guān)(P均gt;0.05)。
2.2 hMLH1、hMSH2基因啟動(dòng)子區(qū)甲基化狀態(tài) MSP結(jié)果顯示,52例非小細(xì)胞肺癌患者癌組織中28例(53.8%)hMLH1基因啟動(dòng)子區(qū)甲基化陽(yáng)性,30例(57.7%)hMSH2基因啟動(dòng)子區(qū)甲基化陽(yáng)性;癌旁組織中17例(32.7%)hMLH1基因啟動(dòng)子區(qū)甲基化陽(yáng)性,18例(34.6%)MSH2基因啟動(dòng)子區(qū)甲基化陽(yáng)性。癌組織與癌旁組織中hMLH1、hMSH2基因甲基化陽(yáng)性率差異有統(tǒng)計(jì)學(xué)意義(χ2=4.740,P=0.029;χ2=5.571,P=0.018)。17例(32.7%)癌組織中hMLH1、hMSH2基因啟動(dòng)子區(qū)同時(shí)發(fā)生甲基化,11例(21.2%)僅hMLH1基因發(fā)生甲基化,13例(25.0%)僅hMSH2基因發(fā)生甲基化,11例(21.2%)兩基因啟動(dòng)子區(qū)均未發(fā)生甲基化。癌組織中hMLH1、hMSH2基因甲基化陽(yáng)性率差異無(wú)統(tǒng)計(jì)學(xué)意義(χ2=0.227,P=0.779)。hMLH1、hMSH2啟動(dòng)子區(qū)甲基化水平與患者性別、年齡、腫瘤大小、病理學(xué)類型、淋巴結(jié)轉(zhuǎn)移、侵犯周圍組織等臨床病理特征無(wú)關(guān)(P均gt;0.05),見表1。
2.3 hMLH1、hMSH2啟動(dòng)子甲基化狀態(tài)與DNMT1表達(dá)的相關(guān)性 Spearman相關(guān)性分析結(jié)果顯示,DNMT1表達(dá)與hMLH1、hMSH2啟動(dòng)子區(qū)甲基化水平呈正相關(guān)(r分別為0.479、0.528,P均lt;0.05)。
3 討論
DNA甲基化為DNA復(fù)制后發(fā)生的共價(jià)修飾,指在DNA甲基化轉(zhuǎn)移酶的催化下將甲基轉(zhuǎn)移給胞嘧啶5′端的碳原子,形成甲基化的胞嘧啶[4],從而阻礙轉(zhuǎn)錄因子與啟動(dòng)子結(jié)合,抑制轉(zhuǎn)錄[5]。目前發(fā)現(xiàn)的DNA甲基化轉(zhuǎn)移酶主要有DNMT1、DNMT2、DNMT3a/3b三類,其中DNMT1在DNA復(fù)制、修復(fù)并維持其正常甲基化中起重要作用。DNMT1表達(dá)增高可使甲基化模式發(fā)生異常,引起抑癌基因沉默、原癌基因激活從而導(dǎo)致腫瘤發(fā)生[6]。Lin等[7]研究表明DNMT1蛋白表達(dá)增高與多種腫瘤組織中抑癌基因啟動(dòng)子區(qū)的高甲基化密切相關(guān)。Tang 等[8]報(bào)道肺癌中經(jīng)常出現(xiàn)CDH1、p16、p53、PTEN、RB、APC[9]等多種抑癌基因的甲基化和失活。

表1 hMLH1、hMSH2基因甲基化狀態(tài)與非小細(xì)胞肺癌患者臨床病理特征的關(guān)系[例(%)]
hMLH1、hMSH2是DNA錯(cuò)配修復(fù)系統(tǒng)(MMR)中的重要成員,擔(dān)負(fù)著對(duì)錯(cuò)配位點(diǎn)的識(shí)別和切除功能,除了有防止自發(fā)突變的堆積,還具有維持DNA高保真度復(fù)制的作用。hMLH1、hMSH2作為重要的抑癌基因,其失活或低表達(dá)可能引起機(jī)體MMR系統(tǒng)功能降低,導(dǎo)致體內(nèi)癌基因和抑癌基因在復(fù)制過(guò)程中發(fā)生突變,進(jìn)而引起腫瘤發(fā)生發(fā)展。大量研究發(fā)現(xiàn),hMLH1、hMSH2不僅與遺傳性非息肉性直腸癌發(fā)病有關(guān),還與胃癌、直腸癌、宮頸癌等其他腫瘤的發(fā)生發(fā)展有密切關(guān)系。Xinarianos 等[10]對(duì)147例肺癌組織進(jìn)行免疫組化檢測(cè)發(fā)現(xiàn)85例(57.8%)hMSH2低表達(dá),88例(58.6%)hMLH1低表達(dá)。
本研究發(fā)現(xiàn)DNMT1 mRNA在52例NSCLC癌組織中的表達(dá)高于癌旁組織,與Zhou 等[11]研究結(jié)果相似,說(shuō)明DNMT1在肺癌組織中呈過(guò)表達(dá),是肺癌發(fā)生發(fā)展過(guò)程中的重要因素。DNMT1表達(dá)與肺癌組織學(xué)類型、腫瘤大小、分化程度、淋巴結(jié)轉(zhuǎn)移及侵犯周圍組織等臨床病理特征無(wú)關(guān),與劉樹立等[12]研究結(jié)果有差異,可能由于DNMT1在轉(zhuǎn)錄和翻譯過(guò)程中存在其他基因或通路影響其蛋白表達(dá),如MGMT、HDAC等。MSP檢測(cè)結(jié)果顯示,癌組織中hMLH1、hMSH2基因啟動(dòng)子區(qū)甲基化陽(yáng)性率均明顯高于相應(yīng)癌旁組織,差異有統(tǒng)計(jì)學(xué)意義,與Wang等[13]研究結(jié)果一致,表明NSCLC中錯(cuò)配修復(fù)基因hMLH1、hMSH2啟動(dòng)子區(qū)甲基化水平升高,基因失活無(wú)法進(jìn)行翻譯以致肺癌的發(fā)生。相關(guān)分析發(fā)現(xiàn),DNMT1表達(dá)與hMLH1、hMSH2啟動(dòng)子區(qū)甲基化水平呈正相關(guān),表明DNMT1可能通過(guò)甲基化機(jī)制來(lái)調(diào)控抑癌基因hMLH1、hMSH2啟動(dòng)子區(qū)甲基化,從而引起hMLH1、hMSH2基因的沉默和失活,進(jìn)一步降低其翻譯和表達(dá)。Qi 等[14]研究發(fā)現(xiàn)膀胱癌組織中DBCCR1低表達(dá)與DNMT1高表達(dá)間存在相關(guān)性,DBCCR1通過(guò)DNMT1介導(dǎo)的DBCCR1啟動(dòng)子區(qū)甲基化而被直接抑制。Moghbeli 等[15]研究發(fā)現(xiàn)51例胃癌患者(25.5%)中13例在hMLH1啟動(dòng)子序列中表現(xiàn)出高甲基化,甲基化狀態(tài)與腫瘤的分期顯著相關(guān)。
綜上所述,在NSCLC中抑癌基因hMLH1、hMSH2存在過(guò)甲基化現(xiàn)象,而DNMT1作為重要的甲基化轉(zhuǎn)移酶在其中發(fā)揮重要作用,是導(dǎo)致其過(guò)甲基化的重要原因。本研究提示DNMT1表達(dá)及hMLH1、hMSH2甲基化檢測(cè)可能對(duì)肺癌標(biāo)志物的篩選及早期診斷提供幫助,但三者表達(dá)與NSCLC患者臨床病理特征無(wú)關(guān)。本研究存在局限性,僅檢測(cè)DNMT1的mRNA轉(zhuǎn)錄水平和hMLH1、hMSH2的甲基化水平,后續(xù)本課題組將擴(kuò)大樣本量,并進(jìn)一步對(duì)其蛋白表達(dá)進(jìn)行檢測(cè)。
[1] Herbst RS, Heymach JV, Lippman SM. Lung cancer[J]. N Engl J Med, 2008,359(13):1367-1380.
[2] Chen C, Yin N, Yin B, et al. DNA methylation in thoracic neoplasms[J]. Cancer Lett, 2011,301(1):7-16.
[3] Herman JG, Graff JR, Myohanen S, et al. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands[J]. Proc Natl Acad Sci U S A, 1996,93(18):9821-9826.
[4] Issa JP. Epigenetic variation and human disease[J]. J Nutr, 2002,132(8 Suppl):2388S-2392S.
[5] Jones PA, Takai D. The role of DNA methylation in mammalian epigenetics[J]. Science, 2001,293(5532):1068-1070.
[6] Dhe-Paganon S, Syeda F, Park L. DNA methyl transferase 1: regulatory mechanisms and implications in health and disease[J]. Int J Biochem Mol Biol, 2011,2(1):58-66.
[7] Lin RK, Hsu HS, Chang JW, et al. Alteration of DNA methyltransferases contributes to 5'CpG methylation and poor prognosis in lung cancer[J]. Lung Cancer, 2007,55(2):205-213.
[8] Tang M, Xu W, Wang Q, et al. Potential of DNMT and its Epigenetic Regulation for Lung Cancer Therapy[J]. Curr Genomics, 2009,10(5):336-352.
[9] Tsou JA, Shen LY, Siegmund KD, et al. Distinct DNA methylation profiles in malignant mesothelioma, lung adenocarcinoma, and non-tumor lung[J]. Lung Cancer, 2005,47(2):193-204.
[10] Xinarianos G, Liloglou T, Prime W, et al. hMLH1 and hMSH2 expression correlates with allelic imbalance on chromosome 3p in non-small cell lung carcinomas[J]. Cancer Res, 2000,60(15):4216-4221.
[11] Zhou G, Ye J, Fang Y, et al. Identification of DBCCR1 as a suppressor in the development of lung cancer that is associated with increased DNA methyltransferase 1[J]. Oncotarget, 2017,8(20):32821-32832.
[12] 劉樹立,徐洪濤,李慶昌,等.肺癌組織Axin與DNMT1表達(dá)及其生物學(xué)意義的探討[J].中華腫瘤防治雜志,2011,18(9):676-679.
[13] Wang YC, Lu YP, Tseng RC, et al. Inactivation of hMLH1 and hMSH2 by promoter methylation in primary non-small cell lung tumors and matched sputum samples[J]. J Clin Invest, 2003,111(6):887-895.
[14] Qi D, Li J, Que B, et al. Long non-coding RNA DBCCR1-003 regulate the expression of DBCCR1 via DNMT1 in bladder cancer[J]. Cancer Cell Int, 2016,16(1):81.
[15] Moghbeli M, Moaven O, Memar B, et al. Role of hMLH1 and E-cadherin promoter methylation in gastric cancer progression[J]. J Gastrointest Cancer, 2014,45(1):40-47.
ExpressionofDNMT1andthemethylationstatusofhMLH1andhMSH2innon-small-celllungcancer
LIUJun1,SUNYu,WANGYanning,LIUWenzhou,ZHOUHuafu
(1TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
ObjectiveTo investigate the DNA methyltransferase 1 (DNMT1) expression and the changes in the methylation status of hMLH1 and hMSH2 genes in the tumor tissues and adjacent tissue specimens of non-small-cell lung cancer (NSCLC).MethodsThe expression of DNMT1 in 52 lung cancer specimens and adjacent tissue specimens was detected by real-time fluorescent quantitative PCR (FQ-PCR). Meanwhile, promoter methylation status of hMLH1 and hMSH2 was detected by methylation-specific PCR (MSP). Correlation of DNMT1 expression with methylation of hMLH1 and hMSH2 genes was analyzed by Spearman correlation analysis.ResultsThe expression of DNMT1 mRNA in 52 cases of NSCLC specimens and adjacent tissue specimens was 3.162 3±0.512 5 and 2.873 1±0.370 6 (Plt;0.001). The positive rate of promoter methylation of hMLH1 in the lung cancer specimens was higher than that in the adjacent tissue specimens [53.8%(28/52) vs. 32.7% (17/52),χ2=4.740,Plt;0.05]. The positive rate of promoter methylation of hMSH2 in the cancer specimens was higher than that in the adjacent tissue specimens [57.7%(30/52) vs. 34.6%(18/52),χ2=5.571,Plt;0.05]. Methylation status of hMLH1 and hMSH2 was not correlated with the patients' gender, age, tumor size, pathological types, lymph node metastasis, and invasion of surrounding tissues (allPgt;0.05). The expression of DNMT1 was positively correlated with the methylation level of hMLH1 and hMSH2 (r=0.479, 0.528, allPlt;0.05).ConclusionDNMT1 is highly expressed in the NSCLC tissues and the DNMT1expression is positively correlated with the promoter methylation levels of hMLH1 and hMSH2 genes, and the expression of these three parameters is not correlated with the clinicopathological features of NSCLC.
non-small-cell lung cancer; DNA methyltransferase 1; hMLH1gene; hMSH2 gene; methylation
10.3969/j.issn.1002-266X.2017.41.006
R734.2
A
1002-266X(2017)41-0020-04
廣西科學(xué)研究與技術(shù)開發(fā)計(jì)劃項(xiàng)目(桂科攻14124004-1-4)。
劉俊(1991-),男,碩士,主要研究方向?yàn)榉伟┌l(fā)病機(jī)制及早期診斷的研究。E-mail:472210765@qq.com
周華富(1964-),男,博士,主任醫(yī)師,主要研究方向?yàn)榉伟┌l(fā)病機(jī)制及早期診斷的研究。E-mail:zhouhuafudr@sina.com
2017-08-10)

