乙型肝炎病毒X蛋白A1762T/G1764A雙突變對肝癌細胞生物鐘基因表達的影響
彭樺,占靜,張乙凡,孫飛,邱夢君,楊盛力
(1華中科技大學同濟醫學院附屬梨園醫院,武漢430077;2華中科技大學同濟醫學院附屬協和醫院;3貴州醫科大學附屬醫院)
·論著·
乙型肝炎病毒X蛋白A1762T/G1764A雙突變對肝癌細胞生物鐘基因表達的影響
彭樺1,占靜2,張乙凡3,孫飛2,邱夢君2,楊盛力2
(1華中科技大學同濟醫學院附屬梨園醫院,武漢430077;2華中科技大學同濟醫學院附屬協和醫院;3貴州醫科大學附屬醫院)
目的研究乙型肝炎病毒X蛋白(HBx)A1762T/G1764A雙突變對肝癌細胞生物鐘基因表達的影響。方法將Bel-7404細胞接種于6孔板中,待細胞生長至60%融合時按照Lipofectamine2000的說明書分別將1.0 μg的pcDNA3.1-HBx和pcDNA3.1-mHBx(A1762T/G1764A雙突變)質粒轉染肝癌細胞系Bel-7404細胞。采用Real-time PCR和Western blotting法檢測Bel-7404細胞中CLOCK、BMAL1、Per1、Per2、Per3、Cry1、Cry2、CKIε mRNA及蛋白表達。結果與轉染pcDNA3.1-HBx相比,轉染A1762T/G1764A雙突變的pcDNA3.1-mHBx表達載體后Bel-7404細胞中Clock、Bmal1、Per2、Per3、Cry1、Cry2 mRNA和蛋白表達均降低(P均lt;0.05)。結論HBx A1762T/G1764A雙突變可引起肝癌細胞生物鐘基因表達紊亂。
肝腫瘤;乙型肝炎病毒X蛋白;突變;生物鐘;鐘控基因
乙型肝炎病毒X蛋白(HBx)是乙型肝炎病毒(HBV)X基因編碼的一種多功能蛋白,具有生長因子樣作用,可直接刺激細胞生長,并可通過影響正常細胞的細胞周期、干擾DNA修復、調節細胞增殖和凋亡、誘導細胞化療耐藥等,對肝癌的發生發展起重要的推動作用[1~3]。研究發現,HBx在肝癌細胞中常以突變體形式存在,突變后的HBx通常在生物學功能上亦發生變化。A1762T/G1764A雙突變是HBx常見的突變方式之一[4]。我們前期研究結果證實,36.5%(36/101)的肝癌組織中存在A1762T/G1764A雙突變,且出現雙突變的患者預后較差[5]。近年來研究顯示生物鐘基因表達異常可能是腫瘤發生發展的原因之一[6~8]。肝癌組織中普遍存在生物鐘基因表達異常,我們前期研究顯示野生型HBx和缺氧微環境同肝癌生物鐘基因表達異常密切相關[9,10]。2016年8月,我們探討了HBx A1762T/G1764A雙突變對肝癌細胞生物鐘基因表達的影響。現報告如下。
1 材料與方法
1.1 材料 兔抗人Clock多克隆抗體、兔抗人Bmal1多克隆抗體、鼠抗人Cry1單克隆抗體和兔抗人Cry2多克隆抗體購于Abcam公司。鼠抗人Per1、Per2和Per3多克隆抗體購于Novus公司。鼠抗人HBx單克隆抗體和鼠抗人β-actin單克隆抗體購自Santa Cruz公司。細胞轉染試劑Lipofectamine2000,RNA提取試劑TRIzol和PCR試劑SYBR?Green PCR Master Mix購于Life公司。PCR引物合成由Life公司完成;胎牛血清由Hyclone公司提供。HBx A1762T/G1764A雙突變表達載體和肝癌細胞系Bel-7404細胞株由香港中文大學威爾斯親王醫院陳功教授饋贈[11]。
1.2 Bel-7404細胞的質粒轉染 將Bel-7404細胞接種于6孔板中,待細胞生長至60%融合時按照Lipofectamine2000的說明書分別將1.0 μg的pcDNA3.1-HBx和pcDNA3.1-mHBx(A1762T/G1764A雙突變)質粒轉染Bel-7404細胞。48 h后分別提取RNA和總蛋白進行后續檢測。
1.3 肝癌細胞生物鐘基因mRNA表達檢測 采用Real-time PCR技術。根據TRIzol的使用說明提取細胞總RNA,測定RNA純度和濃度,取mRNA 1 μg逆轉錄為cDNA。根據SYBR?Green PCR Master Mix(2×)的操作說明書進行定量PCR,每個樣本設3個復孔。總反應體系為20 μL:sybrGreen Mix 10 μL,cDNA模板1.5 μL,10 μmol/L的正向和反向引物各1 μL,ddH2O 6.5 μL。Per1引物:正向引物:5′-AGGCAACGGCAAGGACTC-3′,反向引物:5′-GGCTGTAGGCAATGGAACTG-3′,產物大小101 bp;Per2引物:正向引物:5′-CTACAGCAGCACCATCGTC-3′,反向引物:5′-CCACTCGCAGCATCTTCC-3′,產物大小78 bp;Per3引物:正向引物:5′-TGGTGGTGGTGAATGTAAGAC-3′,反向引物:5′-GGCTGTGCTCATCGTTCC-3′,產物大小104 bp;Cry1引物:正向引物:5′-CAACCTCCATTCATCTTTCC-3′,反向引物:5′-CTCATAGCCGACACCTTC-3′,產物大小151 bp;Cry2引物:正向引物:5′-TGGGCTTCTGGGACTGAG-3′,反向引物:5′- GGTAGGTGTGCTGTCTTAGG-3′,產物大小136 bp;Clock引物:正向引物:5′-GCAGCAGCAGCAGCAGAG-3′,反向引物:5′-CAGCAGAGAGAATGAGTTGAGTTG-3′,產物大小149 bp;Bmal1引物:正向引物:5′-TGCCACCAATCCATACACAGAAG-3′,反向引物:5′-TTCCCTCGGTCACATCCTACG-3′,產物大小123 bp;β-actin引物:正向引物:5′-AGTTGCGTTACACCCTTTCTTGAC-3′,反向引物:5′-GCTCGCTCCAACCGACTGC-3′,產物大小171 bp;HBx引物:正向引物:5′-CGTCCTTTGTTTACGTCCC-3′,反向引物:5′-CAATTTATGCCTACAGCCTCC-3′,產物大小382 bp。
1.4 肝癌細胞生物鐘基因蛋白表達檢測 采用Western blotting法。蛋白定量后通過10%的聚丙烯酰胺凝膠電泳轉移至聚偏二氟乙烯(PVDF)膜上。分別加入兔抗人Clock多克隆抗體、兔抗人Bmal1多克隆抗體、鼠抗人Cry1單克隆抗體和兔抗人Cry2多克隆抗體、鼠抗人Per1、Per2和Per3多克隆抗體,均1∶500稀釋;鼠抗人HBx單克隆抗體1∶250稀釋;鼠抗人β-actin單克隆抗體1∶1 000稀釋。加入HRP標記的羊抗兔二抗、兔抗鼠二抗,1∶2 000稀釋。化學發光法顯色,計算機掃描蛋白質條帶后進行灰度分析。將β肌動蛋白(β-actin)作內參照,分別用生物鐘基因蛋白/β-actin值代表該生物鐘基因蛋白的相對表達量,每個樣本重復3次。
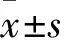
2 結果
2.1 Bel-7404細胞中HBx mRNA和蛋白表達 轉染野生型HBx及A1762T/G1764A雙突變型HBx的Bel-7404細胞中均可檢測到HBx mRNA表達,相對表達量分別為0.41±0.04、0.43±0.05,兩者比較,Pgt;0.05;Western blotting檢測結果顯示,轉染野生型HBx及A1762T/G1764A雙突變型HBx的Bel-7404細胞中均可檢測到HBx 蛋白表達,相對表達量分別為0.38±0.08和0.41±0.06,兩者比較,Pgt;0.05。
2.2 轉染前后肝癌細胞生物鐘基因 mRNA表達變化 Real-time PCR結果顯示,Clock、Bmal1、Per2、Per3、Cry1、Cry2 mRNA在轉染野生型HBx的Bel-7404細胞中相對表達量分別為1.01±0.01、0.99±0.02、1.01±0.02、1.02±0.02、0.98±0.01、1.00±0.02、0.99±0.01;Clock、Bmal1、Per1、Per2、Per3、Cry1、Cry2 mRNA在轉染A1762T/G1764A雙突變HBx的Bel-7404細胞中相對表達量分別為0.83±0.02、0.79±0.03、0.98±0.04、0.47±0.03、0.41±0.01、0.86±0.02、0.90±0.02。與轉染野生型HBx相比,轉染A1762T/G1764A雙突變HBx表達載體后Bel-7404細胞中Clock、Bmal1、Per2、Per3、Cry1、Cry2 mRNA表達降低,差異均有統計學意義(P均lt;0.05);而Per1基因表達差異無統計學意義(Pgt;0.05)。
2.3 轉染前后肝癌細胞生物鐘基因蛋白表達變化 Western blotting檢測結果顯示,Clock、Bmal1、Per2、Per3、Cry1、Cry2蛋白在轉染野生型HBx的Bel-7404細胞中相對表達量分別為0.99±0.03、0.97±0.05、1.02±0.04、1.05±0.04、0.98±0.06、1.01±0.03、0.99±0.05;Clock、Bmal1、Per1、Per2、Per3、Cry1、Cry2蛋白在轉染A1762T/G1764A雙突變HBx的Bel-7404細胞中相對表達量分別為0.76±0.08、0.63±0.07、0.94±0.12、0.31±0.05、0.33±0.06、0.80±0.09、0.89±0.05。與轉染野生型HBx相比,轉染A1762T/G1764A雙突變的HBx表達載體后Bel-7404細胞中Clock、Bmal1、Per2、Per3、Cry1、Cry2蛋白表達降低,差異均有統計學意義(P均lt;0.05);Per1蛋白表達差異無統計學意義(Pgt;0.05)。
3 討論
生物鐘是細胞內潛在的生物節律,在分子水平上由Per1、Per2、Per3、CLOCK、BMAL1、Cry1、Cry2等多個生物鐘基因精密調控。細胞內生物鐘基因表達異常可引起其下游的鐘控基因表達紊亂。人類基因組中約有40%的mRNA表達具有生物節律性,受生物鐘基因調控[12]。這些受生物鐘調控的基因包括與細胞增殖和凋亡密切相關的癌基因(c-myc),抑癌基因(p53,p21)和細胞周期有關的關鍵調控因子(Cyclin A,Cyclin B1,Cyclin D1,Wee1),還包括與細胞侵襲轉移相關的基因,如血管生成相關基因(血管內皮生長因子)和轉移相關基因[13]。這些鐘控基因的表達異常可引起細胞增殖、凋亡、侵襲轉移等生物學行為發生變化。
HBV感染是肝癌發生發展的常見病因之一。HBV引起肝癌發生發展的確切機制目前尚不清楚,但普遍認為由X基因編碼合成的HBx在肝癌發生發展過程中發揮重要作用。HBx可抑制p53表達和c-myc、Ras等癌基因表達,還可通過甲基化修飾使得細胞周期負調控因子p16INK4A和鈣黏蛋白E-cadherin表達減少,進而促進肝細胞的惡性轉化[1~3]。我們前期研究發現肝癌組織的基因組中普遍存在HBx基因突變,其中HBV基本核心區啟動子(BCP)A1762T/G1764A 雙突變發生率為36.5%(36/101)[5]。A1762T/G1764A雙突變是肝細胞癌發生的危險因素之一。研究顯示A1762T/G1764A雙位點突變導致130密碼子(AAG)和131密碼子(GTC)分別出現ATG和ATC突變,突變位置出現在與p53結合及同反式激活功能密切相關的區域(132~139密碼子)相鄰部位,使得HBx的反式激活功能明顯增強,引起一系列癌基因的激活和抑癌基因的失活,最終導致肝癌的發生發展[4]。我們前期研究顯示A1762T/G1764A雙突變和肝癌預后密切相關,A1762T/G1764A雙突變的患者較易出現復發和轉移[5]。
本研究將HBx A1762T/G1764A雙突變表達載體轉染肝癌細胞,發現生物鐘基因除Per1表達無明顯變化外,Per2、Per3、CLOCK、BMAL1、Cry1和Cry2均表達下調。Lin等[14]研究發現,Per1、Per2、Per3、Cry2和Tim在肝癌組織中表達降低。我們前期研究發現Per1、Per2、Per3和Cry2在肝癌組織中的表達低于癌旁組織中[10]。HBx A1762T/G1764A雙突變引起的Per2、Per3、Cry2變化趨勢同其在肝癌組織中的表達狀態一致。因此HBx A1762T/G1764A雙突變可能是引起肝癌細胞生物鐘基因表達異常的諸多原因之一。
研究顯示,Per2和Per3除參與生物鐘調控外,還能抑制腫瘤細胞的生長和增殖,誘導細胞凋亡,在腫瘤組織中普遍呈低表達狀態,被認為是潛在的抑癌基因[8,15]。HBx A1762T/G1764A雙突變引起其表達下調,一定程度上可能促進了肝癌的發生發展。細胞的失序性和失控性生長是惡性腫瘤的特征之一。HBx A1762T/G1764A雙突變引起肝癌細胞生物鐘表達紊亂,進而可能引起下游與細胞增殖、凋亡、侵襲轉移相關的鐘控基因表達紊亂,從而誘導肝癌發生及促進復發和轉移。
[1] Zhang B, Han S, Feng B, et al. Hepatitis B virus X protein-mediated non-coding RNA aberrations in the development of human hepatocellular carcinoma[J]. Exp Mol Med, 2017,49(2):e293.
[2] Wang M, Xi D, Ning Q. Virus-induced hepatocellular carcinoma with special emphasis on HBV[J]. Hepatol Int, 2017,11(2):171-180.
[3] Geng M, Xin X, Bi LQ, et al. Molecular mechanism of hepatitis B virus X protein function in hepatocarcinogenesis[J]. World J Gastroenterol, 2015,21(38):10732-10738.
[4] Yang Z, Zhuang L, Lu Y, et al. Naturally occurring basal core promoter A1762T/G1764A dual mutations increase the risk of HBV-related hepatocellular carcinoma: a meta-analysis[J]. Oncotarget, 2016,7(11):12525-12536.
[5] Yang SL, Liu LP, Sun YF, et al. Distinguished prognosis after hepatectomy of HBV-related hepatocellular carcinoma with or without cirrhosis: a long-term follow-up analysis[J]. J Gastroenterol, 2016,51(7):722-732.
[6] Kiberstis PA. Poor clock management and cancer[J]. Science, 2016,354(6318):1388-1389.
[7] Li W, Liu L, Liu D, et al. Decreased circadian component Bmal1 predicts tumor progression and poor prognosis in human pancreatic ductal adenocarcinoma[J]. Biochem Biophys Res Commun, 2016,472(1):156-162.
[8] Mteyrek A, Filipski E, Guettier C, et al. Clock gene Per2 as a controller of liver carcinogenesis[J]. Oncotarget, 2016,7(52):85832-85847.
[9] Yu C, Yang SL, Fang X, et al. Hypoxia disrupts the expression levels of circadian rhythm genes in hepatocellular carcinoma[J]. Mol Med Rep, 2015,11(5):4002-4008.
[10] Yang SL, Yu C, Jiang JX, et al. Hepatitis B virus X protein disrupts the balance of the expression of circadian rhythm genes in hepatocellular carcinoma[J]. Oncol Lett, 2014,8(6):2715-2720.
[11] Liu LP, Hu BG, Ye C, et al. HBx mutants differentially affect the activation of hypoxia-inducible factor-1α in hepatocellular carcinoma[J]. Br J Cancer, 2014,110(4):1066-1073.
[12] Huisman SA, Ahmadi AR, IJzermans JN, et al. Disruption of clock gene expression in human colorectal liver metastases[J]. Tumour Biol, 2016,37(10):13973-13981.
[13] Li DQ, Pakala SB, Reddy SD, et al. Metastasis-associated protein 1 is an integral component of the circadian molecular machinery[J]. Nat Commun, 2013,4(1):2545.
[14] Lin YM, Chang JH, Yeh KT, et al. Disturbance of circadian gene expression in hepatocellular carcinoma[J]. Mol Carcinog, 2008,47(12):925-933.
[15] Zhao Q, Zheng G, Yang K, et al. The clock gene PER1 plays an important role in regulating the clock gene network in human oral squamous cell carcinoma cells[J]. Oncotarget, 2016,7(43):70290-70302.
EffectsofhepatitisBvirusXproteinA1762T/G1764Adoublemutationonexpressionofclockgeneinlivercancercells
PENGHua1,ZHANJing,ZHANGYifan,SUNFei,QIUMengjun,YANGShengli
(1LiyuanHospitalofTongjiMedicalCollegeofHuazhongUniversityofScienceandTechnologyWuhan430077,China)
ObjectiveTo investigate the effects of hepatitis B virus X protein A1762T/G1764A double mutation on the expression of clock gene in the hepatocellular carcinoma (HCC) cells.MethodsBel-7404 cells were inoculated into into 6-hole plate, when the cells grew to 60% confluence, they were transfected with 1.0 μg pcDNA3.1-HBx and pcDNA3.1-mHBx (A1762T/G1764A double mutant) plasmids by using Lipofectamine 2000 according to the manufacturer's instructions. The mRNA and protein expression levels of the CLOCK, BMAL1, Per1, Per2, Per3, Cry1, Cry2, and CKIε genes in the Bel-7404 cells were detected by real-time PCR and Western blotting.ResultsThe mRNA and protein expression of Clock, Bmal1, Per2, Per3, Cry1 and Cry2 decreased in Bel-7404 cells transfected with A1762T/G1764A double mutant HBx vectors as compared with that of cells transfected with pcDNA3.1-HBx vectors, and the differences were statistically significant (allPlt;0.05).ConclusionsHBx A1762T/G1764A double mutation can cause the disorder of biological clock expression in HCC cells.
liver neoplasms; hepatitis B virus X protein; mutation; circadian clock; clock controlled gene
10.3969/j.issn.1002-266X.2017.41.001
R735.7
A
1002-266X(2017)41-0001-04
國家自然科學基金資助項目(81702885);中央高校基本科研業務費專項資金項目(0118530328):華中科技大學自主創新基金項目(2016YXM241);中國肝炎防治基金會-天晴肝病研究基金科研課題(TQGB20170005);中國博士后科學基金資助項目(2017M613001)。
彭樺(1981-),男,主治醫師,主要研究方向為腹部腫瘤的診斷及治療。E-mail:2300836708@qq.com
楊盛力(1982-),男,主治醫師,博士后,主要研究方向為肝癌的診斷及治療。E-mail:yangshengli2014@yahoo.com
2017-07-16)

