波形蛋白在原發性肝癌組織中的表達及臨床意義
成 超,李海洋△,葉朝陽,李國煒
(貴州醫科大學附屬醫院:1.肝膽外科;2.臨床醫學研究中心,貴陽 550004)
·經驗交流·
波形蛋白在原發性肝癌組織中的表達及臨床意義
成 超1,李海洋1△,葉朝陽2,李國煒1
(貴州醫科大學附屬醫院:1.肝膽外科;2.臨床醫學研究中心,貴陽 550004)
目的探討原發性肝癌(HCC)組織與癌旁組織中波形蛋白的表達及其臨床意義。方法收集該院2015年1月至2016年3月30例手術切除的肝癌組織,離癌2~5 cm(簡稱癌旁近臨)和離癌5 cm以外(簡稱癌旁近遠)組織及患者臨床資料。運用實時熒光定量PCR和免疫組織化學檢測組織中波形蛋白表達,并用Image J軟件及病理評分等對其表達量進行分析。結果癌組織、癌旁組織、正常肝組織標本里波形蛋白的mRNA分別為8.97±4.19、2.14±1.12和1.00±0.00,差異有統計學意義(Plt;0.05)。癌組織、癌旁近臨和癌旁近遠組織標本里波形蛋白表達量分別為75.22±16.87、41.72±6.19和36.26±4.71,差異有統計學意義(Plt;0.05)。波形蛋白表達與患者年齡、性別、腫瘤大小和腫瘤范圍無關(Pgt;0.05),與TNM分期、病理分級、淋巴結轉移、遠處轉移有關(Plt;0.05)。結論檢測HCC患者的波形蛋白表達有助于HCC診斷與預后。
原發性肝癌;波形蛋白;免疫組織化學;實時熒光定量PCR;基因表達
原發性肝癌(HCC)是發病率高、治療困難、病死率高的惡性腫瘤之一,全球每年大約有250 000例患者死于HCC,因此受到全球臨床醫生和研究者的特別關注,如何早期診斷成為肝癌研究熱點之一。正常分化上皮細胞不表達波形蛋白,而波形蛋白通常分布在中胚層來源的間質細胞中,如成纖維細胞、內皮細胞等。大量研究表明,上皮源性腫瘤細胞異常表達波形蛋白,如乳腺癌、胃癌、食管癌、結腸癌、肺癌和前列腺癌等[1],即表現出上皮細胞間充質轉化(EMT)的病理特征,體現為上皮樣功能減弱或消失而間質功能增強,并與上皮細胞纖維化及惡性腫瘤癌細胞的侵襲轉移密切相關[2]。波形蛋白是一種在間質中表達的Ⅲ型中間絲蛋白,在細胞分裂的時候對染色體起支架的作用,并承擔細胞中細胞器的分配和定位[3]。近年研究表明,波形蛋白參與腫瘤的發生和轉移過程,在腫瘤細胞遷移、黏附及凋亡中均發揮重要作用,曾作為間葉組織起源腫瘤的特異性標記[4]。據了解,目前國內研究有關波形蛋白在肝癌細胞中的表達狀況報道還較少。本項目用實時熒光定量PCR和免疫組織化學等技術檢測波形蛋白在HCC組織、癌旁近臨組織和癌旁近遠組織標本中的表達狀況,結合病理特征分析其臨床肝癌診斷意義。
1 資料與方法
1.1一般資料 收集本院肝膽外科2015年1月至2016年3月30例手術切除的肝癌組織,離癌2~5 cm(簡稱癌旁近臨)和離癌5 cm以外(簡稱癌旁近遠)的組織。其中男24例,女6例,平均年齡(52.2±7.1)歲。所有病例術前未行放療、化療,所有標本均經病理科檢查證實。標本采集后冰塊包被,在15 min內放置于-80 ℃冰箱保存。本次研究得到患者的知情同意并經本院醫學倫理委員會批準[2014倫審第(83)號]。
1.2方法
1.2.1實時熒光定量PCR檢測 實時熒光定量PCR引物(上海捷瑞生物工程有限公司),引物序列及產物長度見表1。分別取肝癌、癌旁及正常肝組織各100 mg,研磨后轉入1.5 mL微量離心管中。按照Trizol RMA試劑說明書進行操作。取2 μL RNA樣品,紫外線分光光度儀Nanodrop2000上測定樣品在260 nm和280 nm處吸光度(A)值,評估純度,260/280均在1.65~2.00。
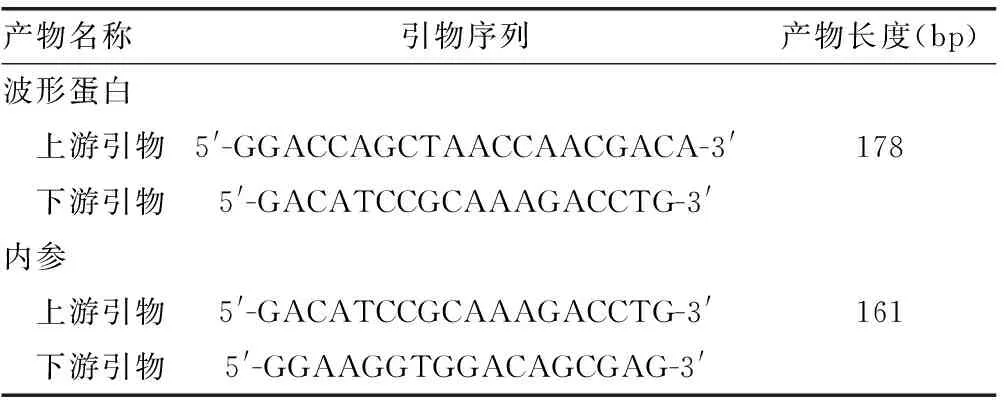
表1 引物序列
1.2.2反轉錄反應 反應體系20 μL,2 μL總RNA,2 μL Oligo-dt(10 μmol/L),2 μL 10×PCR buffer,2 μL Dntp(5 mmol/L),M-MuLV反轉錄酶1 μL(4 U/μL);加入適量的焦碳酸二乙酯使總體積為20 μL,37 ℃、60 min,70 ℃、15 min。最終生成對應的cDNA第一鏈。PCR體系20 μL含Maxima SYBR Green 10 μL,上游引物1 μL,下游引物1 μL,cDNA模板2 μL,最后加無核酸酶的水將整個反應體系補充至20 μL。反應條件:50 ℃ 2 min 循環1次,95 ℃ 10 min 循環1次,95 ℃ 15 s、60 ℃ 60 s循環40次。試劑購自上海捷瑞生物工程有限公司,實時熒光定量PCR反應由ABI Vii7來完成。
1.2.3結果判定 采用β-actin作為內參照,以β-actin內參的拷貝數為校正基數,實驗各樣本中波形蛋白的Ct值與同標本中β-actin內參的Ct值相減,為該標本的波形蛋白的ΔCt值;以正常肝組織中的波形蛋白與β-actin內參的差值ΔCt值作為校正,得出ΔΔCt值(肝癌組織ΔCt-正常肝臟組織ΔCt、癌旁組織ΔCt-正常肝臟組織ΔCt),按目的基因表達量(RQ)=2-ΔΔCt,計算癌組織、癌旁組織中波形蛋白的相對表達水平。
1.2.4免疫組織化學檢測 每個標本經4%多聚甲醛常規灌注固定,取材并置于20%(w/v)蔗糖溶液(4 ℃)中過夜。組織石蠟包埋后連續切片,取石蠟切片脫蠟、水化,滴加3%的H2O2-甲醇液30 min,以清除內源性過氧化物酶的影響,0.01 mol/L PBS清洗5 min×3次;加入0.3%Triton-100 30 min,以增加細胞的通透性,0.01 mol/L PBS清洗5 min×3次;水洗,加一抗(抗波形蛋白,1∶100),4 ℃存放24~48 h,吸去抗體,0.01 mol/L PBS清洗5 min×3次;加0.01 mol/L PBS稀釋的二抗,室溫孵育2 h,0.01 mol/L PBS清洗5 min×3次;加入ABC復合物之類的抗體,室溫孵育2 h,0.01 mol/L PBS清洗5 min×3次,蒸餾水迅速沖3次;加入顯色液,進行免疫組織化學顯色,時間3~10 min,待細胞著色而背底顏色較淡時,馬上吸去顯色液,蒸餾水迅速沖3次后加入0.01 mol/L PBS終止反應;蘇木素復染,梯度脫水之后透明、封片、拍照。每組均設陰性對照,以Tris液替代一抗。SimPlePCI圖像分析系統測定免疫組織化學測試區的陽性細胞數目、平均灰度級、陽性產物的平均灰度與面積、背景面積進行測量。
本院兩位病理科醫生按照隨機雙盲原則在光學顯微鏡下進行讀片,每張切片隨機選取5個(×40)高倍鏡視野,并存取得到文件;按照Image J軟件說明讀取圖片圖像的灰度值。并結合HCC TNM分期評分標準(2015年)分組。(1)T-原發病灶:Tx為原發腫瘤不能測定;T0為無原發腫瘤的證據;T1為孤立腫瘤沒有血管受侵;T2為孤立腫瘤,有血管受侵或多發腫瘤直徑小于或等于5 cm;T3a為多發腫瘤直徑大于5 cm;T3b為孤立腫瘤或多發腫瘤侵及門靜脈或肝靜脈主要分支;T4為腫瘤直接侵及周圍組織,或致膽囊或臟器穿孔。(2)N-區域淋巴腺:Nx為區域內淋巴腺不能測定;N0為無淋巴腺轉移;N1為區域淋巴腺轉移。(3)M-遠處轉移:Mx為遠處轉移不能測定;M0為無遠處轉移;M1為有遠處轉移。(4)肝癌分期:Ⅰ期為T1N0M0;Ⅱ期為T2N0M0;ⅢA期為T3aN0M0;ⅢB期為T3bN0M0;ⅢC期為T4N0M0;ⅣA期為任何T,N1M0;ⅣB期為任何T,任何N,M1。
2 結 果
2.1實時熒光定量PCR檢測 癌組織、癌旁組織及正常肝組織的波形蛋白的mRNA分別為8.97±4.19、2.14±1.12和1.00±0.00,差異有統計學意義(Plt;0.05)。見表2。
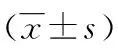
表2 波形蛋白mRNA在各組織中的表達
2.2免疫組織化學檢測 波形蛋白在癌組織中呈強陽性表達,在癌旁近臨組織及癌旁近遠組織呈弱陽性表達,而正常組織里無表達。癌組織、癌旁近臨和癌旁近遠組織樣本里波形蛋白表達量分別為75.22±16.87、41.72±6.19和36.26±4.71,差異有統計學意義(Plt;0.05)。見圖1。
A:癌組織;B:癌旁近臨組織;C:癌旁近遠組織;D:正常組織。
圖1波形蛋白在各組織中病理切片表達(×400)
2.3臨床病理資料 波形蛋白表達與患者年齡、性別、腫瘤大小和腫瘤范圍無關(Pgt;0.05),與TNM分期、病理分級、淋巴結轉移、遠處轉移有關(Plt;0.05)。見表3。

表3 波形蛋白在HCC患者中的表達與臨床病理關系
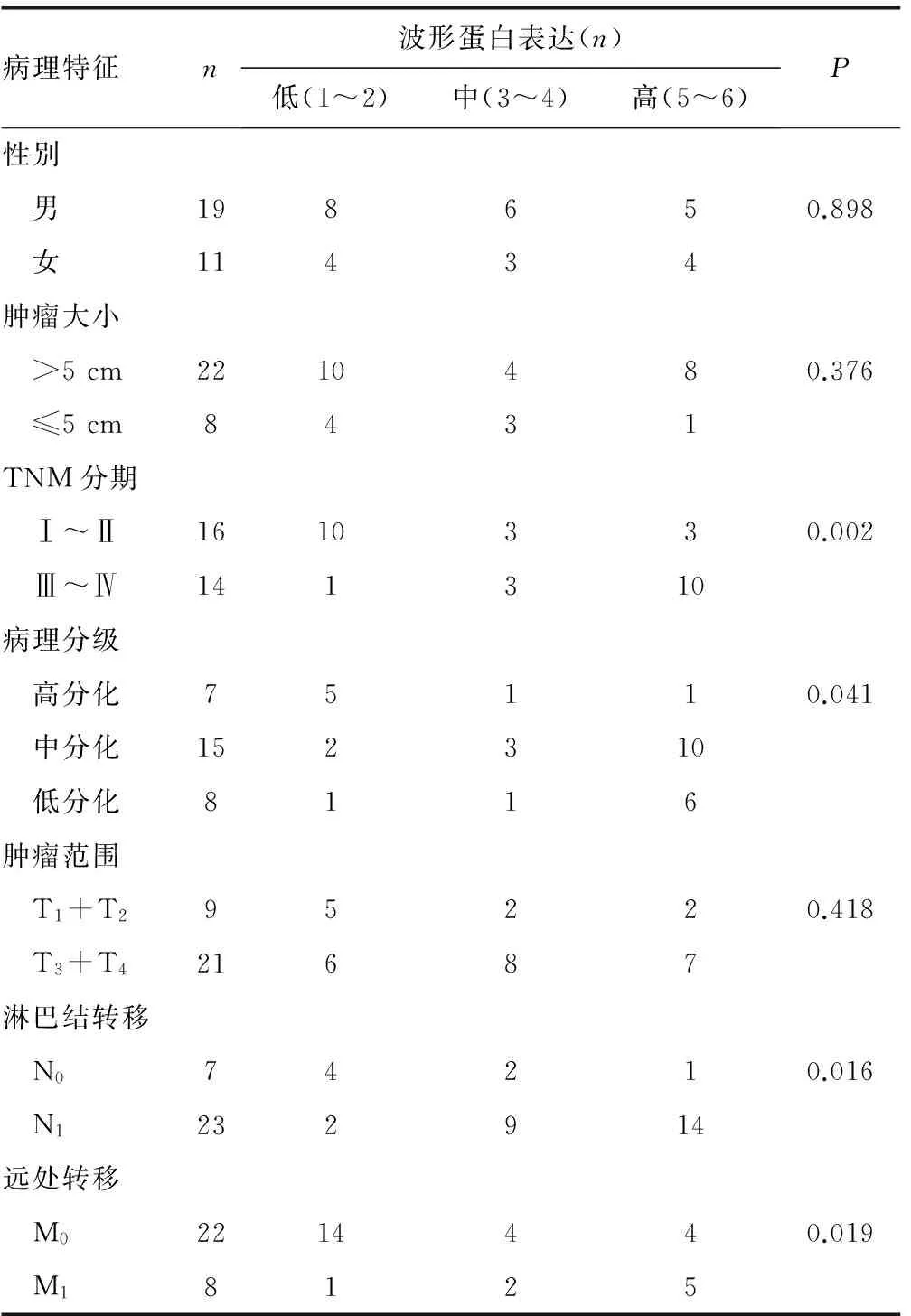
續表3 波形蛋白在HCC患者中的表達與臨床病理關系
3 討 論
惡性腫瘤是危害人類健康的主要原因,是目前導致疾病死亡的第二位因素。HCC是危害人類健康的腫瘤疾病,近10年來發病率逐年升高,由于惡性程度高、起病隱匿,早期診斷率和手術切除率均很低,且對放療和化療不敏感,預后差。
惡性腫瘤最具危害性之處在于它的侵襲轉移性,HCC的侵襲轉移是一個非常復雜的過程,為很多因素與環節相互作用的結果,其機制尚未清晰。盡管如此,目前人們也認識了許多重要的病理過程:惡性腫瘤發生侵襲轉移時,癌細胞之間的黏附能力下降,細胞外基質框架結構被損壞,癌細胞向遠處擴散轉移及癌細胞擴散到其他部位形成新生血管等[5]。本研究也發現,在HCC細胞中波形蛋白異常表達,表現出EMT的病理特征,具有極性的上皮細胞轉換成具有活動能力、能夠在細胞基質間自由移動的間充質細胞過程,這暗示EMT為HCC細胞脫離原發灶侵襲轉移鄰近組織提供必需的物質基礎,由此也可能為臨床診斷提供分子標記。波形蛋白屬于Ⅲ型中間絲蛋白,是細胞骨架組成中除微管和微絲之外的第3組分[6];從胞核到胞膜呈放射狀分布,在維持和調節細胞正常形態和功能中起重要作用,如細胞收縮、遷移、增殖、蛋白合成、基因表達、細胞凋亡和機械力傳導[7]。Tsuruta等[8]用黃色和藍色熒光蛋白分別標記整合素β3和波形蛋白研究表明,波形蛋白通過與整合素β3形成黏著斑來影響細胞黏附。Ivaska等[9]進一步研究表明,波形蛋白與整合素的黏著與脫附是通過蛋白激酶Cε(PKCε) 的磷酸化與去磷酸化來調節的,以實現細胞移動,是細胞移動的參與者。上皮源腫瘤細胞中波形蛋白的高表達,可能使腫瘤細胞去分化而“顯現”為更加原始“腫瘤祖細胞”,并促成EMT。借助或利用間質細胞來實現其侵襲轉移[10]。
本研究發現,癌組織、癌旁組織標本及正常肝組織標本的波形蛋白的mRNA分別為8.97±4.19、2.14±1.12和1.00±0.00,差異有統計學意義(Plt;0.05)。癌組織,癌旁近臨和癌旁近遠組織樣本里波形蛋白表達量分別為75.22±16.87、41.72±6.19和36.26±4.71,差異有統計學意義(Plt;0.05)。有學者詳細論述了腫瘤細胞分泌外泌體作為“先鋒兵”“教唆犯”介導組織器官微環境的改變,為腫瘤轉移定植生長提供有利環境[11-12]。最新的研究表明,腫瘤細胞外泌體是通過誘導提高波形蛋白和N-鈣黏蛋白(N-cadherin)的表達,以促成EMT[13]。筆者推測:HCC細胞分泌腫瘤外泌體,向周圍組織或血液等擴散,誘導波形蛋白等的表達,為腫瘤細胞的轉移、侵襲準備物質基礎,雖然此時腫瘤細胞還未侵襲到此處,表現為組織中波形蛋白表達隨距離HCC組織的近遠而逐漸降低;隨著癌旁組織里波形蛋白表達逐漸增加,促成EMT,腫瘤細胞可能會隨之侵襲到此處。因此,波形蛋白既可能是肝癌發生、發展及惡性程度某種特征因子,同時又是癌細胞轉移侵襲的“鋪路石”,通過癌細胞分泌泌外體的擴散,在癌旁組織里誘導其表達,越靠近癌組織泌外體的濃度越高,促其表達也越高,還有待于進一步深入的研究。現階段研究表明,波形蛋白對于癌癥患者的診斷依然有爭論,波形蛋白的表達與癌癥患者療效不佳相關[14];體外實驗證明,細胞外基質與化療藥物密切相關,但是很多研究證實,波形蛋白不能夠預計癌癥患者術后的復發率及生存率[15]。
本研究顯示,波形蛋白在肝癌組織中的表達明顯高于癌旁組織,并且其表達與TNM分期、病理分級、淋巴結轉移、遠處轉移相關,與性別、年齡、腫瘤大小、腫瘤范圍無關。波形蛋白在肝癌組織的高表達可能對肝癌有一定的促進作用,這與國內外大多數研究一致。但具體調節靶基因類型及其分子機制還需進一步探索。
[1]Vora Hemangini H,Patel Nupur A,Rajvik Kruti N,et al.Cytokeratin and vimentin expression in breast cancer[J].Int J Biol Mark,2009,24(1):38-46.
[2]Mosnier JF,Balique JG.Pleomorphic giant cell carcinoma of the esophagus with coexpression of cytokeratin and vimentin and neuroendocrine differentiation[J].Arch Pathol Lab Med,2000,124(1):135-138.
[3]陳徐艱,沈亦鈺,王兢,等.異黏蛋白、上皮鈣黏蛋白、β鏈蛋白在肝細胞癌中的表達及預后研究[J].中華肝膽外科雜志,2013,19(8):597-600.
[4]Hiroyuki J,Satoko M,Fuyuki S,et al.Vimentin expression of esophageal squamous cell carcinoma and its aggressive potential for lymph node metastasis[J].Biom Res,2010,31(2):105-112.
[5]常磊,袁玉峰,郭濤,等.波形蛋白、E-鈣黏蛋白在原發性肝癌上皮間質轉化過程中的表達及其意義[J].中華肝膽外科雜志,2015,21(1):9-13.
[6]Sabo E,Miselevich I,Bejar J.The role of vimentin expression in predicting the long-term outcome of patients with localized renal cell carcinoma[J].Brit J Urol,1998,80(6):864-868.
[7]Heatley MK,Ewings P,Odling Smee W,et al.Vimentin expression does not assist in predicting survival in ductal carcinoma of the breast[J].Pathology,2002,34(3):230-232.
[8]Tsuruta D,Jones CR.The vimentin cytoskeleton regulates focal contact size and adhesion of endothelial cells subjected to shear stress[J].J Cell Sci,2003,116:4977-4984.
[9] Ivaska J,Vuoriluoto K,Huovinen T,et al.PKCε-mediated phosphorylation of vimentin controls integrin recycling and motility[J].EMBO J,2005,24:3834-3845.
[10]Liu CY,Lin HH,Tang MJ,et al.Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation[J].Oncotarget,2015,6(18):15966-15983.
[11]Hoshino A,Costa-Silva B,Shen TL,et al.Tumour exosome integrins determine organotropic metastasis[J].Nature,2015,527(7578):329-335.
[12]Sung BH,Ketova T,Hoshino D,et al.Directional cell movement through tissues is controlled by exosome secretion[J].Nat Commun,2015,6:7164.
[13]Syn N,Wang LZ,Seth G,et al.Exosome-mediated metastasis:from epithelial-mesenchymal transition to escape from immunosurveillance[J].Trends Pharmacol Sci,2016,37(7):606-617.
[14]Richardson F,Young GD,Sennello R,et al.The evaluation of E-Cadherin and vimentin as biomarkers of clinical outcomes among patients with non-small cell lung cancer treated with erlotinib as second-or third-line therapy[J].Anticancer Res,2012,32(2):537-552.
[15]Satelli A,Li S.Vimentin in cancer and its potential as a molecular target for cancer therapy[J].Cell Mol Life Sci,2011,68(18):3033-3034.
10.3969/j.issn.1671-8348.2017.33.035
貴州省省校合作計劃項目(黔科合LH字[2014]7118號)。
成超(1985-),住院醫師,碩士,主要從事肝膽外科方面的研究。△
,E-mail:2690527939@qq.com。
R735.7
B
1671-8348(2017)33-4714-04
2017-05-10
2017-08-08)

