水下爆炸致兔急性肺損傷的實驗研究
王前進,葉長青,邵先安,徐長江,黃奕江,馬宏昊,郝 建,齊曉林
·短篇論著·
水下爆炸致兔急性肺損傷的實驗研究
王前進,葉長青,邵先安,徐長江,黃奕江,馬宏昊,郝 建,齊曉林
目的構建水下爆炸致急性肺損傷動物模型,研究致傷機制,分析早期死亡原因,為臨床診治水下急性肺損傷提供實驗數據。方法選擇新西蘭兔30只,雌雄不限,質量(2.04±0.35)kg;隨機分為實驗組、對照組兩組,每組15只。實驗組爆炸源與致傷動物的距離為1.8m,對照組不做爆炸。傷后0、4、12、24h采集血液,24h放血處死,采集支氣管肺泡灌洗液(BALF)及肺組織標本,測定肺濕干重比(W/D),測量傷后0、4、12、24h呼吸頻率,并行血氣分析,酶聯免疫吸附測定(ELISA)方法測定血液、BALF中白細胞介素8(IL-8)、腫瘤壞死因子α (TNF-α),光鏡下觀察肺HE染色切片病理學變化。結果實驗組傷后0、4h呼吸頻率較對照組增快(P<0.05),傷后24h PaO2低于對照組(P<0.05);實驗組血液及BALF中IL-8、TNF-α均較對照組升高(P<0.05),實驗組W/D也明顯高于對照組(P<0.05);光鏡下見肺泡結構破壞,肺間質及肺泡腔水腫、出血,粒細胞浸潤。結論實驗組能較好地模擬水下爆炸肺損傷特點,結果重復性好,能作為水下爆炸肺損傷的動物模型。
肺損傷; 水下爆炸; 動物模型
爆炸性武器在水下爆炸,產生強烈沖擊波,造成水下沖擊傷。肺是水下沖擊波致傷和致死的“靶器官”[1]。急性肺損傷(ALI)若不及時救治,可導致急性呼吸窘迫綜合征(ARDS),是早期死亡原因之一。本研究利用中國科技大學研制的爆炸裝置,建立新西蘭兔急性肺損傷模型,研究水下肺損傷致傷機制,分析早期死亡原因,為臨床診治水下急性肺損傷提供實驗數據。
材料與方法
1實驗材料
實驗動物為30只健康新西蘭兔,雌雄不限,質量(2.04±0.35)kg,由安徽長臨河醫藥科技有限公司提供[許可證號syxk(皖)2007-002],均按標準條件飼養。血氣分析采用美艾利爾Epoc?血氣分析系統;兔白細胞介素8(IL-8)酶聯免疫吸附測定(ELISA)試劑盒(上海江萊生物科技有限公司,批號:201602);兔腫瘤壞死因子-a (TNF-α) ELISA試劑盒(上海江萊生物科技有限公司,批號:201602)。
2爆炸裝置
爆炸源為太安炸藥,壓力數據測試系統包括安捷倫示波器(型號dso5054A),水下壓力傳感器為pcb138A25(由中國科學技術大學近代力學系爆炸實驗室提供),見圖1。
3實驗方法
3.1實驗分組 將30只新西蘭兔隨機分為實驗組、對照組,每組15只,根據預實驗結果,實驗組爆炸源與致傷動物的距離為1.8m。
3.2模型建立 實驗組兔氯胺酮40mg/kg,氟哌利多1.6 mg/kg,經肌肉注射麻醉[2],胸部及頸部備皮,分別經左頸總動脈和右頸外靜脈放置留置針,將兔固定在自制鋼質保護箱中,保護箱在兔胸部處開一窗口,窗口大小與兔胸部一致,且可調節(圖2)。兔頭部外露,其余部位如腹部、四肢等均保護在箱體內,將保護箱放置于水下爆炸罐內并固定(圖3)。爆炸源采用太安炸藥1g,制成圓柱狀藥包,炸藥采用導爆管起爆,同時保證新西蘭兔胸部中心與水下壓力傳感器位于同一水平線上。測量超壓為(2.91±0.35)MPa,持續時間為(4.34±1.04)μs(壓力時程曲線見圖4)。爆炸實驗操作全部由專業人員實施[3]。

圖2自制鋼質保護箱圖3 兔保護箱固定于水下爆炸罐內

圖4 水下爆炸壓力時程曲線
4標本采集
經左頸總動脈留置針,各組分別采集傷后0、4、12、24h的頸總動脈血行血氣分析,并采集以上時間點頸總動脈血離心,分離血清備用。傷后24h放血處死實驗兔。夾閉左主支氣管,0.9%氯化鈉10mL反復3次灌洗右肺,抽取支氣管肺泡灌洗液(BALF)離心備用。取左肺下葉,吸干表面雜質,測干濕重。左肺上葉下部經0.9%氯化鈉沖洗,10%甲醛固定。
5觀察指標
(1) 呼吸頻率:記錄實驗組爆炸后0、4、12、24h呼吸頻率,同時記錄對照組相應時間點呼吸頻率。(2) 動脈血氣分析:經左頸總動脈留置管采動脈血2mL,即刻行血氣分析。(3)細胞因子濃度測定:頸總動脈血離心取血清,右肺BALF,ELISA方法分別測定IL-8、 TNF-α的濃度,試驗步驟嚴格按照試劑盒說明書操作。(4)肺組織病理組織學觀察:左肺上葉下部經0.9%氯化鈉沖洗,10%甲醛固定,石蠟包埋,切片4~5μm厚,HE染色,光鏡下由2名有經驗的病理醫生分別獨立觀察。(5)濕干比(W/D):取左肺下葉,吸干表面雜質,天平稱取肺濕重后,置于80℃烘箱72h至烘干,稱取干重,計算肺濕干重比(W/D)。
6統計學分析
結 果
1兩組呼吸頻率比較
爆炸組傷后0h呼吸頻率明顯增快,4h仍呼吸急促,較對照組差異有統計學意義(P<0.05)。12h后呼吸逐漸平穩,與對照組比較差異無統計學意義(P>0.05)。見表1。

表1 兩組呼吸頻率比較(次
與對照組相比:*P<0.05
2兩組動脈PaO2比較
傷后0h,實驗組PaO2升高明顯,與對照組相比,差異有統計學意義(P<0.05);傷后4、12h PaO2降低,與對照組相比,差異無統計學意義(P>0.05);傷后24h,PaO2低于對照組,差異有統計學意義(P<0.05)。見表2。

表2 兩組動脈PaO2比較
與對照組相比:*P<0.05
3兩組血清細胞因子比較
實驗組傷后4、12、24h血清IL-8、TNF-α均明顯升高,與對照組相比,差異顯著(P<0.05)。見表3。
4兩組BALF細胞因子和濕干比(W/D)比較
實驗組傷后12、24h BALF中細胞因子濃度明顯升高,與對照組相比,差異顯著(P<0.05)。實驗組W/D升高,與對照組相比,差異有統計學意義(P<0.05)。見表4。

表3 兩組血清細胞因子比較
與對照組相比:*P<0.05
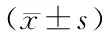
表4 兩組支氣管灌洗液細胞因子和W/D比較
與對照組相比:*P<0.05
5病理變化
實驗組有3只兔兩肺見3葉以上的肺組織大片狀出血,累及肺實質,切面可見粉紅色泡沫狀的水腫液溢出,平均肺組織出血實變面積達80%以上,部分肺組織出現肺大泡和肺不張(圖5)。另12只兔見2葉以上肺組織小片狀出血,肺表面較膨滿,切面見支氣管腔內有少許泡沫樣液體(圖6)。光鏡下見雙側肺泡結構破壞,肺泡壁斷裂破碎,肺間質及肺泡腔水腫、出血,粒細胞浸潤,間質毛細血管內血流淤滯(圖7、8)。

圖5 重度肺損傷圖6 中度肺損傷
圖7 重度肺損傷(HE ×100)圖8 中度肺損傷(HE ×100)
討 論
動物模型是研究水下爆炸沖擊傷的基礎,目前有兩種方法制作模型:(1)利用激波管產生的沖擊波進行沖擊傷實驗研究[4];(2)采用現場水下爆炸動物實驗法,將實驗動物靜脈麻醉后,頸部固定于距爆心一定距離的漂浮夾具,頭露出水面,胸腹部及四肢垂直并浸沒于水中[5]。筆者利用中國科技大學研制的爆炸裝置,采用現場靜爆方法,通過調整爆炸源和實驗兔的距離來控制致傷參數,建立了水下爆炸傷實驗模型。本實驗采用圓柱狀炸藥作為爆炸源,爆炸球具有裝藥量穩定、爆炸參數明確、爆炸能量可控制等優點。實驗兔固定在自制鋼質保護箱中,頭部外露,減少了沖擊波對其他臟器影響,實驗模型更加穩定。
肺是水下爆炸沖擊傷最易受損的器官,其病變程度與動物所承受的超壓大小及距爆心的距離有密切關系,相同爆炸劑量時,距爆心越近損傷越重[5]。筆者根據爆炸源與致傷動物不同的距離,分組進行預實驗,12只新西蘭兔隨機分成2組,每組6只,1組距離1.5m,1組距離1.8m,1.5m組24h只有2只存活,死亡率高,不適合作為實驗模型;而1.8m組早期只有1只死亡,傷后呼吸頻率、血氣、細胞因子變化明顯,病理見肺組織充血水腫,部分肺泡間隔內出血,可見中性粒細胞浸潤或聚集,能夠反映水下爆炸肺損傷的傷情變化特點。因此在后續實驗中,筆者選取1.8m作為爆炸距離。
急性肺損傷實驗動物建模并沒有公認的標準,以前不少研究者建模時參考1994年歐美聯盟協會根據臨床病例統計分析提出的ALI/ARDS診斷標準[6],當氧合指數(PaO2/FiO2)≤300mmHg,即可診斷急性肺損傷。但Matute-Bello等[7]認為這一標準直接應用于判斷急性肺損傷實驗動物傷情并不合理,它只能在一定程度上反映出實驗動物肺損傷的程度。動物的PaO2與人差別較大,本實驗對照組新西蘭兔的PaO2為(82.57±7.03)mmHg,與文獻報道相似[8]。實驗組傷后0h PaO2升高明顯,是實驗兔呼吸頻率增加所致[9],傷后24h PaO2降低,但氧合指數>300mmHg。筆者認為,肺損傷實驗動物模型應根據呼吸頻率、血清和BALF中細胞因子濃度的變化、肺含水量等評估,更重要的是組織病理學改變應符合肺損傷標準。利用中國科技大學研制的爆炸裝置,采用圓柱狀炸藥作為爆炸源,選用爆炸源距離致傷動物1.8m作為致傷參數建立實驗模型,能較好地模擬水下爆炸肺損傷,且致傷參數容易控制,復制簡單,可以進一步應用于水下爆炸傷的臨床救治實驗研究。
水下爆炸肺損傷分為原發性損傷和繼發性損傷。原發性損傷是沖擊波直接作用于胸部造成的損傷,肺部沖擊傷分5度[10],Ⅰ度(無傷):肺臟表面和切面未見異常,或表面僅有輕微充血或個別點狀出血;Ⅱ度(輕度):一葉或數葉有點灶狀或有2個以內的斑塊狀出血,切面擠壓時有很少量粉紅色或血性泡沫樣液體流出,或僅在鏡檢時方可確定有水腫;Ⅲ度(中度):一葉或數葉有斑塊狀或2個以內的小片狀出血,2葉以上的肺表面較膨滿,切面見小支氣管管腔內有少許泡沫樣液體,擠壓時有較多的液體流出;Ⅳ度(重度):一葉或數葉有3個以上的小片狀或有個別彌漫性大片狀出血,3葉以上的肺表面明顯膨脹、發亮,切面見小支氣管管腔內有較多的泡沫樣液體,不加擠壓亦可流出泡沫樣液體,個別肺葉可有淺層裂口;Ⅴ度(極重度):兩側肺臟有4葉以上的肺葉有彌漫性大片狀出血,氣管腔內積存泡沫樣液體,兩側肺表面顯著膨滿、發亮,打開胸腔后肺不萎陷,切面可見小支氣管管腔內有大量的泡沫樣液體,并有大量液體自切面自發流出,肺表面有多發性淺層裂口或深度撕裂。本實驗發現,實驗組有3只兔為重度肺損傷,其余12只為中度肺損傷,大體標本見肺明顯出血腫脹,光鏡下見肺泡壁斷裂,肺大泡形成,肺泡腔內出血。原發性肺損傷機制是:(1)沖擊波對機體胸廓直接打擊引起;(2)沖擊波的負壓引起的肺泡過速和過度擴張所致;(3)沖擊波超壓通過內爆效應引起[11]。實驗組傷后0h PaO2升高,隨著時間延長逐漸下降,傷后24h已明顯低于正常;兩肺腫脹,切面有泡沫樣液體,肺濕干比較對照組有顯著差異;病理檢查顯示肺組織內大量中性粒細胞浸潤,肺泡腔彌漫性出血、水腫,肺間質水腫明顯,肺泡間隔增寬,以上均提示可能存在的繼發因素加重了胸部爆炸傷后的肺原發損傷。IL-8、TNF-α是炎癥反應中重要的細胞因子,與炎癥反應程度密切相關。IL-8可顯著趨化中性粒細胞,誘導其脫顆粒反應、呼吸爆發和溶酶體酶釋放,從而導致過度的炎癥反應,是中性粒細胞介導的肺損傷的重要決定因素[12]。TNF-α是具有廣泛生物活性的細胞活化因子,大量研究證明,在ALI的發生發展過程中,TNF-α等炎性介質的合成、釋放,中性粒細胞在肺內的聚集、補體激活、氧自由基的生成導致的一系列病理改變中起著重要作用[13]。 本實驗發現血清IL-8、TNF-α在傷后均明顯升高,且隨著時間延長升高更明顯,BALF中IL-8、TNF-α也明顯升高,與對照組相比,差異有統計學意義,表明IL-8、TNF-α在傷后繼發肺損傷的發展中起重要作用。
[1] 單佑安,蔣建新,楊志煥,等.大劑量地塞米松對犬嚴重肺沖擊傷的治療作用[J].第三軍醫大學學報,2003,25(11):935-937.
[2] 胡玉紅.一種新的家兔麻醉方法[J].中國實驗動物學雜志, 2001,11(3):183.
[3] 萬曉智,馬宏昊,沈兆武,等.RDX基鋁纖維炸藥與鋁粉炸藥水下爆炸性能比較[J].振動與沖擊,2014,24(33):129-133.
[4] 楊志煥,朱佩芳,蔣建新,等.水下沖擊傷損傷的特點的初步探討[J]. 中華創傷雜志,2003,19(2):111-114.
[5] 黃建松.水下沖擊傷的特點及研究進展[J].海醫軍學雜志,2004,25(2):168-170.
[6] Bernard GR,Artigas A,Brigham KL,et al.Report of the American-Europe Consensus conference on acute respiratory distress syndrome:definitions,mechanisms,relevant outcoms,and clinical trial coordination[J].J Ctit Care,1994,9(1):72-81.
[7] Matute-Bello G,Downey G,Moore BB,et al.An offical American Thoracic Society workshop report:features and measurements of experimental acute lung injury in animals[J].Am J Respir Cell Mol Biol, 2011,44(5):725-738.
[8] 閆峰,吉訓明,田欣,等. 新西蘭兔血氣和部分血液生理生化參數的測定[J].實驗動物科學,2010,27(2): 55-57.
[9] 張岫竹,周繼紅,蔣建新,等.水下沖擊傷后肺與血氣的變化及其意義[J]. 解放軍醫學雜志,2004,29(2):100-102.
[10] Liu B,Wang Z,Leng H,et al.Pathological study of thoracic impact injury involving a relatively static impact pattern[J].J Trauma,1996,40(3S):S85-88.
[11] 陳海斌,王正國,楊志煥,等.沖擊波傳播的三個時段模擬實驗中動物肺的損傷[J].爆炸與沖擊,2000,20(3):264-269.
[12] Feuerstein G,Rabinoviei R.Importance of interleukin-8 and chenokines in organ injury and shock[J].Crit Care Med,1994,22(4):550-551.
[13] 崔乃杰,劉兵.實用危重病急救醫學[M].天津:天津科技翻譯出版公司,1993:530.
2016-08-01;
2017-01-16)
(本文編輯: 郭 衛)
國家自然科學基金青年項目(81600694)
作者單位: 221000 南京,解放軍第四五四醫院糖尿病足中心
共同第一作者: 孫新娟
通信作者: 王愛萍,E-mail:wap454hospital@hotmail.com
Experimentalstudyofacutelunginjuryinrabbitsbyunderwaterblast
WANGQian-jin1,YEChang-qing1,SHAOXian-an1,XUChang-jiang1,HUANGYi-jiang1,MAHong-hao2,HAOJian3,QIXiao-lin1
(1.123th Hospital of PLA,BengBu,AnHui 233015,China; 2.University of Science and Technology of China,Hefei 230026,China;3.Department of Cardiopulmonary Rehabilitation Center,128th Hangzhou Hospital,Hangzhou 310007,China)
ObjectiveTo establish a rabbit model of underwater blast-induced acute lung injury(ubALI) and to investigate the related mechanisms.MethodsThirty rabbits (weighing(2.04±0.35)kg) were randomly divided into two groups: control group (no injury) and experimental group(explode at 1.8 meters).The respiratory rate (RR) and arterial partial pressure of oxygen(PaO2) were assayed at 0,4,12,24h after injury. The expression of interleukin-8 (IL-8),tumor necrosis factor-α(TNF-α) in the bronchial alveolar lavage fluid(BALF) and blood samples were measured by ELISA. Morphological changes of tissues were detected by hematoxylin and eosin(HE)staining,and pulmonary edema was determined by the wet-dry method.ResultsUbALI significantly increased RR at 0 and 4 h,and reduced PaO2at 24 h(P<0.05). UbALI significantly increased the levels of IL-8 and TNF-α in both BALF and blood samples(P<0.05). The water content in the lung markedly increased,and pulmonary edema and granulocyte infiltration were observed in lung tissues after ubALI.ConclusionThese results demonstrate that we have created a reliable and reproducible ubALI model in rabbits. This model will be helpful for studying the mechanisms of ubALI and developing strategies for clinical treatment.
lung injury; underwater explosion; animal model
1009-4237(2017)11-0865-04
R655;R826.5
A
10.3969/j.issn.1009-4237.2017.11.018
233015 安徽 蚌埠,解放軍第一二三醫院(王前進,葉長青,邵先安,徐長江,黃奕江,齊曉林); 230026 合肥,中國科學技術大學(馬宏昊); 310007 杭州,杭州一二八醫院心肺康復醫學中心(郝建)
齊曉林,E-mail:xlqjs@126.com

