谷子SiARGOS1的克隆、表達分析和功能標記開發
王智蘭,杜曉芬,王軍,楊慧卿,王興春,郭二虎,王玉文,袁峰,田崗,劉鑫,王秋蘭,李會霞,張林義,彭書忠
?
谷子的克隆、表達分析和功能標記開發
王智蘭1,杜曉芬1,王軍1,楊慧卿1,王興春2,郭二虎1,王玉文1,袁峰1,田崗1,劉鑫1,王秋蘭1,李會霞1,張林義1,彭書忠1
(1山西省農業科學院谷子研究所/雜糧種質資源發掘與遺傳改良山西省重點實驗室,山西長治 046011;2山西農業大學生命科學學院,山西太谷030800)
從谷子中分離受激素誘導表達、參與器官大小控制的擬南芥(Auxin-regulated gene involved in organ size)基因家族的同源基因,進行生物信息學分析,明確其在不同組織器官及其受植物激素誘導的表達模式,分析基因編碼區及其啟動子序列差異,開發功能標記,為谷子產量性狀相關基因的改良提供依據。通過對已有ARGOS蛋白保守結構域進行BLAST,明確谷子ARGOS家族成員數目并進行蛋白序列分析,采用同源克隆方法獲得谷子ARGOS家族成員之一——編碼區及其啟動子序列,用生物信息學方法分析啟動子的順式作用元件,通過實時熒光定量PCR分析該基因在谷子各器官中以及不同植物激素條件下的誘導表達模式,利用基因編碼區及啟動子序列的SNP和插入缺失序列開發分子標記,同時利用85份谷子品種的穗重(panicle weight,PW)、穗粒重(grain weight,GW)和千粒重(thousand-grain weight,TGW)等產量性狀數據進行基因型間的差異顯著性分析,挖掘用于檢測該基因與谷子產量性狀相關優異等位變異的功能標記。獲得6個谷子ARGOS家族成員,均具有典型的保守OSR(organ size related)結構域,包含2個跨膜螺旋結構和1個高度保守富含亮氨酸區域,克隆了與擬南芥AtARGOS同源的家族成員之一——編碼區及其啟動子序列,該基因位于谷子第8染色體上,開放閱讀框為342 bp,無內含子,編碼113個氨基酸,啟動子區域為2 109 bp,含有與生長素、乙烯、茉莉酸和赤霉素等多種植物激素調控有關的元件。表達分析發現,在谷子根、莖、葉和穗等器官中均有表達,在根中表達量最高,其次為莖和葉,穗中表達量最低。對生長素吲哚乙酸(indole-3-acetic acid,IAA)不敏感,但受乙烯利(ethephon,ETH)上調表達。不同基因型谷子序列分析發現,編碼區151 bp(起始密碼子83 bp)處存在1個SNP(C/G),導致該基因第28個氨基酸發生突變(Ala/Gly),據此設計一個CAPS-Ⅱ標記;另外,啟動子區存在19個SNP和2個InDel,根據-1 652—-1 651處(TA)2/3和-1 165—-1 163處(TCA)1/2的序列差異分別設計SSR引物AP-1和AP-2。同時,用這些標記對85份谷子品種進行檢測,CPAS-Ⅱ和AP-1檢測到不同基因型的穗重、穗粒重和千粒重的差異均不顯著,而AP-2檢測的2種基因型間除千粒重差異不顯著外,穗重和穗粒重在2015和2016兩年間差異均達到顯著水平。在谷子中發現6個ARGOS家族成員,均具有保守OSR結構域,其中,谷子開放閱讀框為342 bp,無內含子,與擬南芥AtARGOS同源,該基因對生長素不敏感,但受乙烯利上調表達。在該基因啟動子區開發的SSR標記AP-2可作為功能標記,用于谷子穗重和穗粒重等產量性狀相關優異等位變異的鑒定和篩選。
谷子;;啟動子;表達分析;功能標記
0 引言
【研究意義】作物產量性狀與植株器官大小存在密切關系[1],植物器官大小除受光照、溫度、營養和激素等外界環境條件影響外,主要受基因表達和信號轉導等遺傳因子調控。谷子具有耐旱耐瘠性強、基因組小、二倍體、生育期短等特點,以谷子為模式作物開展功能基因研究,能為解決多年來難以解析的抗旱和C4光合作用遺傳分子機理提供嶄新的機遇[2-3]。因此,發掘控制谷子器官大小的重要功能基因并用于遺傳改良,對于加快谷子育種進程和提高谷子單產具有重要作用。【前人研究進展】研究認為,細胞總數目的增加[4]和單細胞體積增大[5]2個連續并相關的過程控制植物器官的大小,而植物器官大小在不同物種中差異顯著但在物種內個體之間卻相對一致,說明器官發育過程中,細胞分裂受到遺傳物質的嚴格控制[6]。許多控制植物器官大小的相關基因已被研究,如、、、、、和等[7],其中,擬南芥ARGOS基因家族包括、、和等4個基因。2003年,在擬南芥中首次發現了,該基因受生長素上調表達并通過“auxin→→→”信號通路實現細胞增殖和器官生長的調節[9];由油菜素內酯誘導,這種誘導依賴于油菜素內酯受體BRI1[10];此外,[11]和[12]通過乙烯誘導上調表達,但受ABA和油菜素內酯抑制。該基因家族的共同特點是含有一個保守的ORS結構域,包含2個跨膜螺旋結構,在不同植物激素誘導表達下,最終通過調控細胞數目或細胞體積來調節植物器官大小,對植株生長起到促進作用[8]。玉米ARGOS基因家族目前發現8個基因,其中受乙烯下調表達并參與器官大小的調控,擬南芥轉基因植株抗旱性提高;超表達可使轉基因玉米產量大幅提高[13]。水稻也受生長素誘導上調表達,轉基因植株側生器官的花和葉片變大,角果數目和種子數量增多[14];受干旱、鹽以及外源ABA、MeJA、NAA、ACC、GA3、BR等多種激素上調表達,但不同小麥基因組、和的表達模式存在差異,轉擬南芥植株發芽率增加,葉和花環直徑增大、單株角果數目增多[15];另外,ARGOS基因在大白菜[16-18]、蘿卜[19]、紫花苜蓿[20]中也有報道,均參與植物器官大小的調節。【本研究切入點】谷子ARGOS基因家族成員的特性和受植物激素誘導后的表達模式以及其與產量性狀的關系尚無報道。【擬解決的關鍵問題】本研究通過生物信息學方法獲得谷子中所有ARGOS家族成員并分析其蛋白序列,采用同源克隆方法獲得該基因家族的一個成員的編碼區及其啟動子序列,用生物信息學方法分析啟動子的順式作用元件,采用實時熒光定量PCR分析在谷子各組織器官以及不同植物激素誘導后的表達模式,通過基因編碼區及其啟動子序列進行SNP分析及標記開發,同時利用85份谷子品種的產量性狀進行驗證,開發用于檢測該基因與谷子產量性狀相關優異等位變異的功能標記。
1 材料與方法
1.1 植物材料與性狀測定
用于克隆的谷子品種:晉29A和K186,種植方式:每材料種植1行,行長2.5 m,行距33 cm,取樣時期:拔節期幼葉;用于基因器官表達的谷子品種:豫谷1號,種植方式同上,取樣時期:抽穗后第7天,分別取其根、莖、葉及穗;用于植物激素IAA和ETH響應表達的谷子品種:豫谷1號,種植方式:將種子種植于混合等量營養土和適量水的缽中,放在25℃左右的光照培養箱中培養10 d。然后,用5 μmol·L-1IAA和0.05% ETH分別處理幼苗,在處理后1、3、6和12 h分別取其葉片;用于的SNP分析和標記開發的谷子品種共19份(電子附表1,用下劃線標注的品種):種植方式與取樣時期同晉29A和K186;用于標記驗證的谷子品種:85份谷子品種(電子附表1),其中63份分別來源于中國東北、華北和西北地區,6份來源于美國,4份來源于日本,另外12份來源于印度。于2015和2016年種植于山西省農業科學院谷子研究所試驗田,行長3 m,行距0.33 m,取拔節期葉片用于DNA提取,并于植株籽粒成熟時隨機選取10穗,稱量其穗重和穗粒重,并隨機取1 000粒種子稱重,測定千粒重,利用SPSS軟件IBM SPSS Statistics 19進行統計分析。
1.2 SiARGOS家族成員的生物信息學分析
在NCBI網站(https://www.ncbi.nlm.nih.gov/ genome/?term=foxtail+millet)對已有植物ARGOS蛋白保守結構域進行BLAST,獲得谷子中所有ARGOS家族成員,采用DNAMAN軟件,結合擬南芥、水稻、玉米、小麥、短柄草和高粱的ARGOS家族成員進行蛋白比對,并采用MEGA5生成無根進化樹,用鄰接法進行同源進化分析。
1.3 SiARGOS1全長cDNA克隆
通過擬南芥ARGOS基因家族中4個基因的mRNA序列,在phtozome(http://www.phytozome.net/ search.php)網站進行BLAST,獲得一種谷子ARGOS基因家族序列,編號Seita.8G077300,根據此序列,采用軟件Primer Premier5.0設計包含該基因ORF的引物SiARGOS1(SiARGOS1-1F:5′-ACAAATCCCCAC CCTTGTCA-3′,SiARGOS1-1R:5′-ACTCCTGAAAA GATGCTTCACA-3′),以晉29A和K186的cDNA為模板,擴增得到PCR產物,經克隆測序后得到目標序列。PCR擴增體系為模板2 μL、2×GC Buffer 10 μL、10 mmol·L-1dNTPs 0.4 μL、2 μmol·L-1特異引物4 μL、rTaq DNA聚合酶0.2 μL,ddH2O補充至20 μL。PCR擴增程序為95℃3 min;95℃30 s,58℃30 s,72℃45 s,35個循環;72℃10 min,4℃保存。取PCR產物在1%瓊脂糖凝膠上電泳檢測。
1.4 SiARGOS1啟動子克隆
根據phtozome(http://www.phytozome.net/search. php)網站序號Seita.8G077300,將該基因向上游延伸約2 kb,用軟件Primer Premier5.0設計啟動子區PCR引物Argos-Pro,(Argos-Pro-F:5′-CTCTGTCGTCTG CAAGCAA-3′和Argos-Pro-R:5′-ACTGACAAGGG TGGGGATTT-3′),以晉29A和K186基因組DNA為模板,擴增體系和條件(除退火溫度和延伸時間改為60℃ 30 s,72℃ 2 min)同上,經克隆測序獲得該基因啟動子區序列。將獲得的啟動子序列提交到PlantCARE(http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/),進行順式作用元件的預測。
1.5 RT-PCR和qRT-PCR分析
取豫谷1號抽穗后第7天的根、莖、葉和幼穗,分別提取總RNA并反轉錄為cDNA,另外,用5 μmol·L-1IAA和0.05% ETH分別處理豫谷1號生長10 d的幼苗,在處理后1、3、6和12 h分別取樣,提取總RNA并反轉錄為cDNA,半定量PCR和實時熒光定量PCR引物為SiARGOS1-RT-F:5′-TTGCGTCGA CTTACTTCAGC-3′,SiARGOS1-RT-R:5′-CATGCTC CTCACATCGGTTG-3′。以谷子作為對照(SiActin-F:5′-TTCCCTGGTATTGCTGACCG-3′,SiActin-R:5′-CTCACCCTTCGAGATCCACA-3′)。半定量PCR反應程序為94℃ 3 min;94℃ 30 s,58℃30 s,72℃30 s,28個循環;72℃5 min。反應產物經瓊脂糖凝膠電泳分離;采用Bio-Rad C1000 cycler real time PCR system進行實時熒光定量PCR分析,反應體系為1/10 cDNA template(反轉錄第一鏈)1 μL、SYBR Premix Ex Taq (DRR041D)5 μL、2 μmol·L-1特異引物1 μL,補充ddH2O至10 μL。擴增程序為94℃5 min;94℃30 s,58℃30 s,72℃30 s,35個循環;72℃5 min。65℃—98℃繪制溶解曲線。采用比較閾值法進行定量分析,手工設定熒光閾值,確定循環數Ct值,根據Ct值,計算各樣本的C值,C=2-ΔCt,ΔCt=Ct目標基因-Ct內標基因。試驗設置3次生物學重復并采用雙尾等方差檢驗的方法進行顯著性檢驗(<0.05)。
1.6 SNP和單倍型分析及功能標記開發
對19份谷子材料進行基因編碼區及啟動子全長測序,用引物SiARGOS1和Argos-Pro分別進行編碼區和啟動子擴增,對PCR產物進行克隆測序,利用DNAstar軟件系統的Sequman、Editseq和MegAlign軟件包進行DNA序列的分析,包括拼接、整理與SNP和單倍型分析。引物SiARGOS1的擴增產物經限制性內切酶Ⅱ(CGˇCG)酶切后的片段差異,用于檢測151 bp位點的堿基差異;根據啟動子區兩處插入和缺失設計SSR引物AP-1和AP-2,用于啟動子區的單倍型分型,其中AP-1-F:5′-AGATGAC TCTAAAGGGCATCG-3′,AP-1-R:5′-CAAGGGCAG CAGTGTTTTC-3′;AP-2-F:5′-GTCTTTTGGGATTGT GTCATC-3′,AP-2-R:5′-TGACTAATGTGGTACGGG TC-3′,同時,開發的3處標記分別用85份谷子品種進行驗證。
2 結果
2.1 SiARGOS家族成員的生物信息學分析
在NCBI網站(https://www.ncbi.nlm.nih.gov/ genome/?term=foxtail+millet)對已有ARGOS蛋白保守結構域進行BLAST,共找到6個谷子ARGOS成員,將其分別命名為SiARGOS1、SiARGOS2、SiARGOS3、SiARGOS4、SiARGOS5和SiARGOS6。將得到的谷子ARGOS蛋白與擬南芥、玉米、水稻、小麥、高粱和短柄草的ARGOS蛋白進行了蛋白比對(圖1-A)和進化樹分析(圖1-B),結果表明,與其他已知ARGOS一樣,谷子ARGOS家族具有保守的OSR結構域,包含2個跨膜螺旋結構(圖1-A)。SiARGOS1、SiARGOS3、SiARGOS5和SiARGOS6與擬南芥AtARGOS以及AtARL聚為一類,其中,SiARGOS1和SiARGOS3與小麥、短柄草和高粱的ARGOS同源性最高,SiARGOS5和SiARGOS6與玉米ZmARGOS1和水稻OsARGOS同源性最高,SiARGOS2和SiARGOS4與擬南芥AtOSR1聚為一類,與玉米ZmARGOS8同源性最高。
2.2 SiARGOS1編碼區的克隆
獲取擬南芥ARGOS基因家族中4個基因的mRNA序列,在phtozome(http://www.phytozome.net/ search.php)網站進行BLAST,獲得該基因家族的一種谷子序列,編號Seita.8G077300,經比對分析為而該基因蛋白與擬南芥ARGOS基因家族中的AtARGOS歸為一類,與已有小麥TaARGOSs、高粱SbARGOS和短柄草BdARGOS同源性最高。以晉29A和K186的cDNA為模板,用引物SiARGOS1進行擴增,獲得兩條特異性條帶,長度為491 bp(圖2-A),經克隆測序后發現的ORF為342 bp,基因編碼113個氨基酸,位于谷子第8染色體上,核苷酸序列比對結果顯示該基因編碼區序列在晉29A和K186中沒有差異,同時,用相同引物在基因組DNA中的擴增產物也為491 bp,序列一致,說明該基因沒有內含子,這與擬南芥,水稻和玉米中報道的結果一致[9,13-14]。

A:谷子SiARGOSs和其他植物ARGOS家族的OSR保守結構域,加框的部分為2個跨膜螺旋,中間部分為一個由8個氨基酸(LPPLPPPP)組成的高度保守的富含亮氨酸區域;Si:谷子;At:擬南芥;Ta:小麥;Zm:玉米;Os:水稻;Bd:短柄草;Sb:高粱。B:ARGOS的系統進化樹
2.3 SiARGOS1啟動子的克隆和分析
為進一步了解的表達調控機制,克隆得到起始密碼子前2 109 bp啟動子序列(圖2-B),采用PlantCARE對起始密碼子(ATG)上游的2 109 bp片段進行分析,發現該序列含有真核生物啟動子的典型元件CAAT-box(19個)和TATA-box(6個),能夠與起始轉錄的轉錄因子結合;該區域存在AE-box、Box II、G-box、GTGGC-motif和Sp1等5個與光反應有關的元件;AP-2-like、CGTCA-motif(3個)、GARE-motif和TGA-element是與乙烯、茉莉酸、赤霉素和生長素相關的轉錄因子的結合位點;GCN4-motif和Skn-1-motif(4個)是與胚乳表達相關的順式作用元件;另外還存在其他轉錄因子結合的位點(見電子附表2)。
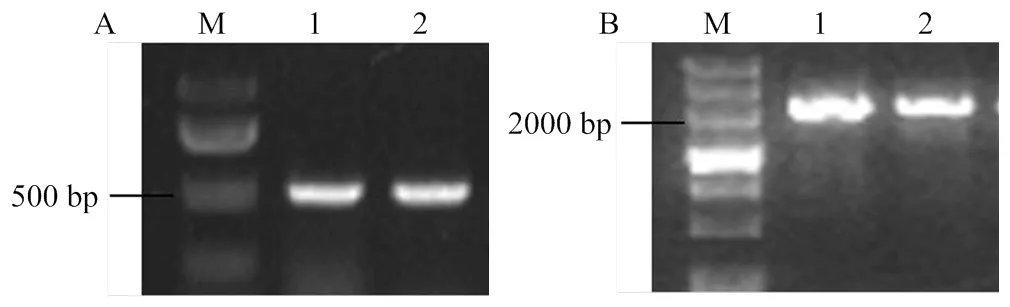
A:SiARGOS1的擴增,M:100 bp DNA marker;1:晉29A;2:K186;B:SiARGOS1啟動子的擴增,M:200 bp DNA marker;1:晉29A;2:K186
2.4 不同組織器官和不同激素條件下SiARGOS1的表達
在豫谷1號抽穗后7 d分別取其根、莖、葉和穗,提取總RNA、合成的cNDA經均一化、RT-PCR和實時定量PCR后,檢測在谷子抽穗期不同組織器官中的表達情況。結果表明,的RT-PCR(圖3-A)和實時定量PCR(圖3-B)結果基本一致,該基因在谷子抽穗期的根、莖、葉和穗中均有表達,在根中的表達量最大,莖和葉次之,而穗中的表達量最小(圖3-A)。

A:通過半定量PCR檢測SiARGOS1在不同組織中的表達;B:通過實時定量PCR檢測SiARGOS1在不同組織中的表達
通過熒光定量PCR檢測對不同激素響應表達。結果顯示,對IAA不敏感,但受ETH上調表達,在ETH處理1和3 h后表達有所上升,且上升水平基本沒有變化,隨著處理時間的推移,表達量進一步升高,在12 h表達量最高(圖4),說明該基因對生長素響應不敏感但受乙烯上調表達。
2.5 SiARGOS1的序列分析及標記開發
通過對19份谷子材料進行編碼區及其啟動子測序,發現有2份材料在該基因編碼區151 bp(起始密碼子83 bp)處存在一個SNP(C/G),導致該基因第28個氨基酸發生突變(Ala/Gly),該堿基差異導致酶切位點Ⅱ(CGˇCG)發生變化(CGCG/CGGG,后者序列Ⅱ不能識別),據此設計了一個CAPS標記(圖5)。用引物SiARGOS1對材料進行擴增,擴增長度為491 bp,擴增產物經Ⅱ酶切后,獲得2種基因型,一種為(CGCG)基因型,將其命名為Hap-Ag-C,酶切不能被切開,酶切產物片段大小仍為491 bp,另一種為(CGGG)基因型,將其命名為Hap-Ag-G,經酶切產生340和151 bp片段(圖6-A)。
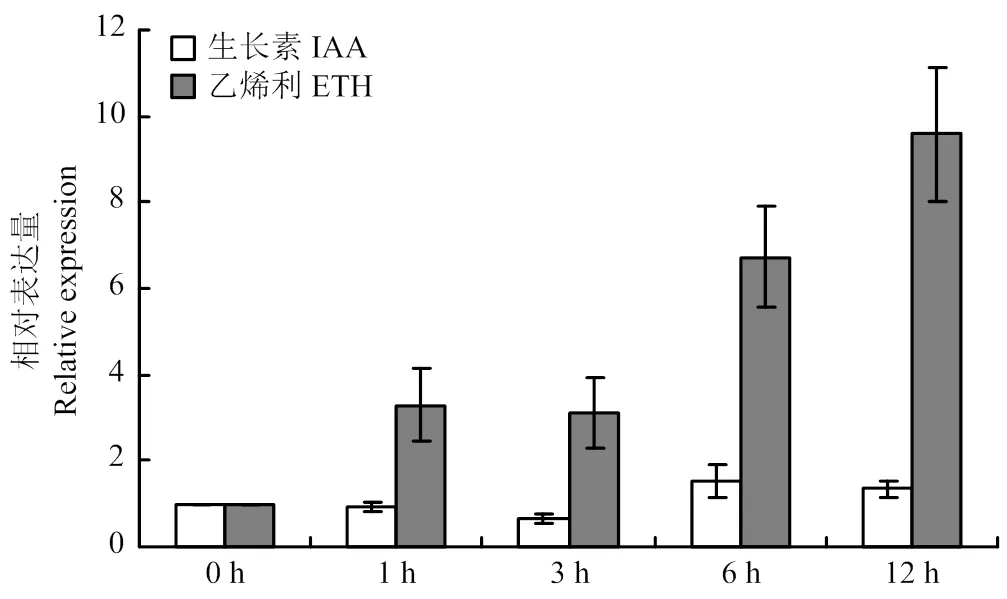
圖4 SiARGOS1對IAA和ETH的響應表達
序列分析表明啟動子區共存在19處SNP和2處插入和缺失(見電子附表3),根據-1 652—-1 651處(TA)2/3和-1 165—-1 163處(TCA)1/2的序列差異分別設計SSR引物AP-1和AP-2(圖5),用于啟動子區的分型檢測。AP-1(圖6-B)在不同品種的擴增條帶分別為206和208 bp,AP-2(圖6-C)在不同品種的擴增條帶分別為259和262 bp。
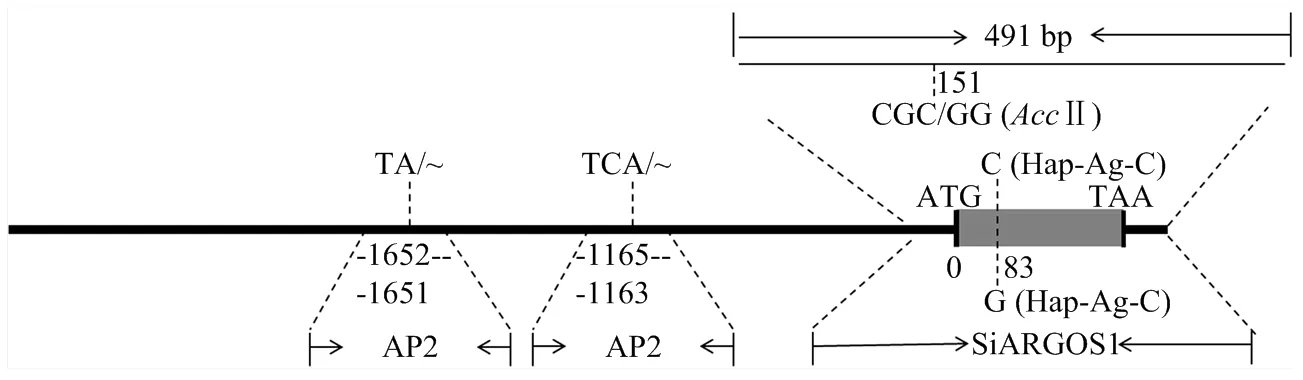
圖5 SiARGOS1的標記開發

A:SiARGOS1 SNP(C/G)位點限制性內切酶AccⅡ酶切位點的CAPS標記;M:DNA marker;1—6分別為:蒙選5084、長農35號、沙灣谷子、山東-5、晉29A、K186;B和C分別為SSR標記AP-1和AP-2,M:DNA marker;1—19分別為:矮寧黃、沙灣谷子、米優、河北十里香、張8311-13、ISE-4、冷生-1、品資15、錢串子、長農35號、山東-5、蒙選5084、PI614817、黑粘谷、茶淀谷、鐵8503、朝108,鵪鶉尾
2.6 功能標記驗證
用標記CPAs-Ⅱ、AP-1和AP-2對85份品種穗重(panicle weight,PW)、穗粒重(grain weight,GW)和千粒重(thousand-grain weight,TGW)等產量性狀進行檢測(表1)。用限制性酶Ⅱ開發的CPAS標記檢測編碼區151 bp(起始密碼子83 bp)SNP(C/G)位點,Hap-Ag-G基因型有9份,75份為Hap-Ag-C基因型,2種基因型間穗重、穗粒重和千粒重的差異均不顯著;用SSR標記AP-1檢測啟動子區-1 652—-1 651處(TA)2/32 bp的缺失,~基因型有42份,43份為TA基因型,2種基因型間穗重、穗粒重和千粒重的差異均不顯著;用SSR標記AP-2檢測啟動子區-1 165—-1 163處(TCA)1/23 bp的缺失,~基因型有58份,27份為TCA基因型,2種基因型間千粒重的差異均不顯著,但其穗重和穗粒重在2015和2016年兩年間的差異均達到了顯著水平。說明根據該處開發的SSR標記AP-2可作為功能標記用于優異等位變異的檢測,而位于該基因啟動子區-1 165—-1 163處(TCA)1/23 bp缺失的等位變異可能對谷子產量性狀有著重要的影響。
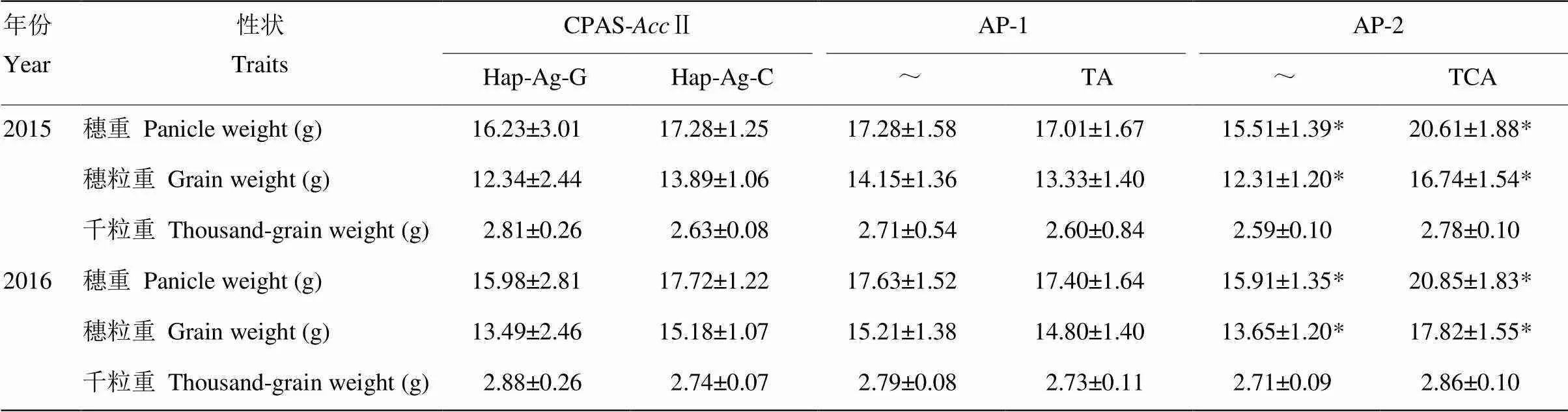
表1 85份谷子品種中不同分子標記檢測基因型與產量性狀相關性
*表示基因型間差異達到5%顯著水平
*indicates significant differences among genotypes at 0.05 probability level
3 討論
本研究通過對已有ARGOS蛋白保守結構域進行BLAST,共獲得6個谷子ARGOS成員,均具有ARGOS家族典型的保守OSR結構域,包含2個跨膜螺旋結構。用擬南芥ARGOS基因家族中4個基因的mRNA序列在phtozome進行BLAST,獲得谷子ARGOS基因家族的一種序列,經比對分析為,該基因蛋白與擬南芥ARGOS基因家族中的AtARGOS歸為一類,而的研究較該基因家族中另外3個成員最早也更為廣泛和深入,與其歸為一類的水稻[14]、玉米[13]和小麥[15]等均已報道,它們均參與信號轉導并對器官生長有促進作用[11],故對進行了深入的研究。結果顯示,該基因位于谷子第8染色體上,在基因組中僅有一個拷貝,并且編碼區內不含有內含子。擬南芥[9]、玉米[13]、水稻[14]、小麥[15]和大白菜[16]ARGOS基因也僅有一個拷貝并且不含有內含子,說明該類基因在植物中保守性。
在豫谷1號抽穗后7 d的根、莖、葉和穗中均有表達,在根中的表達量最大,莖和葉次之,而穗中的表達量最小,這與谷子功能基因網站中(http://structuralbiology.cau.edu.cn/SIFGD/gene_detail. php?gene=Si027037m)查詢的該基因組織表達特征基本一致,都是在根中表達量最高,穗部表達略有不同,這可能與不同生育期取樣有關;另外,該基因在不同植物組織器官的表達也不盡相同,擬南芥在根、莖、花、幼嫩的花環葉和果莢呈現低水平表達,但在成熟的葉中基本檢測不到[9];水稻在幼嫩的根、葉和授粉5 d的種子中表達量較高,而在莖、成熟葉和小穗中表達量較低[14]。小麥主要在莖部表達[15]。
通過啟動子預測發現的啟動子除了核心啟動元件CAAT-box和TATA-box以外,還包括與乙烯、茉莉酸、赤霉素和生長素等多種植物激素相關的順式作用元件調控元件AP-2-like[21]、CGTCA-motif[22]、GARE-motif[23]和TGA-element[24]。在擬南芥ARGOS基因家族中,ARGOS基因受生長素上調表達[9];由油菜素內酯誘導,這種誘導依賴于油菜素內酯受體BRI1[10];和通過乙烯誘導上調表達[11-12]。另外,在水稻[14]中受生長素上調表達,在玉米中卻受乙烯下調表達[25-26],而在小麥中又受生長素、乙烯、茉莉酸和赤霉素等多種植物激素誘導表達[15],因此,分別選用生長素和乙烯利處理生長10 d谷子幼苗,結果顯示對生長素不敏感,但受乙烯利上調表達。表明該基因家族中的不同基因受不同植物激素誘導表達,而且在不同物種中同一基因對不同激素的誘導表達也不同,或者在不同的物種中對植物激素存在一定的特異性,但最終都影響了植物器官大小的調控。另外,啟動子區還存在與光反應和胚乳表達相關的元件,但目前還未見與之相關的研究報道,有待于進一步的試驗驗證。
功能標記(functional marker,FM)是根據基因內部序列設計的,是一種區分和預測等位基因及相對性狀的分子標記[27]。水稻的5′調控區的一個單核苷酸多態性T/G與其落粒性高度相關[28],玉米控制株高和開花期的[29]和[30]、小麥中關于粒寬和光周期的[31]和[32]、控制番茄果實大小的[33]等基因都成功用于功能標記的研究。目前,谷子中定位了多個與千粒重、穗長等產量相關性狀QTL[3, 34],但對于產量性狀相關的特定基因克隆和功能標記開發目前尚未報道。根據及其啟動子區的位點差異開發了1個CAPS標記和2個SSR標記,都具有位點特異性、共顯性、操作簡便等特點。其中,CPAS-AccⅡ標記是根據基因起始密碼子83 bp處存在一個SNP(C/G)設計的,該處變異導致該基因第28個氨基酸發生突變(Ala/Gly),但該位點不在的保守ORS結構域內,2種基因型間穗重、穗粒重和千粒重的差異均不顯著;而根據啟動子-1 165—-1 163處(TCA)1/2的序列差異設計的SSR標記AP-2在2種基因型(~/TCA)間穗重和穗粒重差異均達到顯著水平,說明AP-2可作為功能標記,用于該基因與谷子產量性狀相關優異等位變異的鑒定。這也進一步證實谷子參與器官大小調控,最終影響谷子產量。
另外,用AP-2檢測基因啟動子區-1 165—-1 163處(TCA)1/23 bp的缺失,我們選取的85份谷子材料,~基因型有58份,27份為TCA基因型,其中攜帶有TCA基因型材料的穗重和穗粒重均顯著高于~基因型的材料,說明-1 165—-1 163處(TCA)1/23 bp的插入為優異等位變異。在中國的63份材料中,該變異在育成品種中出現的頻率高于地方種,主要分布在河北(61.54%)、山西(44.44%)、遼寧(57.14%)和山東(44.44%)等4個省份;在來源于美國和印度的材料中均沒有檢測到,而在來源于日本的材料中該變異出現的頻率為75%,說明在谷子選育過程中受到了一定的選擇,TCA基因型具有較高的谷子育種價值。
4 結論
獲得6個谷子ARGOS成員,均具有ARGOS家族典型的保守OSR結構域,并克隆了與擬南芥AtARGOS歸為一類的家族成員的編碼區及其啟動子序列。其啟動子區含有與植物激素、光周期及胚乳表達有關的元件,且在其編碼區和啟動子區分別開發了1個CAPS-Ⅱ標記和2個SSR標記,其中SSR標記AP-2可作為功能標記,用于該基因與谷子穗重和穗粒重等產量性狀相關優異等位變異的鑒定。該基因在谷子根、莖、葉和穗等器官中均有表達,對生長素不敏感,但受乙烯利上調表達,與小麥、短柄草和高粱ARGOS蛋白同源性最高。
致謝:感謝美國North Central Regional Plant Introduction Station(NCRPIS)為本研究提供谷子種質資源。
[1] Guo M, Rupe M A, Dieter J A, Zou J J, Spielbauer D, Duncan K E, Howard R J, Hou Z L, Simmonsa C R.affects plant and organ size in maize: implications for crop yield enhancement and heterosis., 2010, 22: 1057-1073.
[2] Zhang G Y, Liu X, Quan Z W, Cheng S F, Xu X, Pan S K, Xie M, Zeng P, Yue Z, Wang W L, Tao Y, Bian C, Han C L, Xia Q J, Peng X H, Cao R, Yang X H, Zhan D L, Hu J C, Zhang Y X, Li H N, Li H, Li N, Wang J Y, Wang C C, Wang R Y, Guo T, Cai Y J, Liu C Z, Xiang H T, S hi Q X, Huang P, Chen Q C, Li Y R, Wang J, Zhao Z H, Wang J. Genome sequence of foxtail millet () provides insights into grass evolution and biofuel potential., 2012, 30(6): 549-556.
[3] Jia G Q, Huang X H, Zhi H, Zhao Y, Zhao Q, Li W J, Chai Y, Yang L F, Liu K Y, Lu H Y, Zhu C R, Lu Y Q, Zhou C C, Fan D L, Weng Q J, Guo Y L, Huang T, Zhang L, Lu T T, Feng Q, Hao H F, Liu H K, Lu P, Zhang N, Li Y H, Guo E H, Wang S J, Wang S Y, Li J R, Zhang W F, Chen G Q, Zhang B J, Li W, Wang Y F, Li H Q, Zhao B H, Li J Y, Diao X M, Han B. A haplotype map of genomic variations and genome-wide association studies of agronomic traits in foxtail millet ()., 2013, 45: 957-961.
[4] Niklas K J.. Chicago: The University of Chicago Press. 1994.
[5] Mizukami Y. A matter of size: Developmental control of organ size in plant., 2001, 4: 533-539.
[6] Vernoux T, Autran D, Traas J. Developmental control of cell division pattern in the shoot apex., 2000, 43: 569-581.
[7] Beth A K. Making bigger plants: key regulators of final organ size. C, 2009, 12: 17-22.
[8] Rai M I, Wang X, Thibault D M, Kim H J, Bombyk M M, Binder M B, Shakeel S N, Schaller G E. Thegene family functions in a negative feedback loop to desensitize plants to ethylene., 2015, 15(1): 1-14.
[9] Hu Y X, Xie Q, Chua N H. Theauxin-inducible genecontrols lateral organ size., 2003, 15: 1951-1961.
[10] Hu Y X, Poh H M, Chua N H. Thegene regulates cell expansion during organ growth., 2006, 47: 1-9.
[11] Feng G P, Qin Z X, Yan J Z, Zhang X R, Hu Y X.regulates organ growth and final organ size in orchestration withand., 2011, 191(3): 635-646.
[12] Qin Z X, Zhang X, Zhang X R, Feng G P, Hu Y X. Theis involved in regulation of cell expansion during organ growth., 2014, 14(1): 1-11.
[13] Shi J R, Habben J E, Archibald R L, Drummond B J, Chamberlin M A, Williams R W, Renee Lafitte H, Weers B P. Overexpression of ARGOS genes modifies plant sensitivity to ethylene, leading to improved drought tolerance in bothand maize., 2015, 169: 266-282.
[14] Wang B, Sang Y L, Song J, Gao X Q, Zhang X S. Expression of a ricegene inpromotes cell division and expansion and increases organ size., 2009, 36: 31-40.
[15] Zhao Y, Tian X J, Li Y Y, Zhang L Y, Guan P F, Kou X X, Wang X B, Xin M M, Hu Z R, Yao Y Y, Ni Z F, Sun Q X, Peng H R. Molecular and functional characterization of wheatgenes influencing plant growth and stress tolerance., 2017, 8: 170.
[16] 王保. 大白菜基因的分離與功能分析. 中國農業科學, 2009, 42(6): 2068-2075.
Wang B. Isolation and functional characterization ofgene from Chinese cabbage., 2009, 42(6): 2068-2075. (in Chinese)
[17] Wang B, Zhou X C, Xu F, Gao J W. Ectopic expression of a Chinese cabbagegene inincreases organ size., 2010, 19: 461-472.
[18] Gu A X, Zhao J J, Li L M, Wang Y H, Zhao Y J, Hua F, Xu Y C, Shen S X. Analyses of phenotype andandexpression in a ploidy Chinese cabbage series derived from one haploid., 2016, 66(2): 161-168.
[19] 張一卉, 王彬, 李化銀, 王淑芬, 高玲, 王鳳德, 高建偉. 蘿卜基因的克隆及表達分析. 山東農業科學, 2014, 46(10): 1-5.
Zhang Y H, Wang B, Li H Y, Wang S F, Gao L, Wang F D, Gao J W. Isolation and expression ofgenes in radish., 2014, 46(10): 1-5. (in Chinese)
[20] 王夢穎, 晁躍輝, 叢麗麗, 楊青川, 康俊梅, 張鐵軍. 紫花苜蓿基因的克隆及對擬南芥的轉化. 中國草地科學, 2014, 36(4): 52-59.
Wang M Y, Chao Y H, Cong L L, Yang Q C, Kang J M, Zhang T J. Cloning ofgene from AlfalfaL.) and transformation of(L.) Heynh., 2014, 36(4): 52-59. (in Chinese)
[21] Licausi F, Ohme-Takagi M, Petata P. APETALA2/EthyleneResponsiveFactor(AP2/ERF)transcription factors:mediatorsofstressresponsesanddevelopmentalprograms., 2013, 199: 639-649.
[22] Rouster J, Leah R, Mundy J, Cameron-Mills V. Identification of a methyl jasmonate-responsive region in the promoter of a lipoxygenase 1 gene expressed in barley grain., 1997, 11(3): 513-523.
[23] Rogers J C, Lanahan M B, Rogers S W. The cis-acting gibberellin response complex in highalpha-amylase gene promoters. Requirement of a coupling element for high-level transcription., 1994, 105: 151-158.
[24] Xin S, Tao C C, Li H B. Cloning and functional analysis of the promoter of angene from., 2016, 11(9): e0161695.
[25] Shi J R, Drummond B J, Wang H Y, Archibald R L, Habben J E. Maize andARGOS proteins interact with ethylene receptor signaling complex, supporting a regulatory role for ARGOS in ethylene signal transduction., 2016, 171(4): 2783-2797.
[26] Shi J R, Gao H R, Wang H Y, Renee Lafitte H, Rayeann L, Archibald R L, Yang M Z, Hakimi S M, Mo H, Habben J E. ARGOS8 variants generated by CRISPR-Cas9 improve maize grain yield under field drought stress conditions., 2016, 17: 1-10.
[27] Andersen J R, Lübberstedt T. Functional markers in plants., 2003, 8(11): 554-560.
[28] Saeko K, Takeshi I, Shao Y L, Kaworu E, Yoshimichi F, Takuji S, Masahiro Y. An SNP caused loss of seed shattering during rice domestication., 2006,312: 1392-1396.
[29] Doebley J, Stec A, Gustus C.and the origin of maize: evidence for epistasis and the evolution of dominance., 1995, 141(1): 333-346.
[30] Thornsberry J M, Goodman M M, Doebley J, Kresovich S, Nielsen D, Buckler E S.polymorphisms associate with variation in flowering time., 2001, 28(3): 286-289.
[31] Su Z Q, Hao C Y, Wang L F, Dong Y C, Zhang X Y. Identification and development of a functional marker ofassociated with grain weight in bread wheat (L.)., 2011, 122: 211-223.
[32] Guo Z A, Song Y X, Zhou R H, Ren Z L, Jia J Z. Discovery, evaluation and distribution of haplotypes of the wheatgene., 2010, 185(3): 841-851.
[33] Nesbitt T C, Tanksley S D. Comparative sequencing in the genus Lycopersicon: implications for the evolution of fruit size in the domestication of cultivated tomatoes., 2002, 162(1): 365-379.
[34] Fang X M, Dong K J, Wang X Q1, Liu T P2, He J H, Ren R Y, Zhang L, Liu R, Liu X Y, Li M, Huang M Z, Zhang Z S, Tianyu Yang T Y. A high density genetic map and QTL for agronomic and yield traits in Foxtail millet [(L.) P. Beauv.]., 2016, 17: 336-347.
(責任編輯 李莉)
Molecular Cloning, Expression Analysis and Development of Functional Markers forGene in Foxtail millet
Wang ZhiLan1, Du XiaoFen1,Wang Jun1, Yang HuiQing1, Wang XingChun2, Guo ErHu1, Wang YuWen1, YuAN Feng1, Tian Gang1, Liu Xin1, Wang QiuLan1, Li HuiXia1, Zhang LinYi1, Peng ShuZhong1
(1Millet Research Institute, Shanxi Academy of Agricultural Sciences/Shanxi Key Laboratory of Genetic Resources and Breeding in Minor Crops, Changzhi 046011, Shanxi;2College of Life Science, Shanxi Agricultural University, Taigu 030800, Shanxi)
The homologous genes of(auxin-regulated gene involved in organ size) family were isolated from foxtail millet, which were induced expression by hormone and participate in the regulation of plant organ size. Bioinformatics, including alignment of amino acid sequences and promoter cis acting elements, and the expression pattern in different tissues and plant hormones were analyzed. Functional markers were developed from sequences analysis of gene encoding region and promoter, which will play an important role in genetic improvement of yield traits, accelerate breeding process and increase yield of foxtail millet.The number of ARGOS family members and the sequence of the ARGOS family in foxtail millet were analyzed through BLAST of conserved domain with the existing ARGOS in other plants. The encoding region and promoter sequences ofgene, one of the family members ofin foxtail millet, were obtained with homologous cloning method. The promoter cis acting elements ofwas analyzed by the bioinformatics analysis. Expression patterns in different tissues and plant hormone ofwere analyzed using real-time PCR. Functional markers were developed from sequence analysis of SNP and insertion/deletion in gene encoding region and promoter. Functional markers of elite alleles of yield related traits were tested using data analysis of significant differences between genotypes associated with the yield traits such as panicle weight, grain weight and thousand-grain weight in 85 cultivars.A total of six ARGOS family members were found to have a conserved OSR (Organ Size Related) domain consisting of two transmembrane helical structures and a highly conserved proline-rich motif in foxtail millet. the open reading frame (ORF) and the promoter of, one of the family members homologous towere cloned. Sequence analysis showed that the ORF ofon chromosome 8 encoding a putative protein composed of 113 amino acids was 342 bp in length, without intron. The promoter contains a variety of regulation related components including auxin, ethylene and other plant hormone with 2 109 bp in length.is expressed in all organs of foxtail millet, at high levels in root, whereas at lowest level in panicle. The gene was insensitive to indole-3-acetic acid (IAA), but was up-regulated by ethephon (ETH). On the basis of the alignment of genegenomic DNA sequence, CAPS-Ⅱmarker was developed on the missense polymorphism site (C/G→Ala/Gly) at the 150 bp of the encoding region, two SSR markers, AP-1 and AP-2, were developed at -1652--1651(TA)2/3and -1165--1163(TCA)1/2of promoter, respectively. No significant association was found among the yield associated traits such as panicle weight, grain weight and thousand-grain weight with CAPS-Ⅱ and AP-1 in 85 cultivars. However, AP-2 proved to be highly correlated with panicle weight and grain weight in 85 cultivars, in addition to thousand-grain weight. The average values of panicle weight for two genotypes were 15.52 g and 20.61 g, respectively, while the ones of grain weight for two genotypes were 12.24 g and 16.74 g, respectively.Six ARGOS family members were found in foxtail millet , all of which had conserved OSR domain. The open reading frame (ORF) ofhomologous to, is 342 bp in length without intron. The SSR marker AP-2, which was developed in the promoter region of thegene, could be used as functional marker for the selection of superior allelic variation in yield traits such as panicle weight and panicle weight of foxtail millet varieties.
foxtail millet;;promoter; expression analysis; functional marker
2017-04-17;
山西省重點科技創新團隊項目(2015013001-09)、山西省農業科學院種業發展專項(2015ZYZX-04)、山西省農業科學院科技自主創新能力提升工程項目(2016ZZCX-09)、山西省青年基金(2015021143)、山西省農業科學院農業科技創新研究課題(ZDSYS1504)
接受日期:2017-05-03
聯系方式:王智蘭,Tel:15234582699;E-mail:wangyan11111ai@163.com。杜曉芬,Tel:18636509393;E-mail:dxf6285210@126.com。王智蘭和杜曉芬為同等貢獻作者。通信作者王軍,Tel:13333550810;E-mail:128wan@163.com。通信作者郭二虎,Tel:13994673899;E-mail:guoerhu2003@163.com

