黃芪和當歸配伍對小鼠造血干細胞衰老模型細胞增殖的影響
張珂勝 陳凌波 黃小平 鄧常清
[摘要]研究黃芪和當歸配伍對小鼠造血干細胞衰老模型細胞增殖能力的影響及其作用機制。大鼠灌胃給藥制備含藥血漿后,體外培養小鼠造血干細胞,實驗設空白對照組、模型組、空白血漿組、芪歸1∶1血漿組、芪歸10∶1血漿組、單用當歸血漿組、單用黃芪血漿組,以三丁基過氧化氫(tBHP)誘導小鼠造血干細胞衰老,以含藥血漿作用于造血干細胞衰老模型。SAβ半乳糖苷酶染色法檢測細胞衰老率,流式細胞術檢測細胞周期分布,RTPCR檢測Cyclin D1,P21,P53 mRNA表達,Western blot檢測Cyclin D1蛋白表達。結果顯示,tBHP作用于造血干細胞后,可使衰老細胞增加,細胞增殖能力降低,G0/G1期細胞增多,G2/M+S期細胞減少,同時伴Cyclin D1表達降低,P53,P21表達增強。黃芪、當歸、芪歸1∶1配伍、芪歸10∶1配伍含藥血漿可降低衰老細胞陽性率,使G0/G1期細胞減少,G2/M+S期細胞增加,細胞增殖能力增強,并使Cyclin D1基因和蛋白表達增強,P53,P21基因表達降低。以上效應以芪歸1∶1配伍的作用為強。結果表明,tBHP可使造血干細胞衰老,細胞增殖能力降低。黃芪、當歸及其配伍可抑制造血干細胞衰老,促進造血干細胞增殖和細胞周期轉換,以芪歸1∶1配伍的作用為強。其作用機制可能與其上調細胞周期正性調節因子表達,下調細胞周期負性調節因子表達,從而促進細胞由靜止期進入增殖期有關。
[關鍵詞]造血干細胞; 衰老; 細胞增殖; 黃芪; 當歸; 細胞周期
[Abstract]The aim is to study the effect and its mechanism of Astragalus Radix combined with Angelicae Sinensis Radix on the proliferation of hematopoietic stem cells(HSCs) in senescence model After drugcontaining plasma of rats was prepared via intragastric administration, HSCs of mice were cultured in vitro, and then they were divided into blank control group, model group, blank plasma group, Astragalus Radix + Angelicae Sinensis Radix 1∶1 group and 10∶1 group, Angelicae Sinensis Radix plasma group, and Astragalus Radix plasma group HSCs senescence model was induced by using tertbutyl hydrogen peroxide(tBHP), and intervened by drugcontaining plasma Cells senescence rate was tested by SAβgalactosidase staining method; cell cycle distribution was determined by flow cytometry; Cyclin D1, P21, and P53 mRNA were measured with RTPCR, and Cyclin D1 protein expression was measured by Western blot Results showed that after being induced by tBHP, senescence rate of HSCs was increased; cell proliferation ability was decreased; count of G0/G1 phase cells was increased; count of G2/M+S phase cells was reduced; Cyclin D1 expression was downregulated while P53, P21 expression was upregulated, which were reversed by Astragalus Radix + Angelicae Sinensis Radix 1∶1 and 10∶1, single Angelicae Sinensis Radix, and single Astragalus Radix plasma Furthermore, the above effects were most obvious in Astragalus Radix+Angelicae Sinensis Radix 1∶1 group These results suggested that tBHP can promote HSCs senescence and reduce cell proliferation ability Angelicae Sinensis Radix, Astragalus Radix and their combinations can inhibit HSCs senescence, promote HSCs proliferation as well as cell cycle conversion; moreover, the effects of 1∶1 Astragalus Radix+Angelicae Sinensis Radix were strongest The mechanisms may be related to upregulating the expression of cell cycle positive regulator, downregulating the expression of cell cycle negative regulator, thus promoting the cells to enter the proliferation phase from the stationary phase.endprint
[Key words]hematopoietic stem cells; senescence; proliferation; Astragalus Radix; Angelicae Sinensis Radix; cell cycle
造血干細胞(hematopoietic stem cells,HSCs)是機體內具有自我更新和多向分化潛能的一類成體干細胞,是所有血細胞的始祖細胞,能分化為成熟血細胞以及某些非造血細胞[1]。既往研究表明,HSCs衰老可導致其增殖和分化功能低下,使血細胞發生失去正常調控,是多種造血功能障礙性疾病的重要原因。增齡和多種原因如放射線、抗腫瘤化療藥物等可引起骨髓HSCs衰老,導致其增殖和分化功能低下,從而使造血功能降低。因此,延緩HSCs衰老是防治骨髓造血功能低下的重要手段[2]。由李東垣創立的黃芪當歸5∶1配伍的當歸補血湯(Danggui Buxue Tang,DBT)是中醫治療血虛證的經典方,有益氣補血的功效,具有促進造血的作用[3],可用于各種原因貧血的治療。研究表明,當歸黃芪在1∶5~5∶1配伍均對促進造血功能的恢復具有協同作用[4]。DBT的補血作用主要來源于當歸 [5]。作者前期研究發現,黃芪和當歸配伍比例在5∶1,25∶1,1∶1,1∶25,1∶5,1∶10時,可升高外周血細胞數,增加血清造血生長因子含量、骨髓有核細胞數和骨髓造血組織面積,降低脾指數,尤以黃芪當歸1∶1,1∶25,1∶5配伍時發揮促造血的作用最強[6]。但黃芪當歸配伍促造血作用的機制尚未完全弄清。為進一步明確黃芪和當歸配伍促造血的作用機制,作者采用體外造血干細胞衰老模型,比較黃芪當歸不同配伍對細胞增殖及其相關基因表達的影響,以明確黃芪當歸配伍促造血作用的合理配伍關系,探討其作用機制,為黃芪當歸配伍的合理應用提供實驗依據。
1材料
11藥物黃芪,產地內蒙古。當歸,產地甘肅。由湖南中醫藥大學第一附屬醫院藥劑科統一購進并經左亞杰教授鑒定。
12動物清潔級SD雄性大鼠,體質量(200±20) g,動物質量合格證號SCXK(湘)20110003。C57BL/6小鼠,6~8 周齡,雌雄各半,體質量20~25 g,動物質量合格證號SCXK(湘)20120001。動物由湖南斯萊克景達實驗動物有限公司提供。實驗場地為湖南中醫藥大學動物實驗中心,場地許可證號SCXK(湘)20130005。
13試劑胎牛血清(美國Hyclone,批號NWK0489);IMDM培養液(美國Hyclone,批號NAG1440);磷酸緩沖鹽溶液(phosphate buffer saline,PBS,pH 74)(吉諾生物醫藥技術有限公司,批號GNM20012);Ficoll淋巴細胞分離液(天津灝洋生物有限公司,批號YZB/津15952011);牛血清白蛋白(bovine serum albumin,BSA,美國MP Biomedicals,批號0218054210);抗PE磁珠AntiPE MicroBeads(德國 Miltenyi 公司,批號130048701);三丁基過氧化氫(Tertbutyl hydroperoxide,tBHP)(美國Sigma,批號STBD5969V);衰老相關β半乳糖苷酶(senescence assiociated βgalactosidase,SAβgal)染色試劑盒(碧云天生物有限公司,批號CO602);細胞周期檢測試劑盒(天津三箭生物技術有限公司,批號CY2001O);細胞增殖及細胞毒性檢測(CCK8法)試劑盒(武漢博士德生物有限公司,批號AR1160500);Sca1PE抗體(德國 Miltenyi 公司,批號130102297);Trizol Reagent(Invitrogen Life Technologies,批號15596026);First Strand cDNA Synthesis Kit試劑盒(TOYOBO公司);Taq DNA Polymerase(Thermo scientific,批號114675526);50×TAE(ASPEN,批號114675526);瓊脂糖(ASPEN,批號111860);GoldView I型核酸染色劑(Life sciences,批號20150810);6×Loading Buffer(Takara公司,批號A6701A);引物由Invitrogen Biotechnology Co LTD中國公司合成,引物序列為GAPDH:上游引物5′GAGGCCGGTGCTGAGTATGT3′,下游引物5′ACAGTCTTCTGGGTGGCAGTG3′,299 bp;Cyclin D1:上游引物5′GGATGAGAACAAGCAGACCATC3′,下游引物5′AGAAAGTGCGTTGTGCGGTA3′,186 bp;P53:上游引物5′TAAACGCTTCGAGATGTTCCG3′,下游引物5′AGCAGTTTGGGCTTTCCTCC3′,149 bp;P21:上游引物5′GCTGCCCAAGGTCTACCTGA3′,下游引物5′CAATCTGCGCTTGGAGTGATAG3′,244 bp。SDSPAGE凝膠制備試劑盒(ASPEN,批號114717460);BCA蛋白質濃度測定試劑盒(ASPEN,批號114675524);RIPA總蛋白裂解液(ASPEN,批號114675671);ECL化學發光檢測試劑盒(ASPEN,批號114717172);磷酸化蛋白酶抑制劑(ASPEN,批號165482142);兔抗小鼠GAPDH單克隆抗體(Abcam公司,批號ab37168);兔抗小鼠Cyclin D1單克隆抗體(Abcam公司,批號ab134175);過氧化物酶標記羊抗兔二抗(KPL公司,批號150361);045 μm PVDF膜(MilliPore公司,批號IPVH00010);蛋白Marker(Thermo公司,批號00289411)。endprint
14儀器磁珠分選器MiniMACS Starting Kit(德國Miltenyi公司,批號130090312);流式細胞儀(美國BectonDickinson公司);酶標儀(奧地利);CO2培養箱(美國);PCR儀(杭州博日科技);電泳儀(北京六一儀器廠);轉移電泳槽(北京六一儀器廠);垂直電泳槽(北京六一儀器廠);酶標儀(Diatek公司)。
2方法
21藥物及含藥血漿制備設立黃芪、當歸、黃芪當歸不同比例(10∶1,1∶1)配伍。稱取藥材,以水回流法提取3次,第1次加入8倍量水,加熱沸騰2 h。后2次加入6倍量水,加熱沸騰提取1 h,冷卻后傾出水溶液。合并3次水提液過濾后濃縮成質量濃度分別為:黃芪05 g·mL-1(生藥)、當歸05 g·mL-1(生藥)、黃芪當歸不同比例配伍19 g·mL-1(生藥)。各藥液加入01%的苯甲酸鈉,分裝4 ℃冷藏備用。
含藥血漿制備:參照以往的方法[7],清潔級SD大鼠50只,隨機分為5組,每組10只,空白組(予等量雙蒸水)、單用黃芪組(10 g·kg-1)、單用當歸組(10 g·kg-1)、黃芪當歸1∶1配伍組(芪19 g·kg-1 +歸19 g·kg-1)、黃芪當歸10∶1配伍組(芪345 g·kg-1 +歸35 g·kg-1),灌胃給藥,連續給藥7 d后,于末次給藥后2 h腹主動脈取血,以2%EDTA2Na抗凝,3 000 r·min-1離心15 min,取血漿即為含藥血漿或空白血漿,將同組各動物血漿等量混合,分裝后-70 ℃保存。
22小鼠Sca1+HSCs分離和培養參照文獻方法[8]。小鼠處死后以75%乙醇浸泡5 min,無菌條件下取出股骨和脛骨。用PBS[含2 mmol·L-1乙二胺四乙酸(EDTA)、05%BSA]反復沖洗骨髓腔,通過4號針頭制備成單細胞懸液。將細胞懸液移至離心管中離心(3 000 r·min-1,15 min)后棄上清,加PBS制成細胞懸液。將細胞懸液緩緩加入到盛有5 mL的Ficoll淋巴細胞分離液離心管中,2 000 r·min-1離心20 min,輕輕吸取中間細胞層至新離心管中,離心后以PBS洗滌3次,最后以PBS懸浮細胞,即得骨髓單個核細胞(bone marrow nucleated cells,MNCs)。
將上述分離的MNCs進行免疫標記:取MNCs加入90 μL PBS緩沖液(含2 mmol·L-1 EDTA,05%BSA,pH 74)和10 μL Anti Sca1PE抗體標記細胞,4 ℃孵育10 min。 離心棄上清,加入80 μL PBS緩沖液和20 μL AntiPE MicroBeads,4 ℃孵育20 min。離心棄上清,以05 mL PBS緩沖液重懸細胞,加入磁場分離柱內,流出道收集未標記細胞(即Sca1-細胞),05 mL緩沖液(PBS緩沖液加入2 mmol·L-1 EDTA,05%BSA,pH 72)洗柱3次,陽性細胞會留滯在柱內,其他細胞流出分選柱。取下分選柱,加入05 mL緩沖液(同上)沖出標記細胞(即Sca1+ HSCs)。分別收集分選前及分選后的細胞各1×106個,流式細胞儀檢測分選前后細胞的Sca1+陽性率。分選前MNCs的Sca1+細胞為17%,分離純化后 Sca1+ 細胞純度為892%。表明經過磁珠分選后Sca1+HSCs純度遠高于分選前。
將洗滌后的HSCs加10 mL培養液(含10%胎牛血清的IMDM培養基,100 U·mL-1青霉素,100 g·L-1鏈霉素),接種培養瓶內,于37 ℃ 5%CO2孵箱培養。每2 d換液1次。
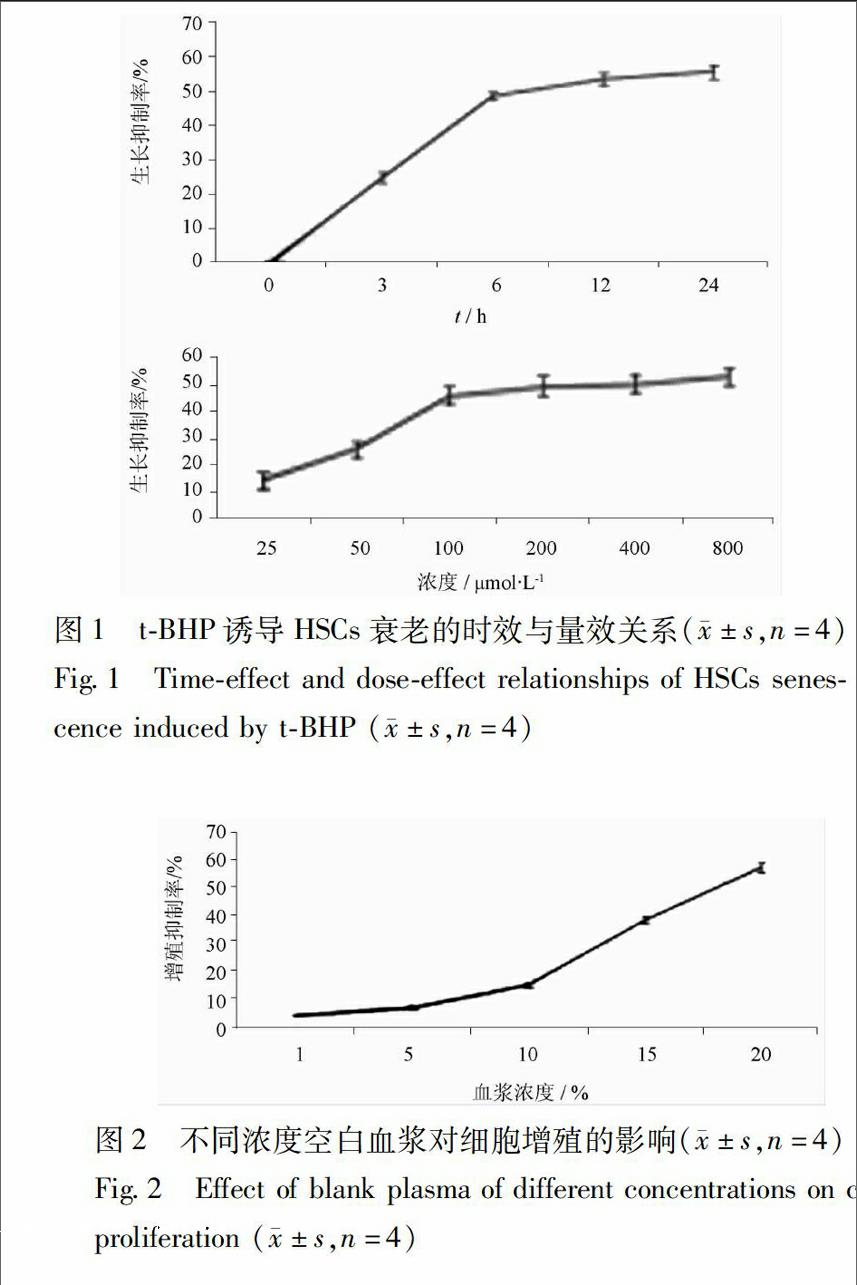
23tBHP誘導的Sca1+HSCs衰老模型的建立tBHP誘導Sca1+ HSCs衰老的時效關系:參照文獻方法[9]。實驗用HSCs傳代細胞4~6代。將細胞接種于96孔板,用無血清培養基培養12 h使細胞生長同步化于G0期后,換成含tBHP(終濃度100 μmol·L-1)的IMDM完全培養基,1×105個細胞/100 μL/孔,繼續培養0,3,6,12,24 h后以CCK8試劑測定450 nm吸光度A,計算tBHP對HSCs生長的抑制率,抑制率(IR)=(1-A實驗組/A空白組)×100%。以確定tBHP對HSCs損傷的合適時間,實驗重復3次。
tBHP誘導Sca1+ HSCs衰老的量效關系:在確定tBHP誘導細胞衰老的合適時間(作用6 h)后,測定tBHP致細胞衰老的量效關系。實驗用HSCs傳代細胞4~6代。將細胞接種于96孔板,使細胞生長同步化于G0期后,分別換成含不同終濃度
tBHP(0,25,50,100,200,400,800 μmol·L-1)的IMDM完全培養基,1×105個細胞/100 μL/孔,繼續培養6 h后,同上采用CCK8試劑測定tBHP對HSCs生長的抑制率,以確定tBHP引起HSCs衰老的合適濃度,實驗重復4次。
衰老細胞的鑒定:采用衰老相關β半乳糖苷酶染色法鑒定。陽性細胞胞質呈藍色,陰性細胞不著色[10]。計數陽性細胞并計算陽性細胞率,陽性細胞率=(陽性細胞數/細胞總數)×100%。
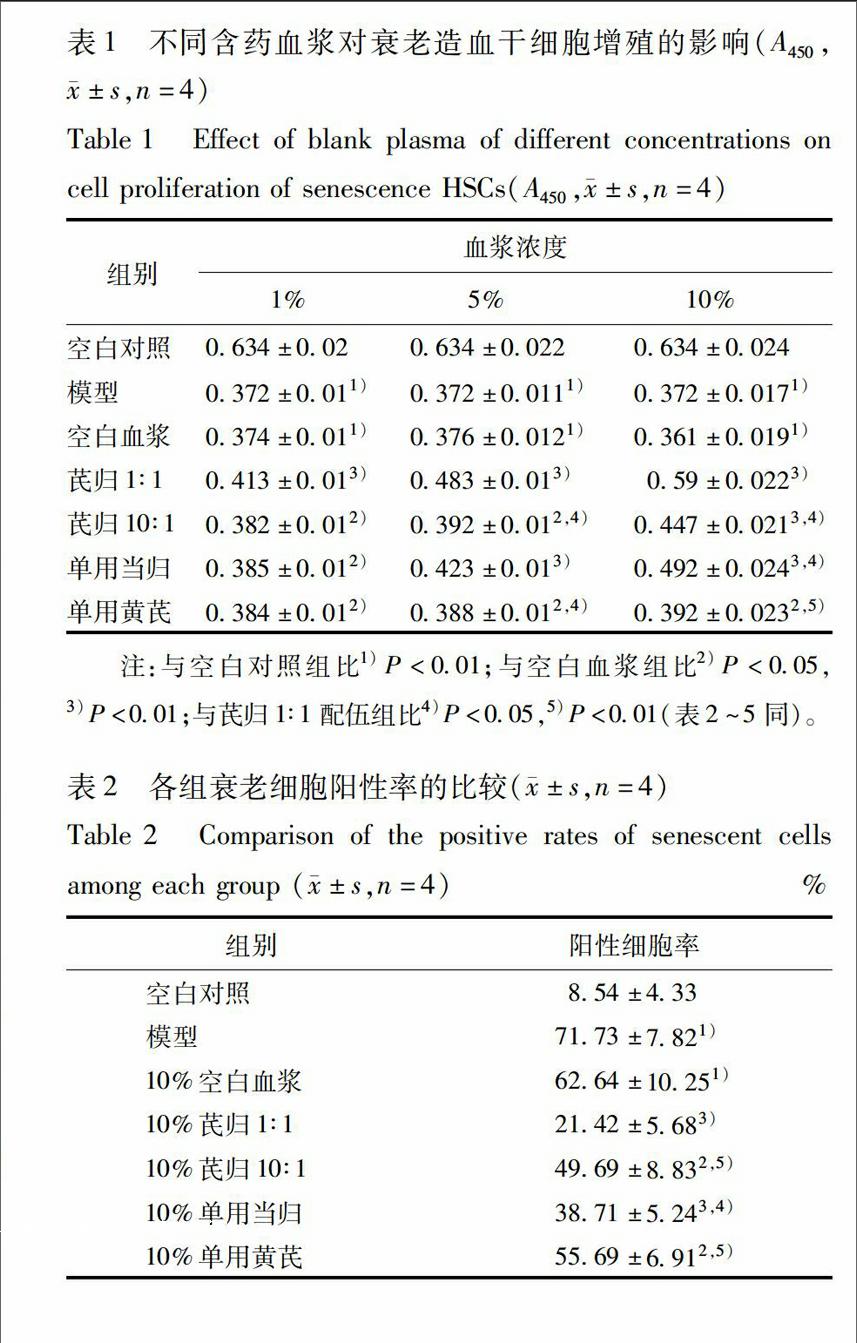
24各含藥血漿促衰老Sca1+ HSCs增殖實驗空白血漿的細胞毒實驗:運用CCK8法測定細胞增殖能力以反映空白血漿對細胞的毒性。實驗用傳代細胞4~6代。將細胞接種于96孔培養板,1×105個/100 μL/孔,使細胞生長同步化于G0期,然后分別加入不同終濃度空白血漿(0%,1%,5%,10%,15%,20%),培養24 h后,以CCK8法測定,計算空白血漿對細胞生長的抑制率,抑制率(inhibition ratio,IR)=(1-A實驗組/A空白組)×100%,取抑制率小于20%的血漿濃度作為無細胞毒性的血漿濃度[7]。
各含藥血漿促HSCs衰老模型細胞增殖和細胞周期測定:在確定無細胞毒性血漿濃度(不超過10%)及tBHP誘導細胞衰老的最佳時間為6 h和最佳濃度為100 μmol·L-1后,進行各含藥血漿對細胞增殖能力和細胞周期影響的實驗。實驗分為無血漿空白對照組、模型組、空白血漿組、芪歸1∶1組、芪歸10∶1組、單用當歸組、單用黃芪組。同前用HSCs傳代細胞4~6代。常規傳代培養后,加入不同濃度含藥血漿(0%,1%,5%,10%)和tBHP后培養6 h,按CCK8法測定450 nm的A以反映細胞增殖活性。endprint
各組細胞同上處理后以SAβ半乳糖苷酶染色,倒置顯微鏡下計數400個細胞,計算衰老細胞陽性率=(陽性細胞數/細胞總數)×100%。
運用流式細胞分選術測定細胞周期。離心收集各組細胞1×106個,PBS洗滌1次,70%冰乙醇固定過夜,100 μL牛胰核糖核酸酶(1 g·L-1)37 ℃孵育30 min。 孵育后用碘化丙啶(propidium iodide,PI)1 mL(用001 mol·L-1 PBS 配制終濃度50 mg·L-1的PI工作液)4 ℃避光30 min染色,測定樣本細胞數不少于2×104個。計數G0期、G1期、S期、M期細胞百分比。
25RTPCR法測定Cyclin D1,P53,P21 mRNA的表達收集各組細胞,以Trizol試劑提取RNA,以紫外分光光度法測定A260和A280比值在18~22,說明RNA純度高,無蛋白污染。取2 μg RNA采用First Strand cDNA Synthesis Kit試劑盒進行cDNA合成。然后進行PCR反應,循環次數40次。取10 μL PCR產物進行瓊脂糖凝膠電泳,凝膠成像分析系統對各目的條帶進行掃描,用Quantity One軟件(BioRad公司)分析各條帶OD值。計算各目的基因與內參GAPDH的OD比值作為目的基因的相對表達量。
26Western blot法測定Cyclin D1蛋白表達細胞處理同前。收集各組細胞,以PBS洗滌,以總蛋白提取試劑提取細胞總蛋白。BCA法測定蛋白濃度,將各樣品蛋白濃度調整一致,加入適量5×蛋白上樣緩沖液,95~100 ℃沸水浴5 min,冷卻后備用。然后進行SDSPAGE電泳。電轉法轉膜。將完成轉移的PVDF膜以封閉液封閉,再加入用TBST(含5%脫脂奶粉)稀釋的兔抗鼠一抗(GAPDH一抗1∶1萬稀釋,Cyclin D1一抗1∶1萬稀釋),4 ℃孵育過夜。TBST洗3次,加入TBST(含5%脫脂奶粉)稀釋的羊抗兔二抗(1∶1 000稀釋),室溫孵育30 min,TBST洗4次。以ECL化學發光試劑進行發光。AlPhaEaseFC圖像處理系統分析目標條帶的累積光密度值(integrated optical density,IOD)。以目的蛋白與GAPDH的IOD比值作為該目的蛋白的相對表達量。
27統計方法采用SPSS 160軟件進行統計分析,實驗結果以±s表示,多組間比較采用單因素方差分析。組間兩兩比較方差齊者用LSD檢驗,方差不齊者用Dunner T3檢驗。以P<005表示差異有統計學意義。
3結果
31tBHP誘導的造血干細胞衰老模型的建立tBHP誘導后,隨培養時間的延長,tBHP對細胞增殖的抑制作用逐漸增強,到6 h抑制率達(4863±105)%,其后抑制率緩慢上升;隨著tBHP濃度增加,細胞生長抑制率逐漸增強,當終濃度為100 μmol·L-1時,細胞生長抑制率為48%,其后生長抑制率緩慢上升。由此確定tBHP誘導細胞衰老(生長抑制)的最佳作用時間和濃度分別為6 h和100 μmol·L-1,見圖1。
32空白血漿的細胞毒實驗空白血漿濃度低于10%時細胞增殖抑制率小于20%。因此,取抑制率小于20%的血漿濃度(1%,5%,10%)作為無細胞毒性的血漿濃度,見圖2。
33各含藥血漿對細胞增殖的影響隨著含藥血漿濃度的增加,其促進細胞增殖活性逐漸增強,呈量效關系。與空白對照組比較,模型組細胞增殖活性顯著降低(P<001)。與空白血漿組比較,芪歸1∶1配伍組、10∶1配伍組、單用黃芪組、單用當歸組不同濃度含藥血漿細胞增殖活力顯著增強(P<005,P<001),尤其在含藥血漿濃度為10%時,其細胞增殖力顯著高于空白血漿組(P<001)。與芪歸1∶1配伍組比較,芪歸10∶1配伍組、單用黃芪組、單用當歸組在5%~10%含藥血漿濃度時,細胞增殖活性顯著低于芪歸1∶1配伍組(P<005,P<001),表明芪歸1∶1配伍組含藥血漿促衰老造血干細胞增殖的活性強于芪歸10∶1配伍組、單用黃芪組與單用當歸組,見表1。
34各含藥血漿對細胞衰老的影響與空白對照組比較,模型組和空白血漿組衰老細胞陽性率顯著高于空白對照組(P<001)。與空白血漿組比較,芪歸1∶1配伍、10∶1配伍、單用黃芪、單用當歸10%含藥血漿衰老細胞陽性率顯著降低(P<005,P<001)。與芪歸1∶1比較,芪歸10∶1配伍、單用黃芪、單用當歸組衰老細胞陽性率顯著增加(P<005,P<001),見表2。
35各含藥血漿對細胞周期的影響與空白對照組比較,模型組和空白血漿組G0/G1期細胞顯著增多(P<001),G2/M+S期細胞顯著減少(P<001)。與空白血漿組比較,芪歸1∶1配伍組G0/G1期細胞顯著減少(P<001),G2/M+S期細胞顯著增加(P<001)。與芪歸1∶1配伍組比較,芪歸10∶1配伍組和單用黃芪組G0/G1期細胞顯著增多(P<005,P<001),G2/M+S期細胞顯著減少(P<005,P<001),單用當歸組與芪歸1∶1配伍組比較,差異無顯著性,見表3。
36各含藥血漿對Cyclin D1,P53,P21 mRNA表達的影響與空白對照組比較,模型組和空白血漿組Cyclin D1表達顯著降低(P<001),P53,P21表達顯著增強(P<001)。與空白血漿組比較,芪歸1∶1配伍組、芪歸10∶1配伍組、單用黃芪組、單用當歸組Cyclin D1表達均顯著增強(P<001),P53,P21表達均顯著降低(P<005,P<001)。與芪歸1∶1配伍組比較,芪歸10∶1配伍組、單用當歸組、單用黃芪組Cyclin D1表達均顯著低于芪歸1∶1配伍組(P<001),P53,P21表達均顯著高于芪歸1∶1配伍組(P<001),見表4,圖3。
37各含藥血漿對Cyclin D1蛋白表達的影響與空白對照組比較,模型組和空白血漿組Cyclin D1蛋白表達顯著降低(P<001)。與空白血漿組比較,芪歸1∶1配伍組、芪歸10∶1配伍組、單用當歸組、單用黃芪組Cyclin D1蛋白表達均顯著增強(P<001)。與芪歸1∶1配伍組相比較,芪歸10∶1配伍組、單用當歸組、單用黃芪組Cyclin D1蛋白表達均顯著低于芪歸1∶1組(P<005,P<001),見表5,圖4。endprint
MMarker;1空白對照組;2模型組;3空白血漿組;4芪歸1∶1組;5芪歸10∶1組;6單用當歸組;7單用黃芪組。
4討論
骨髓造血干細胞(hematopoietic stem cell,HSCs)是血液譜系中最重要的細胞,具有高度的自我更新、多向分化、跨系分化與重建長期造血的潛能,其作為一種組織特異性干細胞,通過不對稱分裂一方面維持自身數量的相對穩定,另一方面生成多系或和單系造血祖細胞,以維持機體的正常造血功能。機體代謝過程中產生的活性氧分子、紫外線照射、電離輻射以及大多數化療藥物均可誘導造血干細胞DNA損傷,這些損傷最終導致造血干細胞的衰老[11]。造血干細胞衰老可導致機體造血功能障礙,且組織修復能力降低、免疫功能下降。tBHP在體外可誘導HSC衰老,表現為細胞增殖和多向分化能力降低,處于細胞周期活躍增殖的細胞數量減少,細胞衰老重要標志SAβgal表達增加[9]。本研究采用tBHP在體外成功誘導了HSCs衰老,與文獻報道一致。
DBT是補氣生血的經典方,由黃芪當歸5∶1配伍而成,對多種原因的造血功能障礙具有良好的治療作用。現代藥理也表明,DBT組成藥物黃芪和當歸有效成分黃芪多糖與當歸多糖可延緩造血干細胞衰老。黃芪多糖可通過調節CDK4,Cyclin D,P16等細胞周期相關蛋白的表達起到延緩HSCs衰老的作用[12]。在放射損傷的Sca1+ HSCs體內衰老模型,當歸多糖顯著降低了SAβ半乳糖苷酶染色陽性細胞百分率,抑制G1期細胞比例增加以及S期細胞比例減少,抑制衰老造血干細胞混合集落形成單位(mixed colony forming unit,CFUMix)數量的減少,其機制與抑制氧化損傷、調控細胞周期蛋白相關基因與蛋白的表達、抑制端粒損傷以及端粒酶活性下調有關[1315]。提示抑制HSCs衰老促進造血功能的恢復可能是DBT促造血作用的重要機制。以往的研究表明,在骨髓造血功能抑制模型,黃芪和當歸5∶1,25∶1,1∶1,1∶25,1∶5,1∶10配伍時,可升高外周血細胞數,增加血清造血生長因子含量和骨髓有核細胞數,促進造血祖細胞增殖,尤以黃芪當歸1∶1,1∶25,1∶5配伍時發揮促造血的作用最強。提示黃芪和當歸配伍促造血作用并不是經典的5∶1配伍,而是在一定的范圍配伍均具有促進造血作用。因此,本研究采用血漿藥理學方法,選擇黃芪和當歸1∶1配伍(促造血作用最強)和10∶1配伍(促造血作用弱)2個配伍比例,進一步從HSCs衰老研究了黃芪和當歸配伍的促造血作用機制。結果表明,黃芪、當歸、芪歸1∶1、芪歸10∶1配伍可促進衰老的造血干細胞增殖,降低衰老細胞陽性率,減少細胞周期G0/G1期細胞數,增加G2/M和S期細胞數,其中以芪歸1∶1配伍的作用最強。提示黃芪當歸及其配伍可延緩HSCs衰老,通過促進細胞周期轉換促進了HSCs增殖,從而發揮其促造血作用。
細胞生命活動的基本過程體現在細胞周期中。在細胞周期時相變化過程中,細胞由靜止進入增殖、分化、衰老、凋亡和死亡等生理狀態,細胞周期關鍵調控因子,如INK4 家族(包括P16,P15,P18,P19)及CIP/KIP 家族(包括P21,P27,P57等)發生改變時,細胞將發生衰老或繞過衰老程序繼續增殖[16]。細胞周期蛋白Cyclin是正性調節因子,其表達上調可以促進細胞周期啟動復制,由G1期進入S期。P53基因是一種抑癌基因,其編碼蛋白P53參與細胞對DNA損傷的應答,在維持細胞基因組的穩定性中起“分子警察”的作用。細胞衰老與細胞周期的停滯有關。P53可使P21的表達增強,結果一方面抑制CDK4/6Cyclin D1 復合物對Rb蛋白的磷酸化,另一方面抑制CDK2Cyclin E 復合物的活性,使細胞停滯于G1期,最終誘發細胞衰老的特征性改變[17]。P21能夠廣泛結合并抑制各種CyclinCDK復合物,包括Cyclin D/CDK4,Cyclin E/CDK2和 Cyclin A/CDK2,使Rb低磷酸化,不能釋放E2F,DNA合成受抑制,導致細胞不能進入S期,停滯在G期,從而誘發細胞衰老[18]。本研究表明,tBHP作用于造血干細胞后,可使Cyclin D1表達降低,P53和P21表達上調,從而誘導了細胞衰老,細胞增殖能力下降。黃芪、當歸、芪歸1∶1配伍、芪歸10∶1配伍使Cyclin D1基因和蛋白表達上調,P53和P21基因表達下調。而且芪歸1∶1配伍的作用強于黃芪、當歸和芪歸10∶1配伍。提示黃芪當歸配伍延緩造血干細胞衰老、促進細胞增殖的作用與其上調細胞周期正性調節因子表達,下調細胞周期負性調節因子表達,從而促進細胞由靜止期進入增殖期有關。也表明黃芪和當歸在合理的配伍下(如1∶1配伍)可發揮較好的延緩造血干細胞衰老、促進細胞增殖的作用。
[參考文獻]
[1]Rossi D J, Bryder D, Weissman I L Hematopoietic stem cell aging:mechanism and consequence[J]. Exp Gerontol, 2007, 42(5):385.
[2]Nijnik A, Woodbine L, Marchetti C, et al. DNA repair is limiting for hacmatopoietic stem cells during ageing[J]. Nature, 2007, 447(7145):686.
[3]Yang X, Huang C G, Du S Y, et al. Effect of Danggui Buxue Tang on immunemediated aplastic anemia bone marrow proliferation mice[J]. Phytomedicine, 2013, 21(5):640.endprint
[4]Shi X Q, Shang E X, Tang Y P, et al. Interaction of nourishing and tonifying blood effects of the combination of Angelicae Sinensis Radix and Astragali Radix studied by response surface method[J]. Acta Pharm Sin, 2012, 47(10):1375.
[5]范穎,陳信義當歸補血湯源流及配伍效用關系研究進展[J]. 中國實驗方劑學雜志, 2006, 12(10):62.
[6]Li F, Tang R, Chen L B, et al. Effects of Astragalus combined with Angelica on bone marrow hematopoiesis suppression induced by cyclophosphamide in mice[J]. Biol Pharm Bull, 2017, 40(5):598.
[7]Chen G, Wu L, Deng C Q The effects of Bu Yang Huan Wu Decoction and its effective components on proliferationrelated factors and ERK1/2 signal transduction pathway in cultured vascular smooth muscle cells[J]. J Ethnopharmacol, 2011, 135(1):7.
[8]Zhou Y, Yang B, Yao X, et al. Establishment of an aging model of Sca1+ hematopoietic stem cell and studies on its relative biological mechanisms[J]. In Vitro Cell Dev Biol Anim, 2011, 47(2):149.
[9]周玥,姜蓉,王萍,等三丁基過氧化氫通過調控細胞周期誘導Sca1+造血干祖細胞衰老[J]. 第三軍醫大學學報, 2011, 33(18):1893.
[10]Lee B Y, Han J A, Im J S, et al. Senescenceassociated betagalactosidase is lysosomal betagalactosidase[J]. Aging Cell, 2006, 5(2):187.
[11]李德冠,孟愛民造血干細胞衰老機制研究[J]. 中國藥理學通報, 2008,32(6):701.
[12]王乾興,金華,何國平,等黃芪多糖對衰老小鼠造血干細胞細胞周期調控蛋白的影響[J]. 遵義醫學院學報, 2014, 40(2):144.
[13]張先平,王乾興,陳斌,等當歸多糖抑制氧化損傷延緩造血干細胞衰老[J]. 中國中藥雜志,2013,38(3):407.
[14]張先平,劉俊,徐春燕,等當歸多糖對小鼠衰老造血干細胞端粒、端粒酶及P53的影響[J]. 中國中藥雜志,2013,38(14):2354.
[15]張先平,王乾興,陳斌,等當歸多糖對小鼠衰老造血干細胞細胞周期蛋白的調控[J]. 基礎醫學與臨床,2013, 21(3):320.
[16]Noda S, Ichikawa H, Miyoshi H Hematopoietic stem cell aging is associated with functional decline and delayed cell cycle progression[J]. Biochem Biophys Res Commun, 2009, 383(2):210.
[17]Dumble M, Moore L, Chambers S M, et al. The impact of altered P53 dosage on hematopoietic stem cell dynamics during aging[J]. Blood, 2007, 109(4):1736.
[18]Yu H, Yuan Y, Shen H, et al. Hematopoietic stem cell exhaustion impacted by P18 INK4C and P21 CiP1/Waf1 in opposite manners[J]. Blood, 2006, 107(3):1200
[責任編輯張寧寧]endprint

