氯化銅催化三組分“一鍋法”合成新型N1-取代3,4-二氫嘧啶酮衍生物
宋志國(guó), 姜宏旭, 張 順, 潘 鶴(渤海大學(xué) 實(shí)驗(yàn)管理中心,遼寧 錦州 121013)
氯化銅催化三組分“一鍋法”合成新型N1-取代3,4-二氫嘧啶酮衍生物
宋志國(guó)*, 姜宏旭, 張 順, 潘 鶴
(渤海大學(xué) 實(shí)驗(yàn)管理中心,遼寧 錦州 121013)
以二水合氯化銅為催化劑,通過(guò)等摩爾芳香醛、乙酰乙酸甲(乙)酯和N-取代脲的Biginelli縮合反應(yīng),“一鍋法”合成了19個(gè)N1-取代的3,4-二氫嘧啶酮衍生物,其中11個(gè)為新化合物,其結(jié)構(gòu)經(jīng)1H NMR,13C NMR和MS表征。考察了催化劑用量和反應(yīng)溫度對(duì)產(chǎn)物收率的影響。結(jié)果表明最優(yōu)反應(yīng)條件為:催化劑用量為0.3 mmol,反應(yīng)溫度為90 ℃。并對(duì)催化機(jī)理進(jìn)行了探討。
Biginelli反應(yīng); 嘧啶酮衍生物; 氯化銅; 催化; 一鍋法; 無(wú)溶劑; 合成
近年來(lái)研究結(jié)果表明,二氫嘧啶酮類化合物(DHPMs)及其衍生物具有廣泛的生物活性,包括抗病毒、抗腫瘤、抗菌和抗炎等[1]。此外,一些官能化的DHPMs還可用作抗高血壓劑和α1a-拮抗劑[2]。因此,該類化合物引起了人們極大的研究興趣,隨著研究的不斷深入,發(fā)現(xiàn)其中一些N-取代官能化的3,4-二氫嘧啶酮衍生物具有更廣泛、更優(yōu)良的藥理活性[3]。但是,對(duì)N-取代官能化的3,4-二氫嘧啶酮衍生物的合成方法報(bào)道相對(duì)較少。目前,其合成方法主要為Biginelli三組分“一鍋法”反應(yīng),已報(bào)道的催化劑有MgBr2[4-5]、酸性氧化鋁[6]、聚磷酸酯[7]、 I2[8]、 Me3SiCl[9]、Y(OAc)3[10]、 H3BO3[11]、 NaHSO4[12]、對(duì)甲苯磺酸[13]等。上述方法在一定程度上改善了合成路線,但是其中仍然存在催化劑昂貴、用量大、操作復(fù)雜、使用有毒有機(jī)溶劑(DMF)以及微波輔助等缺點(diǎn)。因此,尋求一種經(jīng)濟(jì)、綠色、環(huán)保的合成方法具有重要意義。
本文采用無(wú)溶劑條件,以廉價(jià)易得的CuCl2·2H2O(3 mol%)為催化劑,等摩爾的芳香醛、乙酰乙酸甲(乙)酯和N-取代脲經(jīng)三組分“一鍋法”反應(yīng)高效合成了19個(gè)N1-取代的3,4-二氫嘧啶酮衍生物(4a~4s),收率高達(dá)95%,其中11個(gè)為新化合物(4b,4g,4i,4k,4l,4n~4s),其結(jié)構(gòu)經(jīng)1H NMR,13C NMR和MS表征。除烷基取代脲外,還考察了芳基取代脲的反應(yīng)效果。考察了催化劑用量和反應(yīng)溫度對(duì)產(chǎn)物收率的影響,并對(duì)催化機(jī)理進(jìn)行了探討。
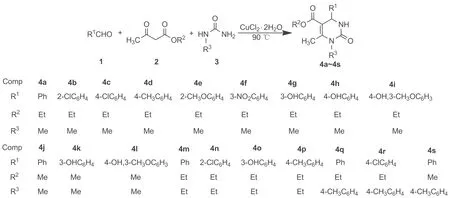
Scheme1

表1 CuCl2·2H2O催化合成N1-取代的3,4-二氫嘧啶酮衍生物的實(shí)驗(yàn)結(jié)果*Table 1 Experimental results of synthesizing N1-substituted 3,4-dihydropyrimidinones catalyzed by CuCl2·2H2O*
*反應(yīng)條件:芳香醛10 mmol,乙酰乙酸甲(乙)酯10 mmol,N-取代脲10 mmol, CuCl2·2H2O 0.3 mmol, 90 ℃。
該方法不使用有毒有機(jī)溶劑,反應(yīng)條件溫和(常壓、90 ℃),反應(yīng)時(shí)間較短(8 min~4 h),操作簡(jiǎn)單,彌補(bǔ)了以上方法的不足。
1 實(shí)驗(yàn)部分
1.1 儀器與試劑
RD-Ⅱ型熔點(diǎn)儀(溫度未校正); Agient 400-MR型核磁共振儀(DMSO-d6為溶劑,TMS為內(nèi)標(biāo)); LC/MSD VL ESI型質(zhì)譜儀。
所用試劑均為分析純或化學(xué)純。
1.24a~4s的合成通法
在25 mL反應(yīng)瓶中分別加入芳香醛(10 mmol)、乙酰乙酸甲(乙)酯(10 mmol)、N-取代脲(10 mmol)和CuCl2·2H2O(0.3 mmol),攪拌下回流(90 ℃)反應(yīng)至終點(diǎn)(TLC跟蹤,有固體物質(zhì)生成)。冷卻至室溫,加入冰水洗滌,抽濾,濾餅干燥得粗產(chǎn)物,用無(wú)水乙醇重結(jié)晶得4a~4s。
5-乙氧羰基-1,6-二甲基-4-苯基-3,4-二氫嘧啶-2(1H)-酮(4a): 淡黃色固體;1H NMRδ: 7.99(s, 1H, NH), 7.21~7.33(m, 5H, ArH), 5.16(s, 1H, CH), 4.02(q,J=8.0 Hz, 2H, CH2), 3.10(s, 3H, NCH3), 2.49(s, 3H, C=CCH3), 1.11(t,J=8.0 Hz, 3H, OCH2CH3);13C NMRδ: 165.99, 153.50, 151.01, 144.49, 128.87, 127.74, 126.46, 102.84, 59.95, 52.82, 30.13, 16.45, 14.47; MSm/z: 275{[M+H]+}。
5-乙氧羰基-1,6-二甲基-4-(2-氯苯基)-3,4-二氫嘧啶-2(1H)-酮(4b): 淡黃色固體;1H NMRδ: 7.96(s, 1H, NH), 7.31~7.42(m, 4H, ArH), 5.65(s, 1H, CH), 3.94(q,J=8.0 Hz, 2H, CH2), 3.17(s, 3H, NCH3), 2.57(s, 3H, C=CCH3), 1.01(t,J=8.0 Hz, 3H, OCH2CH3);13C NMRδ: 165.64, 152.64, 151.98, 141.33, 132.18, 129.85, 129.65, 128.93, 128.20, 101.40, 59.85, 50.50, 30.04, 16.43, 14.30; MSm/z: 309{[M+H]+}。
5-乙氧羰基-1,6-二甲基-4-(3-羥基苯基)-3,4-二氫嘧啶-2(1H)-酮(4g): 淡黃色固體;1H NMRδ: 9.40(s, 1H, OH), 7.95(s, 1H, NH), 6.67~7.11(m, 4H, ArH), 5.13(s, 1H, CH), 4.08(q,J=4.0 Hz, 2H, CH2), 3.12(s, 3H, NCH3), 2.49(s, 3H, C=CCH3), 1.17(t,J=4.0 Hz, 3H, OCH2CH3);13C NMRδ: 166.07, 157.81, 153.66, 150.57, 145.94, 129.79, 117.00, 114.64, 113.34, 103.17, 59.99, 52.70, 30.14, 16.45, 14.48; MSm/z: 291{[M+H]+}。
5-乙氧羰基-1,6-二甲基-4-(4-羥基-3-甲氧基苯基)-3,4-二氫嘧啶-2(1H)-酮(4i): 橙紅色固體;1H NMRδ: 8.94(s, 1H, OH), 7.87(s, 1H, NH), 6.60~6.79(m, 3H, ArH), 5.08(s, 1H, CH), 4.06(q,J=4.0 Hz, 2H, CH2), 3.74(s, 3H, OCH3), 3.11(s, 3H, NCH3), 2.49(s, 3H, C=CCH3), 1.15(t,J=4.0 Hz, 3H, OCH2CH3);13C NMRδ: 166.12, 153.65, 150.47, 147.74, 146.24, 135.50, 118.50, 115.70, 110.95, 103.32, 59.91, 55.93, 52.46, 30.07, 16.43, 14.56; MSm/z: 321{[M+H]+}。
5-甲氧羰基-1,6-二甲基-4-(3-羥基苯基)-3,4-二氫嘧啶-2(1H)-酮(4k): 淡黃色固體;1H NMRδ: 9.39(s, 1H, OH), 7.95(s, 1H, NH), 7.08~6.63(m, 4H, ArH), 5.08(s, 1H, CH), 3.58(s, 3H, OCH3), 3.08(s, 3H, NCH3), 2.47(s, 3H, C=CCH3);13C NMRδ: 166.57, 157.84, 153.67, 151.04, 145.74, 129.88, 116.93, 114.66, 113.25, 102.78, 52.47, 51.55, 30.20, 16.51; MSm/z: 277{[M+H]+}。
5-甲氧羰基-1,6-二甲基-4-(4-羥基-3-甲氧基苯基)-3,4-二氫嘧啶-2(1H)-酮(4l): 橙紅色固體;1H NMRδ: 8.93(s, 1H, OH), 7.88(s, 1H, NH), 6.77~6.55(m, 3H, ArH), 5.05(s, 1H, CH), 3.71(s, 3H, ArOCH3), 3.56(s, 3H, OCH3), 3.07(s, 3H, C=CCH3), 2.47(s, 3H, NCH3);13C NMRδ: 166.61, 153.66, 150.91, 147.81, 146.27, 135.23, 118.38, 115.67, 110.90, 102.88, 55.91, 52.30, 51.50, 30.11, 16.47; MSm/z: 307{[M+H]+}。
5-乙氧羰基-1-乙基-6-甲基-4-(2-氯苯基)-3,4-二氫嘧啶-2(1H)-酮(4n): 淡黃色固體;1H NMRδ: 7.89(s, 1H, NH), 7.42~7.31(m, 4H, ArH), 5.66(s, 1H, CH), 3.94(q,J=8.0 Hz, 2H, OCH2), 3.70(q,J=8.0 Hz, 2H, NCH2), 2.59(s, 3H, C=CCH3), 1.15(t,J=8.0 Hz, 3H, OCH2CH3), 1.02(t,J=8.0 Hz, 3H, NCH2CH3);13C NMRδ: 165.69, 152.06, 150.83, 141.43, 132.22, 129.89, 129.61, 128.88, 128.08, 101.67, 59.85, 50.71, 37.44, 15.81, 15.23, 14.25; MSm/z: 323{[M+H]+}。
5-乙氧羰基-1-乙基-6-甲基-4-(3-羥基苯基)-3,4-二氫嘧啶-2(1H)-酮(4o): 淡黃色固體;1H NMRδ: 9.37(s, 1H, OH), 7.84(s, 1H, NH), 7.08~6.62(m, 4H, ArH), 5.05(s, 1H, CH), 4.01(q,J=8.0 Hz, 2H, OCH2), 3.60(q,J=8.0 Hz, 2H, NCH2), 2.46(s, 3H, C=CCH3), 1.12(t,J=8.0 Hz, 3H, OCH2CH3), 1.06(t,J=8.0 Hz, 3H, NCH2CH3);13C NMRδ: 166.11, 157.80, 153.01, 149.47, 146.10, 129.79, 117.02, 114.62, 113.41, 103.43, 60.00, 52.89, 37.37, 15.91, 15.26, 14.50; MSm/z: 305{[M+H]+}。
5-乙氧羰基-1-乙基-6-甲基-4-(4-甲基苯基)-3,4-二氫嘧啶-2(1H)-酮(4p): 淡黃色固體;1H NMRδ: 7.87(s, 1H, NH), 7.10(s, 4H, ArH), 5.12(s, 1H, CH), 4.00~3.60(m, 4H, OCH2, NCH2), 2.48(s, 3H, C=CCH3), 2.24(s, 3H, ArCH3), 1.10~1.06(m, 6H, OCH2CH3, NCH2CH3);13C NMRδ: 166.06, 152.98, 149.64, 141.74, 136.88, 129.35, 126.43, 103.43, 59.94, 52.72, 37.32, 21.04, 15.86, 15.23, 14.47; MSm/z: 303{[M+H]+}。
5-乙氧羰基-1-(4-甲基苯基)-6-甲基-4-苯基-3,4-二氫嘧啶-2(1H)-酮(4q): 淡黃色固體;1H NMRδ: 8.18(s, 1H, NH), 7.12~7.43(m, 9H, ArH), 5.34(s, 1H, CH), 4.07(q,J=4.0 Hz, 2H, OCH2), 2.36(s, 3H, C=CCH3), 2.07(s, 3H, ArCH3), 1.14(t,J=4.0 Hz, 3H, CH2CH3);13C NMRδ: 165.89, 152.61, 149.55, 144.54, 137.86, 135.55, 129.83, 129.05, 127.92, 126.71, 118.64, 103.98, 60.14, 53.55,
21.10, 18.49, 14.46; MSm/z: 351{[M+H]+}。
5-乙氧羰基-1-(4-甲基苯基)-6-甲基-4-(4-氯苯基)-3,4-二氫嘧啶-2(1H)-酮(4r): 淡黃色固體;1H NMRδ: 8.18(s, 1H, NH), 7.48~7.11(m, 8H, ArH), 5.29(s, 1H, CH), 4.05(q,J=6.0 Hz, 2H, OCH2), 2.35(s, 3H, C=CCH3), 2.05(s, 3H, ArCH3), 1.13(t,J=6.0 Hz, 3H, OCH2CH3);13C NMRδ: 165.75, 152.40, 149.98, 143.40, 137.93, 135.39, 132.46, 130.00, 129.83, 129.07, 128.65, 103.36, 60.21, 52.92, 21.10, 18.49, 14.47; MSm/z: 385{[M+H]+}。
5-甲氧羰基-1-(4-甲基苯基)-6-甲基-4-苯基-3,4-二氫嘧啶-2(1H)-酮(4s): 淡黃色固體;1H NMRδ: 8.21(s, 1H, NH), 7.43~7.04(m, 9H, ArH), 5.34(s, 1H, CH), 3.61(s, 3H, OCH3), 2.35(s, 3H, C=CCH3), 2.08(s, 3H, ArCH3);13C NMRδ: 166.41, 152.67, 149.89, 144.34, 137.90, 135.50, 129.85, 129.12, 127.96, 126.64, 118.29, 103.73, 53.36, 51.63, 21.09, 18.55; MSm/z: 337{[M+H]+}。
2 結(jié)果與討論
2.1 反應(yīng)條件優(yōu)化
以苯甲醛、乙酰乙酸乙酯和甲基脲反應(yīng)為模型,反應(yīng)物用量均為10 mmol,考察催化劑用量和反應(yīng)溫度對(duì)收率的影響,對(duì)反應(yīng)條件進(jìn)行優(yōu)化。
(1) 催化劑用量
在無(wú)溶劑條件下于80 ℃反應(yīng),考察催化劑CuCl2·2H2O用量對(duì)反應(yīng)的影響,結(jié)果見表2。由表2可知,在該反應(yīng)條件下,隨著催化劑用量的增加,收率逐漸提高,當(dāng)催化劑用量為0.3 mmol時(shí),收率達(dá)到90%;繼續(xù)增加催化劑用量,收率提高不明顯。因此,確定該反應(yīng)中催化劑用量為0.3 mmol為宜(No.4)。
(2) 反應(yīng)溫度
CuCl2·2H2O(0.3 mmol)為催化劑,反應(yīng)物配比1 ∶1 ∶1(10 mmol),改變反應(yīng)溫度進(jìn)行實(shí)驗(yàn),結(jié)果見表3。由表3可以看出,適當(dāng)提高反應(yīng)溫度,反應(yīng)時(shí)間隨之縮短,收率隨之增加,當(dāng)反應(yīng)溫度達(dá)到90 ℃時(shí),收率最高可達(dá)93%(No.4);繼續(xù)增加反應(yīng)溫度,收率不再提高。從而確定較佳反應(yīng)溫度為90 ℃。
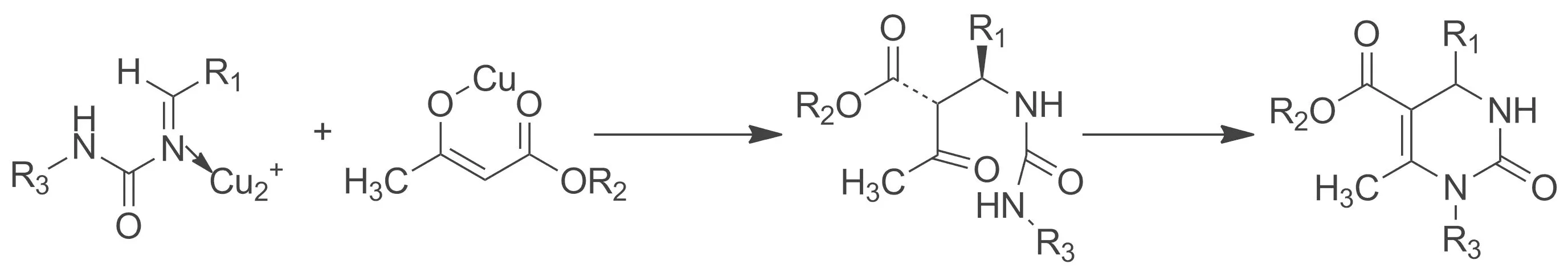
Scheme 2
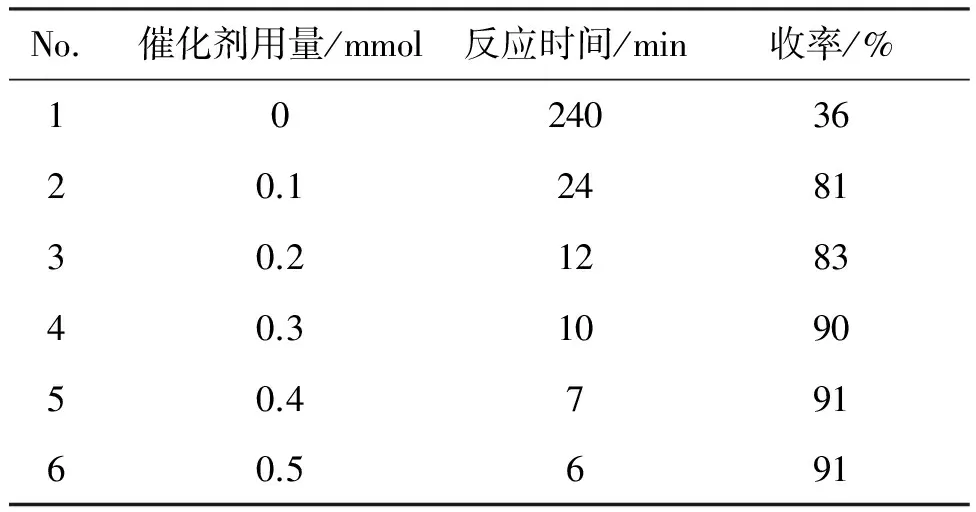
表2 催化劑用量對(duì)收率的影響Table 2 The effect of the amount of catalyst on the yields

表3 反應(yīng)溫度對(duì)收率的影響Table 3 The effect of the reaction temperature on the yields
2.2 底物拓展
表1為采用不同的芳香醛、乙酰乙酸酯和N-取代脲合成N1-取代的3,4-二氫嘧啶酮衍生物的反應(yīng)時(shí)間、收率及熔點(diǎn)數(shù)據(jù)。從表1可以看出,無(wú)論芳香醛上的取代基是供電子基團(tuán)或吸電子基團(tuán),CuCl2·2H2O都能很好的催化該反應(yīng),而且取代基位置對(duì)反應(yīng)無(wú)影響。產(chǎn)品收率大部分都在70%以上,最高可達(dá)95%(No.5)。反應(yīng)時(shí)間短,有的反應(yīng)僅需8 min即可到達(dá)反應(yīng)終點(diǎn)(No.1)。與不加催化劑(表2, No.1)時(shí)相比,反應(yīng)時(shí)間大大縮短,收率有大幅的提高,說(shuō)明催化劑起到了很好的催化作用。作者嘗試了乙酰乙酸乙酯和乙酰乙酸甲酯的反應(yīng)效果,都得到了相應(yīng)的目標(biāo)產(chǎn)物,反應(yīng)效果無(wú)太大區(qū)別。除了甲基脲和乙基脲外,實(shí)驗(yàn)證明對(duì)甲苯基脲也能參與反應(yīng),但收率較低(No.17~19)。
2.3 催化機(jī)理
關(guān)于Biginelli的反應(yīng)機(jī)理,早在1997年,Kappe就通過(guò)碳譜和氫譜對(duì)其進(jìn)行了分析[16]。研究結(jié)果表明,在催化劑的作用下,首先是醛和脲進(jìn)行縮合,生成N-酰基亞胺正離子中間體,然后再與酯縮合得到開鏈的酰脲,最后進(jìn)一步環(huán)化、脫水得到相應(yīng)的3,4-二氫嘧啶-2(1H)-酮衍生物(Scheme 2)。
采用CuCl2·2H2O為催化劑,以等摩爾芳香醛、乙酰乙酸甲(乙)酯和N-取代脲為原料,無(wú)溶劑條件下合成了一系列N1-取代的3,4-二氫嘧啶酮衍生物。該催化劑催化活性高,用量少,催化效果好。與已報(bào)道的反應(yīng)相比,該方法具有操作簡(jiǎn)單,反應(yīng)時(shí)間短,催化劑廉價(jià)易得、不使用有機(jī)溶劑等優(yōu)點(diǎn)。為N1-取代的3,4-二氫嘧啶酮衍生物的制備提供了一條方便、快速、有效的合成方法。
[1] KAPPE C O. 100 Years of the Biginelli dihydropyrimidine synthesis[J].Tetrahedron,1993,49(32):6937-6963.
[2] ATWAL K S, SWANSON B N, UNGER S E,etal. Dihydropyrimidine calcium channel blockers. 3-carbamoyl-4-aryl-1,2,3,4-tetrahydro-6-methyl-5-pyrimidinecarboxylic acid esters as orally effective antihypertensive agent[J].J Med Chem,1991,34(2):806-811.
[3] BARROW J C, NANTERMET P G, SELNICK H G,etal.Invitroandinvivoevaluation of dihydropyrimidinone C-5 amides as potent and selectiveα1Areceptor antagonists for the treatment of benign prostatic hyperplasia[J].J Med Chem,2000,43(14):2703-2718.
[4] SALEHI H, GUO Q X. A facile and efficient one-pot synthesis of dihydropyrimidinones catalyzed by magnesium bromide under solvent-free conditions[J].Synth Commun,2004,34(1):171-179.
[5] SALEHI H, GUO Q X. Efficient magnesium bromide-catalyzed one-pot synthesis of substituted 1,2,3,4-tetrahydropyrimidin-2-ones under solvent-free conditions[J].Chin J Chem,2005,23(1):91-97.
[6] BESOLUK S, KUCUKISLAMOGLU M, NEBIOGLU M,etal. Solvent-free synthesis of dihydropyrimidinones catalyzed by alumina sulfuric acid at room temperature[J].J Iran Chem Soc,2008,5(1):62-66.
[7] KAPPE C O, KUMAR D, VARMA R S. Microwave-assisted high-speed parallel synthesis of 4-aryl-3,4-dihydropyrimidin-2(1H)-ones using a solventless Biginelli condensation protocol[J].Synthesis,1999,1999(10):1799-1803.
[8] ZALAVADIYA P, TALA S, AKBARI J,etal. Multi-component synthesis of dihydropyrimidines by iodine catalyst at ambient temperature andin-vitroantimycobacterial activity[J].Arch Pharm Chem Life Sci,2009,342(8):469-475.
[9] RYABUKHIN S V, PLASKON A S, BONDARENKO S S,etal. Acyl pyruvates as synthons in the Biginelli reaction[J].Tetrahedron Lett,2010,51(32):4229-4232.
[10] ARIDOSS G, JEONG T Y. A convenient one-pot Biginelli reaction catalyzed by Y(OAc)3:An improved protocol for the synthesis of 3,4-dihydropyrimidin-2(1H)-ones and their sulfur analogues[J].Bull Korean Chem Soc,2010,31(4):863-868.
[11] ISMAILI L, NADARADJANE A, NICOD L,etal. Synthesis and antioxidant activity evaluation of new hexahydropyrimido[5,4-c]quinoline-2,5-diones and 2-thioxohexahydropyrimido[5,4-c]quinoline-5-ones obtained by Biginelli reaction in two steps[J].Eur J Med Chem,2008,43(6):1270-1275.
[12] CHENG Q F, WANG Q F, XU X Y,etal. Solvent-free synthesis of monastrol derivatives catalyzed by NaHSO4[J].J Heterocyclic Chem,2010,47(3):624-628.
[13] 王海萍,李麗,劉慶儉.N(1)-甲基取代的二氫嘧啶酮類化合物的合成[J].山東化工,2013,42(5):32-33.
[14] PUTATUNDA S, CHAKRABORTY S, GHOSH S,etal. RegioselectiveN1-alkylation of 3,4-dihydropyrimidine-2(1H)-ones:Screening of their biological activities against Ca2+-ATPase[J].Eur J Med Chem,2012,54(8):223-231.
[15] SINGH K, ARORA D, POREMSKY E,etal.N1-alkylated 3,4-dihydropyrimidine-2(1H)-ones:Convenient one-pot selective synthesis and evaluation of their calcium channel blocking activity[J].Eur J Med Chem,2009,44(1):1997-2001.
[16] KAPPE C O. A reexamination of the mechanism of the Biginelli dihydropyrimidine synthesis.Support for anN-acyliminium ion intermediate[J].J Org Chem,1997,62(21):7201-7204.
One-potThreeComponentsSynthesisofN1-Substituted3,4-DihydropyrimidinonesDerivativesCatalyzedbyCopperChloride
SONG Zhi-guo*, JIANG Hong-xu, ZHANG Shun, PAN He
(Center of Experimental Management, Bohai University, Jinzhou 121013, China)
NineteenN1-substituted 3,4-dihydropyrimidin-2(1H)-ones derivatives(eleven new compounds) were synthesized by an one-pot reaction of aromatic aldehydes, methyl(ethyl) acetoacetate andN-substituted ureas using CuCl2·2H2O as a catalyst under solvent-free conditions. The structures were characterized by1H NMR,13C NMR and MS. The effects of the catalyst dosage and the reaction temperature on the yields were investigated. The results showed that the optimal reaction conditions were as follows: the catalyst dosage was 0.3 mmol, and temperature was 90 ℃. The probable reaction mechanism was proposed.
Biginelli reaction; pyrimidinone derivative; copper chloride; catalysis; one-pot reaction; solvent-free; synthesis
2017-03;
2017-09-06
國(guó)家自然科學(xué)基金資助項(xiàng)目(21406016); 遼寧省高等學(xué)校優(yōu)秀人才支持計(jì)劃(LJQ2015002); 遼寧省自然科學(xué)基金資助項(xiàng)目(2015020201)
宋志國(guó)(1975-),男,漢族,遼寧撫順人,副高級(jí)實(shí)驗(yàn)師,主要從事綠色催化化學(xué)的研究。 E-mail: lnbhu@hotmail.com
·研究論文·
O626.4
A
10.15952/j.cnki.cjsc.1005-1511.2017.11.17054

