酸功能化離子液體催化合成2-叔丁基蒽醌
郭亞楠, 郭芳杰, 陳 平, 王 欣(遼寧石油化工大學 化學與材料科學學院, 遼寧 撫順 113001)
·研究簡報·
酸功能化離子液體催化合成2-叔丁基蒽醌
郭亞楠, 郭芳杰, 陳 平*, 王 欣
(遼寧石油化工大學 化學與材料科學學院, 遼寧 撫順 113001)
以N-甲基咪唑、吡啶、1,4-丁烷磺內酯、對甲苯磺酸及硫酸為主要原料,經兩步反應合成了4種酸功能化離子液體[MIM-BS][TsO](IL1)、 [MIM-BS][HSO4](IL2)、 [PY-BS][TsO](IL3)和[PY-BS][HSO4](IL4),其結構和性能經1H NMR, IR和TGA表征。以[MIM-BS][TsO]為催化劑,催化2-(4-叔丁基苯甲酰基)苯甲酸(BB酸)合成2-叔丁基蒽醌,并對反應條件進行了優化。結果表明:IL10.4 g,n(IL)/n(BB酸)=0.5,于120 ℃反應9 h, 2-叔丁基蒽醌產率最高達90%,離子液體循環使用5次后催化活性無明顯降低。
離子液體; 酰化反應; 2-叔丁基蒽醌; 正交實驗; 催化; 合成
叔丁基蒽醌作為化學中間體,是生產雙氧水的催化劑。雙氧水作為綠色氧化劑,其需求量逐年增加[1],因此對生產雙氧水所需要的蒽醌也有了更高的要求。與乙基蒽醌比,叔丁基蒽醌氫效值高,近年來的工業生產需求更大[2]。叔丁基蒽醌的合成通過苯酐與叔丁苯在AlCl3的催化下發生F—C酰基化反應生成中間產物2-(4-叔丁基苯甲酰基)苯甲酸(BB酸),然后BB酸在強酸(如發煙硫酸和多聚磷酸)作用下脫水制得[3]。該方法副產物多、強酸催化劑對設備腐蝕比較嚴重且不可回收,造成環境污染等問題。
Cole等[4]首次報道了在陽離子中引入磺酸功能化基團制備離子液體。該離子液體用于有機合成時表現出反應條件溫和、轉化率較高、產物易分離且可循環利用等良好特點,在許多酸催化反應[5]如Friedel-Crafts反應、酯化、醚化、加成及羥醛縮合反應中作為一種綠色催化劑和溶劑表現出優異的催化活性,并取得了良好的催化效果。
本文以N-甲基咪唑、吡啶、1,4-丁烷磺內酯、對甲苯磺酸及硫酸為主要原料,通過兩步法合成兩種咪唑類和兩種吡啶類酸功能化離子液體[MIM-BS][TsO](IL1)、 [MIM-BS][HSO4](IL2)、 [PY-BS][TsO](IL3)和[PY-BS][HSO4](IL4)(Scheme 1),其結構和性能經1H NMR, IR和TGA表征。該類離子液體可作為催化劑和溶劑。研究了IL1催化BB酸閉環反應合成2-叔丁基蒽醌(Scheme 2)的催化活性。結果顯示,該催化劑具有化學性質穩定、催化活性高、易回收和重復使用等優點[6]。

Scheme 1
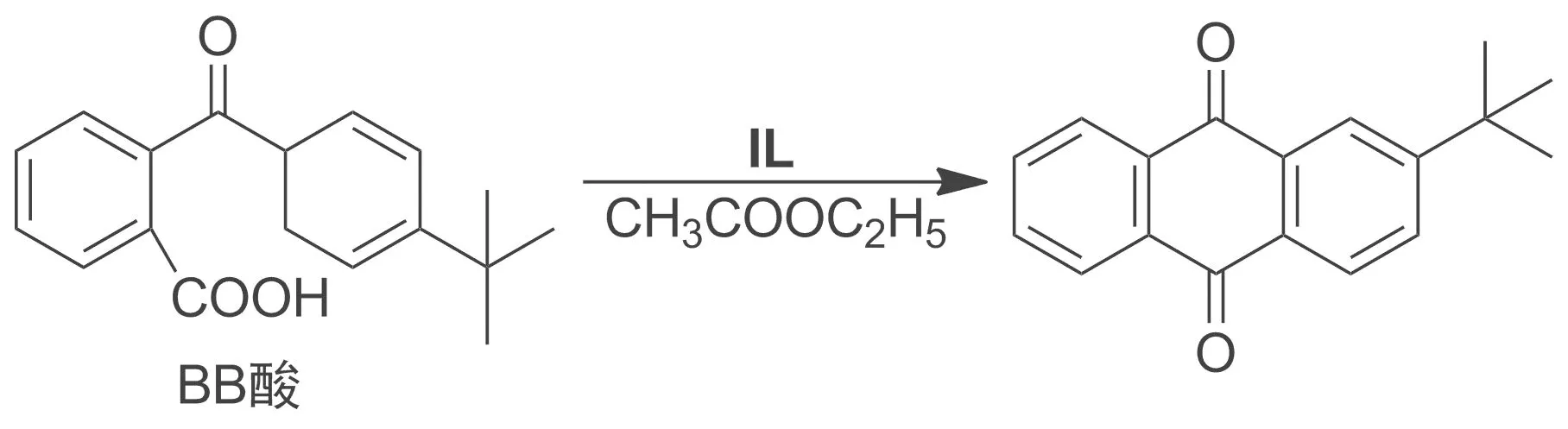
Scheme 2
1 實驗部分
1.1 儀器與試劑
X-6型顯微熔點儀;Bruker AV 600型核磁共振儀(D2O為溶劑,TMS為內標);FTS-135型傅里葉變換紅外光譜儀(KBr壓片);HCT-1微機差熱天平(綜合熱分析儀)。
BB酸(白色晶體,產率82%, m.p.137 ℃),實驗室自制;N-甲基咪唑(MIM)、吡啶(Py)、 1,4-丁烷磺內酯(BS)和對甲苯磺酸(TsO),分析純,邁瑞爾公司;其余所用試劑均為分析純,國藥集團化學試劑有限公司。
1.2 酸功能化離子液體的合成[7](以IL1為例)
將BS 5.04 g(0.03 mol)滴加至MIM 8.36 g(0.11 mol)中,攪拌下于50 ℃反應2 d,冷卻后用研缽研碎,無水乙醚洗滌3次得白色固體,于80 ℃真空干燥24 h得3-[3′-(1′-甲基咪唑)]-1-丁烷磺酸(MIM-BS)兩性鹽,滴加對甲基苯磺酸5.1 g(0.03 mol),攪拌下于80 ℃反應8 h。依次用丙酮和無水乙醚洗滌3次以除去未反應的原料,于60 ℃真空干燥24 h得透明黏稠狀離子液體IL1。
用濃硫酸代替對甲基苯磺酸,用類似方法合成IL2。
用Py代替MIM,用類似的方法合成IL3和IL4。
IL1: 產率95%, m.p. 32 ℃;1H NMR(500 MHz,DMSO-d6)δ: 9.17(s, 1H), 7.78~7.71(m, 2H), 7.52~7.51(m, 2H), 7.16~7.14(m, 2H), 4.19~4.17(m, 2H), 3.85(s, 3H), 2.63~2.60(m, 2H), 2.52~2.50(m, 1H), 2.30(s, 3H), 1.89~1.86(m, 2 H), 1.58~1.56(m, 2H)。表征數據與文獻報道一致[8]。
IL2: 產率93%, m.p. 34 ℃;1H NMR(500 MHz, DMSO-d6)δ: 8.38(s, 1H), 7.17(s, 1H), 7.11(s, 1H), 3.91(t,J=8.0 Hz, 2H), 2.68(t,J=8.0 Hz, 2H), 1.68~1.74(m, 2H), 1.44~1.51(m, 2H); IRν: 3 443, 3 154, 2 959, 1 680, 1 575, 1 448, 1 194, 1 050, 589 cm-1。
IL3: 產率90%;1H NMR(500 MHz, DMSO-d6)δ: 9.64(s, 1 H), 9.17(s, 1H), 9.11(d,J=6.0 Hz, 2H), 8.60(t,J=7.5 Hz, 1H), 8.16(t,J=7.5 Hz, 1H), 7.78~7.70(m, 2H), 7.50(d,J=8.0 Hz, 2H), 7.14(d,J=8.0 Hz, 2H), 4.63(t,J=8.0 Hz, 2H), 4.17(t,J=8.0 Hz, 2H), 3.84(s, 3H), 2.04~1.97(m, 2H), 1.90~1.83(m, 2H), 1.62~1.53(m, 2H); IRν: 3 450, 3 070, 2 960, 1 650, 1 490, 1 235, 1 127, 1 020, 810, 682 cm-1。
IL4:產率92%;1H NMR(500 MHz, DMSO-d6)δ: 8.53~8.47(m, 2H), 8.19(s, 1H), 4.32~4.28(m, 2H), 2.63~2.58(m, 2H), 1.83~1.79(m, 2H), 1.45~1.42(m, 2H); IRν: 3 429, 3 063, 1 639, 1 494, 1 198, 1 059, 586 cm-1。
1.3 酸功能化離子液體催化合成2-叔丁基蒽醌
將乙酸乙酯6 mL、IL0.2 g和BB酸0.15 g置于燒瓶中,升溫至120 ℃,攪拌反應3~9 h。冷卻至室溫,加飽和食鹽水50 mL,分液,有機相旋蒸除溶劑得淡黃色固體,用乙醇/水(V/V=2/1)重結晶得淡黃色晶體叔丁基蒽醌,產率90%, m.p.105 ℃;1H NMR(500 MHz,CDCl3)δ: 8.07(d,J=8.0 Hz, 1H), 7.67(t,J=8.5 Hz, 1H), 7.62(t,J=6.0 Hz, 1H), 7.56~7.53(m, 1H), 7.43(d,J=8.0 Hz, 2H), 7.34(t,J=7.5 Hz, 1H), 1.33(s, 9 H); IRν: 3 027, 2 967, 1 668, 1 600, 1 573, 1 490, 1 255 cm-1。
1.4 催化劑的回收
將反應后分離所得水相用15 mL乙酸乙酯分3次萃取其中殘余有機物,分離后旋蒸水相,于70 ℃真空干燥24 h得淡黃色離子液體0.16 g。
2 結果與討論
2.1 不同酸功能化離子液體催化合成叔丁基蒽醌
分別考察了四種組成不同的離子液體催化合成叔丁基蒽醌,結果見表1。由表1可知,[MIM-BS][TsO]的催化效果最好,叔丁基蒽醌的產率達90%。故后續實驗選擇IL作為催化劑。
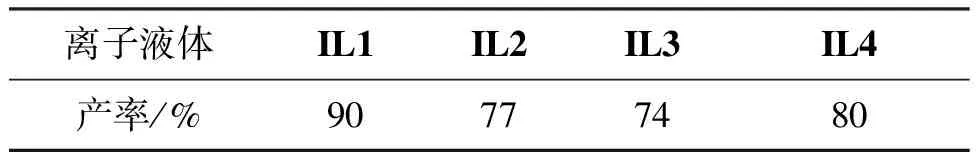
表1 不同離子液體催化性能比較Table 1 Comparison of catalytic properties of different ionic liquids
反應條件:n(IL1)/n(BB酸)=0.5,乙酸乙酯(5 mL)為溶劑,于120 ℃反應9 h。
2.2IL1催化合成2-叔丁基蒽醌的反應條件優化
采用L9(34)正交實驗表,考察反應條件對合成2-叔丁基蒽醌的影響,正交設計條件見表2,結果見表3。表3中的極差R反映了參數水平變化,R值越大,該因素對反應的影響越大[9]。因此影響該反應的主次順序催化劑量>反應溫度>反應物的摩爾比>反應時間。
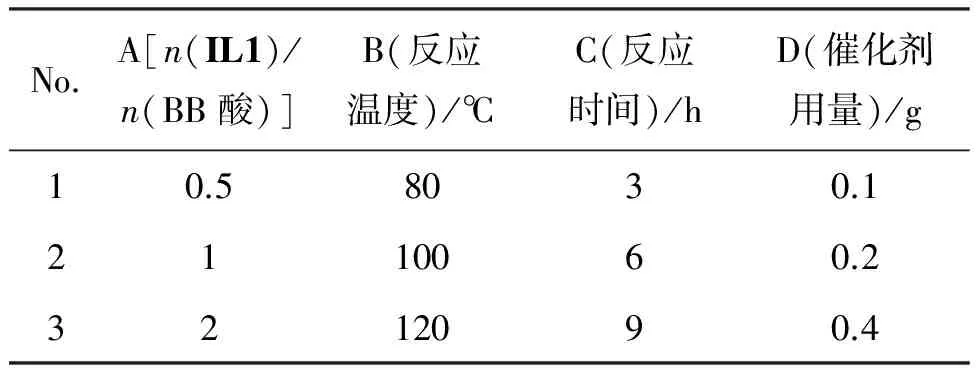
表2 正交實驗因素和水平表Table 2 The factor-level of orthogonal experiment
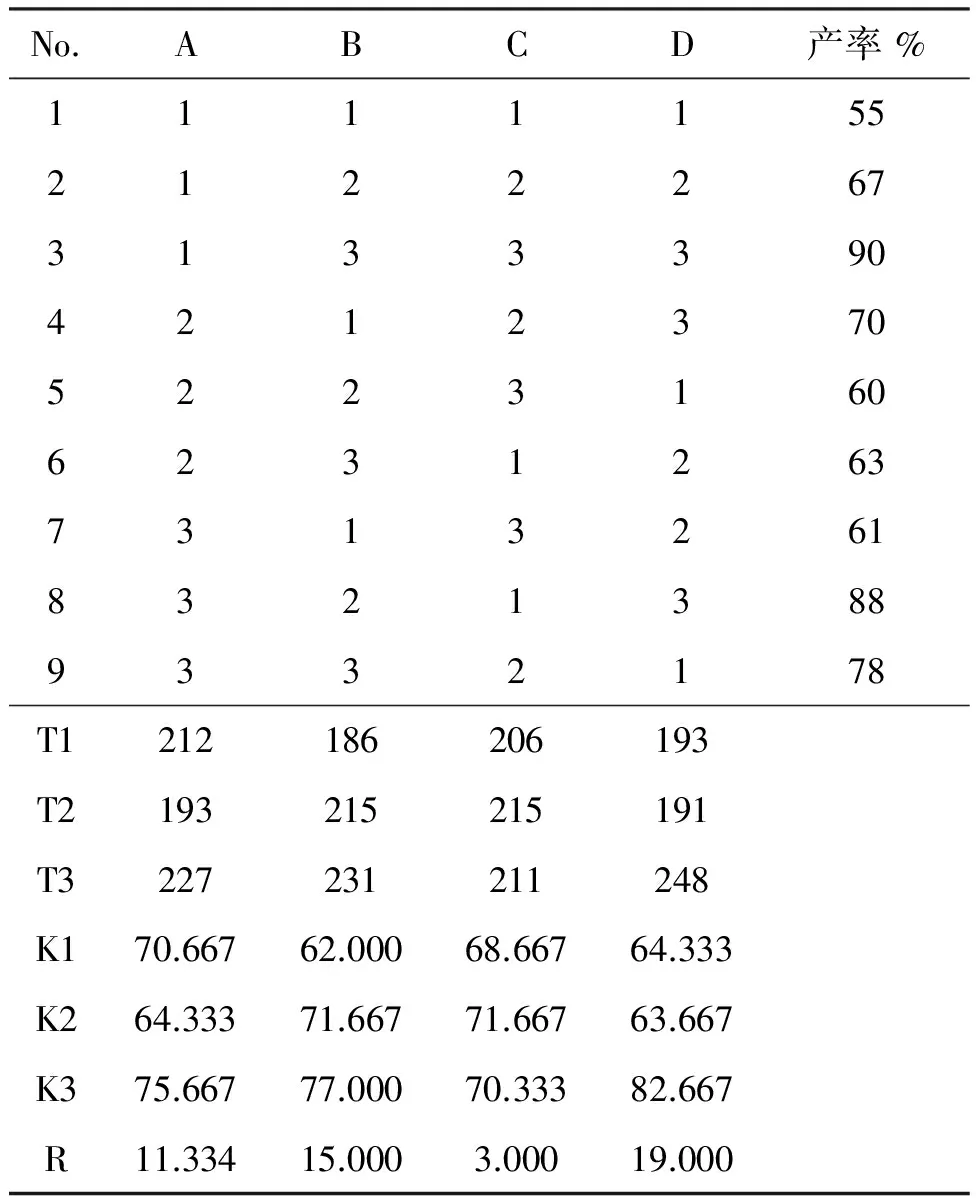
表3 正交實驗結果及分析Table 3 The results and analysis of orthogonal experiment
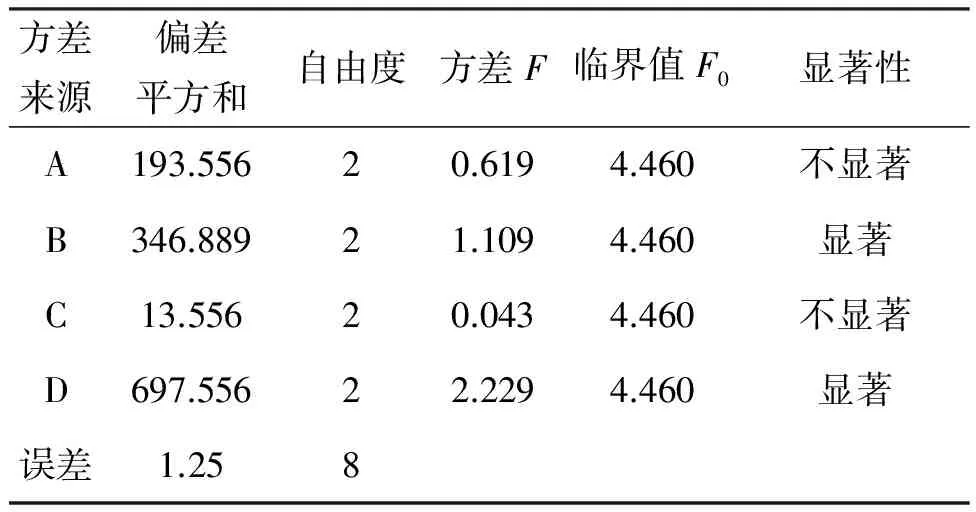
表4 方差分析表
也可利用方差分析對上述各反應條件進行顯著性檢驗,結果見表4。由表4可見,催化劑量和反應溫度對實驗影響顯著,與表3中的極差R分析一致,其中最高產率的優選條件為A1B3C3D3,即0.4 g離子液體,催化劑與反應物的摩爾比0.5,于120 ℃反應9 h, 2-叔丁基蒽醌產率90%。
2.3 不同溶劑對合成2-叔丁基蒽醌的影響
反應條件同上,考察溶劑對反應的影響,結果見表5。由表5可見,乙酸乙酯作溶劑最理想,2-叔丁基蒽醌收率90%,其次是二氯甲烷和氯苯,無溶劑時產率最低。無溶劑時體系的黏度比較大,易引起局部過熱導致副反應發生;溶劑能使反應體系分散得更均勻,避免上述情況發生。三種溶劑中,乙酸乙酯的沸點適中,故反應效果最好。
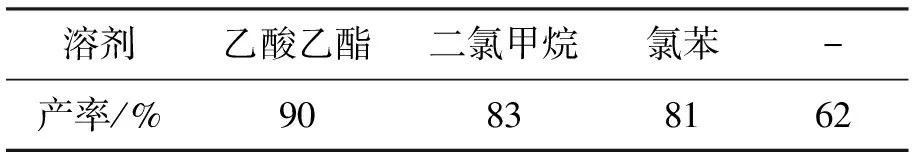
表5 不同溶劑對合成2-叔丁基蒽醌的影響Table 5 Effect of solvents on the yield of 2-tert-butylanthraquinone
2.4IL1的重復利用
反應后對IL1進行純化并重復使用,結果見圖1。圖1表明,離子液體重復使用5次后催化活性仍較高,故具有一定的重復使用性能。
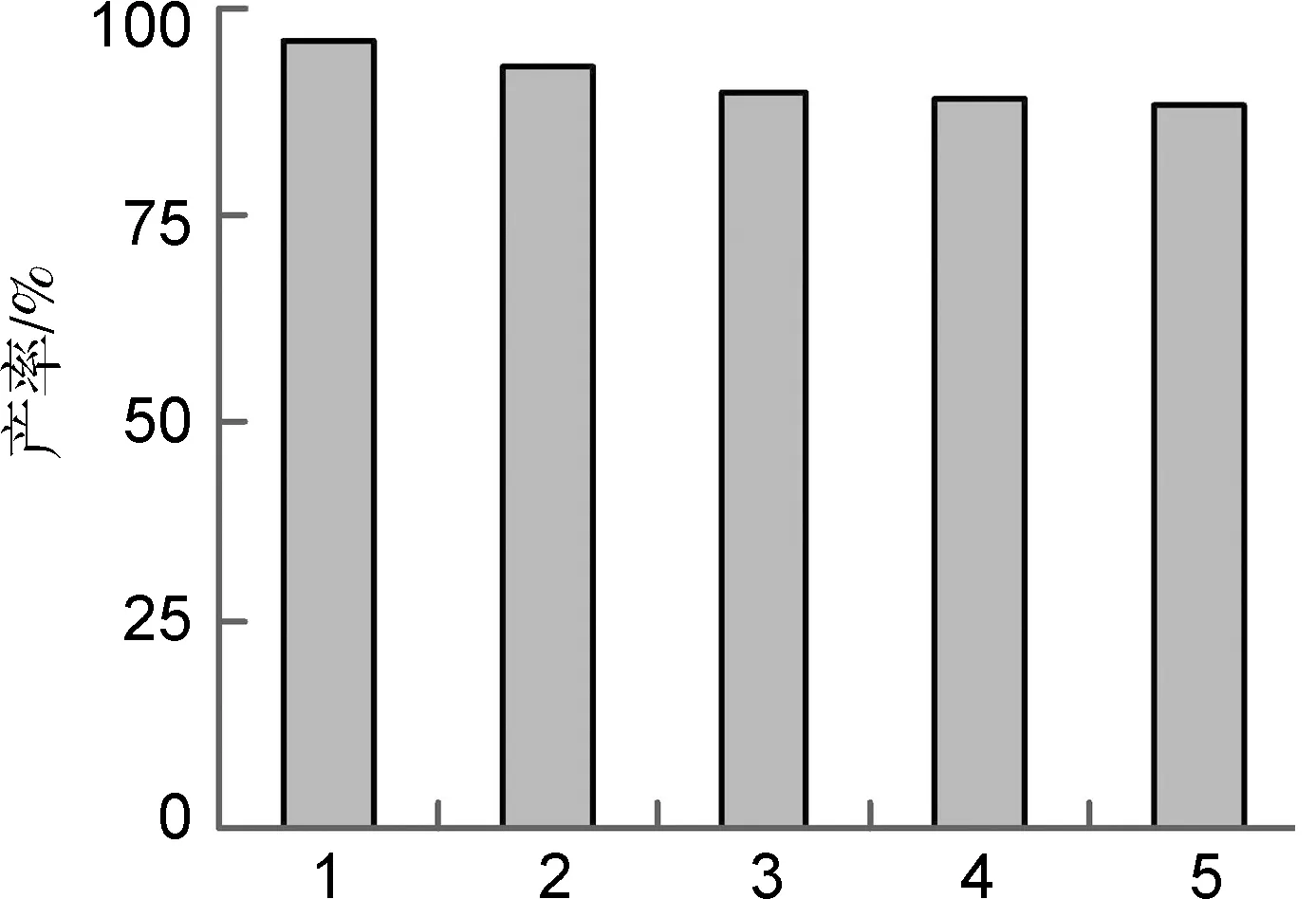
循環次數圖 1 離子液體的重復利用結果Figure 1 Reuse of ionic liquids
以N-甲基咪唑、吡啶、1,4-丁烷磺內酯、對甲苯磺酸及硫酸為主要原料,采用兩步法合成了4種磺酸功能化離子液體[MIM-BS][TsO](IL1)、 [MIM-BS][HSO4](IL2)、 [PY-BS][TsO](IL3)和[PY-BS][HSO4](IL4),并將其催化BB酸閉環合成2-叔丁基蒽醌。結果表明:IL1的催化效果最好,IL10.4 g為催化劑,n(IL1)/n(BB酸)=0.5,于120 ℃反應9 h, 2-叔丁基蒽醌最高產率達90%。離子液體可循環使用,重復使用5次后產率無明顯下降。
[1] REIS R M, ROCHA R S, LANZA M R. Electrogeneration of H2O2in acid medium using catalysts modified with manganese ii phthalocyanine supported in printex 6l carbon[J].ECS Transactions, 2012,43(1):103-109.
[2] 于劍昆,韓向東. 四丁基脲的合成及其在蒽醌法過氧化氫生產中的應用[J].化學推進劑與高分子材料,2011,9(6):31-36.
[3] 秦偉程. 2-烷基蒽醌合成技術與應用市場[J].化工中間體,2004,1(1):10-13.
[4] COLE A C, JENSEN J L, NTAI I,etal. Novel Br?nsted acidic ionic liquids and their use as dual solvent-catalysts[J].Journal of the American Chemical Society,2002,124(21):5962-5963.
[5] 郭亞楠,郭芳杰,陳平. 磺酸功能化離子液體用于催化反應的最新進展[J].遼寧石油化工大學學報,2016,36(3):1-7.
[6] VAFAEEZADEH M, ALINEZHAD H. Br?nsted acidic ionic liquids:Green catalysts for essential organic reactions[J].Journal of Molecular Liquids,2016,218:95-105.
[7] WU Q, WANG M, HAO Y,etal. Synthesis of poly-oxymethylene dimethyl ethers catalyzed by Br?nsted acid ionic liquids with alkanesulfonic acid groups[J].Industrial & Engineering Chemistry Research,2014,53(42):16254-16260.
[8] 史津暉. 離子液體中酰化反應的探究[D].杭州:浙江工業大學,2011.
[9] 李玉賢,張佳樂,劉金浩. 正交實驗法優化咖啡因提取實驗工藝研究[J].實驗室科學,2011,14(2):105-107.
Synthesisof2-Tert-butylanthraquinoneCatalyzedbyAcidFunctionalizedIonicLiquid
GUO Ya-nan, GUO Fang-jie, CHEN Ping*, WANG Xin
(College of Chemistry and Material Science Engineering, Liaoning Shihua University, Fushun 11300, China)
Four acid functional ionic liquids, [MIM-BS] [TsO](IL1), [MIM-BS] [HSO4](IL2), [PY-BS] [TsO](IL3) and [PY-BS] [HSO4](IL4)were synthesized usingN-methylimidazole, pyridine, 1,4-butane sultone,p-toluene sulfonic and H2SO4as raw materials. The structures were characterized by1H NMR, IR and TGA. 2-Tert-butylanthraquinone was synthesized from 2-(4-tertbutyl benzoyl) benzoic acid(BB acid) using [MIM-BS][TsO] as catalyst. The reaction conditions were optimized. The results showed that the yield of 2-tert-butyl anthraquinone reach 90% whenn(IL)/n(BB) was 0.5,IL1was 0.4 g, reaction at 120 ℃ for 9 h. Moreover, the catalytic activity of [MIM-BS][TsO] exhibited no obvious decrease after being reused for five times.
ionic liquid; acetylation reaction; 2-tert-butylanthraquinone; orthogonal experiment; catalysis; synthesis
2017-02-25;
2017-09-27
國家自然科學基金資助項目(21071073); 遼寧省自然科學基金資助項目(2015020196)
郭亞楠(1991-),女,漢族,河南駐馬店人,碩士研究生,主要從事有機化學的合成與應用研究。 E-mail: 1045286719@qq.com
陳平,教授, E-mail: chenping-fs@sohu.com
O643.36
A
10.15952/j.cnki.cjsc.1005-1511.2017.11.17036

