S-烯丙基巰基半胱氨酸對乳腺癌細胞裸鼠移植瘤的抑瘤作用及其機制
閆金銀,張曉云,李寧,王鹿,張揚,蔡海峰
(華北理工大學附屬唐山市人民醫(yī)院,河北唐山063000)
S-烯丙基巰基半胱氨酸對乳腺癌細胞裸鼠移植瘤的抑瘤作用及其機制
閆金銀,張曉云,李寧,王鹿,張揚,蔡海峰
(華北理工大學附屬唐山市人民醫(yī)院,河北唐山063000)
目的觀察S-烯丙基巰基半胱氨酸(SAMC)對乳腺癌細胞裸鼠移植瘤的抑瘤作用,并探討其作用機制。方法將MCF-7細胞懸液接種于BALB/C雌性裸鼠右側腋下近上肢處成瘤,制作乳腺癌MCF-7細胞裸鼠皮下移植瘤模型。將造模成功的裸鼠隨機分為對照組、低劑量SAMC組、高劑量SAMC組、紫杉醇組。對照組給予Nacl注射液,低劑量SAMC組給予150 mg/kg的SAMC,高劑量SAMC組給予300 mg/kg的SAMC,紫杉醇組給予10 mg/kg的紫杉醇。每周腹腔注射給藥3次,共給藥3周。末次給藥后第2天處死裸鼠,取移植瘤組織稱重,計算各組腫瘤抑瘤率;HE染色鏡下觀察腫瘤組織病理變化;采用免疫組化法檢測各組腫瘤組織中的VEGF、Caspase-3蛋白。結果低劑量SAMC組、高劑量SAMC組、紫杉醇組瘤重低于對照組(P均<0.05)。高劑量SAMC組腫瘤抑制率高于低劑量SAMC組(P<0.05),但與紫杉醇組相比差異無統(tǒng)計學意義。腫瘤組織HE染色見低劑量SAMC組、高劑量SAMC組、紫杉醇組出現(xiàn)不同程度的細胞壞死,三組壞死面積和程度依次增大。對照組、低劑量SAMC組、高劑量SAMC組、紫杉醇組腫瘤組織中Caspase-3蛋白相對表達量依次升高,VEGF相對表達量依次降低(P均<0.05)。結論SAMC可抑制乳腺癌細胞裸鼠移植瘤的生長,機制可能與Caspase-3蛋白表達上調、VEGF蛋白表達下調有關。
S-烯丙基巰基半胱氨酸;乳腺癌;血管內皮生長因子;含半胱氨酸的天冬氨酸蛋白水解酶3
乳腺癌是臨床最常見女性惡性腫瘤。流行病學研究[1,2]表明,乳腺癌的發(fā)病率呈上升趨勢,并且發(fā)病年齡趨于年輕化,預計到2030年,乳腺癌發(fā)病人數(shù)將達264萬,病死人數(shù)達170萬[3]。近年越來越多的研究表明,許多傳統(tǒng)中藥不僅具有明顯抗腫瘤療效,且毒性作用小,抗腫瘤的同時可提高機體免疫力。大蒜富含機體所需的多種微量元素及生物活性成分。S-烯丙基巰基半胱氨酸(SAMC)是大蒜水溶性有效活性成分之一,現(xiàn)已證實SAMC對結腸癌、肺癌、乳腺癌、前列腺癌及白血病等許多惡性腫瘤細胞的增殖有抑制作用[4~6],然而在動物體內實驗觀察SAMC對乳腺癌作用的相關研究較少。紫杉醇可抑制細胞有絲分裂過程中紡錘體的形成,使腫瘤細胞有絲分裂過程停滯,誘導細胞凋亡,目前已成為乳腺癌患者最常使用的化療藥物之一[7~9]。本研究建立了乳腺癌細胞裸鼠移植瘤模型,以紫杉醇為陽性對照,觀察SAMC的抑瘤作用,并探討可能的作用機制,為SAMC應用于乳腺癌臨床治療提供一定的實驗依據(jù)。
1 材料與方法
1.1 主要實驗材料 MCF-7乳腺癌細胞系(百恩維生物科技有限公司),4周齡BALB/C雌性裸鼠(北京維通利華公司),SAMC(北京世紀奧科生物技術有限公司),紫杉醇注射液(深圳萬樂制藥有限公司),DAB顯色試劑(上海生工生物工程股份有限公司),VEGF、Caspase-3免疫組化試劑盒(北京中杉金橋有限公司)。
1.2 乳腺癌細胞裸鼠移植瘤模型建立 MCF-7細胞接種于RPMI1640培養(yǎng)基(含10%小牛血清、100 U/mL的鏈霉素、100 U/mL的青霉素),在37 ℃、5%CO2的飽和濕度條件下培養(yǎng)。將處于對數(shù)生長期的MCF-7細胞用胰酶消化,離心,制成細胞懸液,將含1×107個細胞的懸液200 μL接種于裸鼠右側腋下近上肢處成瘤。造模成功標準為裸鼠移植瘤長徑≥5 mm。
1.3 實驗分組與SAMC用法 將造模成功的24只裸鼠隨機分為對照組、低劑量SAMC組、高劑量SAMC組和紫杉醇組。對照組給予0.9% NaCl注射液,0.2 mL/次;低劑量SAMC組給予150 mg/kg的SAMC;高劑量SAMC組給予300 mg/kg的SAMC;紫杉醇組給予10 mg/kg的紫杉醇。各組每周腹腔注射3次,隔2 d注射1次,每次注射前稱重,共給藥3周。干預期間觀察裸鼠生長狀態(tài)。
1.4 瘤重測量及腫瘤抑制率測算 各組于末次給藥后第2天采用0.2%水合氯醛麻醉取瘤,脫頸法處死全部裸鼠。完整分離腫瘤組織,稱瘤重,計算各組腫瘤抑制率,腫瘤抑制率=(1-實驗組瘤重/對照組瘤重)×100%。
1.5 腫瘤組織病理觀察 將腫瘤組織蠟塊固定于切片機上進行切片,然后進行脫蠟及水化、蘇木素染色、鹽酸乙醇分化、伊紅染色、脫水透明及封片,鏡下觀察各組切片中腫瘤組織病理變化,拍照。
1.6 腫瘤組織中VEGF、Caspase-3蛋白檢測 將石蠟包埋的腫瘤標本做4 μm厚切片,常規(guī)脫蠟水化,微波修復抗原,3%H2O2室溫孵育7 min,阻斷內源性過氧化物酶,滴加10%山羊血清封閉,加1∶100稀釋的一抗,4 ℃冰箱孵育過夜,PBS洗滌后加二抗(辣根過氧化物酶標記),DAB顯色2~4 min,蘇木素復染,樹脂封片,鏡下觀察拍照。圖片收集后用Image Pro Plus6.0圖像分析軟件進行分析,以目的蛋白陽性表達區(qū)域的積分密度值表示目的蛋白相對表達量。
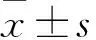
2 結果
2.1 各組瘤重和腫瘤抑制率比較 SAMC干預后裸鼠皮下移植瘤的生長速度減緩,并隨SAMC濃度的升高移植瘤生長速度受抑制越明顯。對照組、低劑量SAMC組、高劑量SAMC組、紫杉醇組瘤重分別為(3.05±0.26)、(2.36±0.18)、(2.09±0.14)、(1.92±0.16)g,低劑量SAMC組、高劑量SAMC組、紫杉醇組瘤重低于對照組(P均<0.05)。低劑量SAMC組、高劑量SAMC組、紫杉醇組抑瘤率分別為22.62%±0.28%、31.48%±0.23%、37.05%±0.12%,高劑量SAMC組腫瘤抑制率高于低劑量SAMC組(P<0.05),但與紫杉醇組相比差異無統(tǒng)計學意義。
2.2 各組腫瘤組織病理變化 對照組腫瘤組織細胞排列緊密,細胞體積增大形態(tài)不規(guī)則。低劑量SAMC組中組織細胞排列疏松,出現(xiàn)較為分散的小面積的細胞壞死。高劑量SAMC組出現(xiàn)較大面積的細胞壞死,細胞結構消失。紫杉醇組細胞壞死更為徹底,壞死區(qū)呈均質紅染。見圖1。

注:A為對照組;B為低劑量SAMC組;C為高劑量SAMC組;D為紫杉醇組。
圖1各組腫瘤組織病理變化(箭頭指示壞死區(qū))
2.3 各組腫瘤組織中Caspase-3、VEGF蛋白表達比較 鏡下觀察到Caspase-3蛋白表達于乳腺癌細胞的胞質及部分胞膜,陽性表達產(chǎn)物染色后呈現(xiàn)棕黃色(見圖2)。VEGF表達于乳腺癌細胞的胞質內,鏡下見棕黃色顆粒,呈團塊狀或片狀分布(見圖3)。對照組、低劑量SAMC組、高劑量SAMC組、紫杉醇組腫瘤組織中Caspase-3蛋白相對表達量分別為9 763±814、13 626±912、16 732±631、18 955±738,VEGF蛋白相對表達量分別為8 810±625、6 979±780、4 945±537、3 231±569。對照組、低劑量SAMC組、高劑量SAMC組、紫杉醇組腫瘤組織中Caspase-3蛋白相對表達量依次升高,VEGF相對表達量依次降低(P均<0.05)。

注:A為對照組;B為低劑量SAMC組;C為高劑量SAMC組;D為紫杉醇組。
圖2各組腫瘤組織Caspase-3蛋白表達情況

注:A為對照組;B為低劑量SAMC組;C為高劑量SAMC組;D為紫杉醇組。
圖3各組腫瘤組織中VEGF蛋白表達情況
3 討論
目前天然植物提取物以其抗腫瘤效果好、不良反應少等優(yōu)點成為抗惡性腫瘤藥物研究的熱點領域之一。大蒜中所含有的多種含硫化合物活性成分不僅可預防癌癥發(fā)生,還具有抗腫瘤作用。流行病學調查研究表明大蒜的攝入量與許多惡性腫瘤發(fā)病率呈反比[10]。SAMC作為大蒜主要活性成分之一,其抗腫瘤作用已得到廣泛證實。本實驗通過建立乳腺癌細胞裸鼠移植瘤模型,應用不同濃度劑量SAMC進行干預,觀察其體內抗腫瘤作用并探索可能的機制。本研究結果顯示,對照組瘤重高于其余三組,高劑量SAMC組腫瘤抑制率高于低劑量SAMC組,但與紫杉醇組相比差異無統(tǒng)計學意義;腫瘤組織HE染色見低劑量SAMC組、高劑量SAMC組、紫杉醇組出現(xiàn)不同程度的細胞壞死,三組壞死面積和程度依次增大。這初步證實了SAMC可顯著抑制乳腺癌裸鼠皮下移植瘤生長,提示SAMC在裸鼠體內可發(fā)揮抗腫瘤作用。
為進一步探討SAMC的抑瘤作用機制,我們采用免疫組化法檢測了腫瘤組織中的Caspase-3蛋白和VEGF蛋白。Caspase家族是一組半胱氨酸蛋白酶,特異性切割天冬氨酸,在細胞凋亡過程中有重要作用。目前研究[11,12]表明Caspase-3處于依賴Caspase家族級聯(lián)反應的3條凋亡信號傳導通路的關鍵環(huán)節(jié),是最重要的細胞凋亡過程中的效應分子。本研究結果顯示低劑量SAMC組、高劑量SAMC組及紫杉醇組Caspase-3蛋白表達水平均高于對照組,且高劑量SAMC組高于低劑量SAMC組,但低于紫杉醇組,提示SAMC可提高乳腺癌組織中Caspase-3蛋白的表達水平,進而促進細胞凋亡的發(fā)生。同時,有研究表明SAMC可以通過上調p53、p21表達,誘導細胞周期阻滯在G0/G1期,觸發(fā)線粒體凋亡途徑等機制誘導乳腺癌細胞凋亡[13]。
目前研究發(fā)現(xiàn),惡性腫瘤的增殖、浸潤及遠處轉移特性均以有效血液供應為基礎[14]。新生小血管為腫瘤組織快速生長提供所需營養(yǎng)物質[15]。VEGF作用于血管內皮細胞,可強烈促進其有絲分裂,促使新血管形成,已被認為是促進惡性腫瘤血管生成的最強細胞因子[16,17]。研究表明,VEGF不僅可以促進內皮細胞增殖,增加血管通透性,還可上調Bcl-2基因表達,發(fā)揮抑制腫瘤細胞凋亡,從而間接起到促腫瘤細胞增殖及生長的作用[18,19]。近來相關研究提示VEGF可能參與了惡性腫瘤的演變過程,并且與乳腺癌惡性程度有一定的相關性[20]。本研究觀察了各組腫瘤組織中VEGF的表達變化,結果顯示低劑量SAMC組、高劑量SAMC組及紫杉醇組Caspase-3蛋白表達水平均低于對照組,高劑量SAMC組低于低劑量SAMC組,但高于紫杉醇組,提示SAMC可能通過下調乳腺癌組織中VEGF的表達,抑制組織內新血管的生成能力,使腫瘤組織營養(yǎng)供給不足,進而抑制其生長并促進組織壞死。
綜上所述,SAMC可抑制乳腺癌細胞裸鼠移植瘤的生長,機制可能與Caspase-3蛋白表達上調、VEGF蛋白表達下調有關。在接下來的研究中,我們將進一步深入探索SAMC抑制乳腺癌的相關分子機制,為研發(fā)新抗腫瘤藥物、探索抗腫瘤治療新靶點提供理論依據(jù)。
[1] Turkoz FP, Solak M, Petekkaya I, et al. Association between common risk factors and molecular subtypes in breast cancer patients[J]. Breast, 2013,22(3):344-350.
[2] Protani M, Page A, Taylor R, et al. Breast cancer risk factors in Queensland women attending population-based mammography screening[J]. Maturitas, 2012,71(3):279-286.
[3] Akarolo-Anthony SN, Ogundiran TO, Adebamowo CA. Emerging breast cancer epidemic: evidence from Africa[J]. Breast Cancer Res, 2010,12(4):8.
[4] Huang YS, Xie N, Su Q, et al. Diallyl disulfide inhibits the proliferation of HT-29 human colon cancer cells by inducing differentially expressed genes[J]. Mol Med Rep, 2011,4(3):553-559.
[5] Khuda-Bukhsh AR, Das S, Saha SK. Molecular approaches toward targeted cancer prevention with some food plants and their products: inflammatory and other signal pathways[J]. Nutrit Cancer, 2014,66(2):194.
[6] 梁宗英,張樂,侯繼申,等.大蒜素對肺癌細胞增殖與凋亡的影響[J].山東醫(yī)藥,2017,57(6):27-29.
[7] Park JE, Woo SR, Kang CM, et al. Paclitaxel stimulates chromosomal fusion and instability in cells with dysfunctional telomeres: implication in multinucleation and chemosensitization[J]. Biochem Biophys Res Commun, 2011,404(2):615-621.
[8]李淑芬,孟文靜,賈勇圣.卡培他濱聯(lián)合長春瑞濱治療轉移性乳腺癌的臨床進展[J].實用腫瘤雜志,2014,29(4):391-394.
[9]韋長元.紫杉類藥物在晚期乳腺癌治療中的應用[J].中國癌癥防治雜志,2013,5(3):197-200.
[10] Casella S, Leonardi M, Melai B, et al. The role of diallyl sulfides and dipropyl sulfides in the in vitro antimicrobial activity of the essential oil of garlic, Allium sativum L. and leek, Allium porrum L[J]. Phytother Res, 2013,27(3):380-383.
[11] Fuchs Y, Steller H. Programmed Cell Death in Animal Development and Disease[J]. Cell, 2011,147(4):742.
[12] Hu Q, Peng J, Liu W, et al. Elevated cleaved caspase-3 is associated with shortened overall survival in several cancer types[J]. Int J Clin Exp Pathol, 2014,7(8):5057.
[13] Zhang H, Wang K, Lin G, et al. Antitumor mechanisms of S-allyl mercaptocysteine for breast cancer therapy[J]. BMC Complement Altern Med, 2014,14(1):270.
[14]于海明,楊俊蘭,焦順昌.乳腺癌腫瘤免疫微環(huán)境研究進展[J].解放軍醫(yī)學院學報,2013(6):664-666.
[15]閆金銀,韓龍才,李寧,等.S-烯丙基巰基半胱氨酸對裸鼠移植瘤腫瘤細胞凋亡及血管生成作用的研究[J].中國煤炭工業(yè)醫(yī)學雜志,2015,18(8):1352-1356.
[16] Fan X, Krieg S, Kuo CJ, et al. VEGF blockade inhibits angiogenesis and reepithelialization of endometrium[J]. Faseb J, 2008,22(10):3571.
[17] Blank S, Deck C, Dreikhausen L, et al. Angiogenic and growth factors in gastric cancer[J]. J Surg Res, 2015,194(2):420-429.
[18] 劉崇梅,李岳,林明暉,等.VEGF在乳腺癌中的表達及其與ER、PR的相關性研究[J].現(xiàn)代腫瘤醫(yī)學,2012,20(3):527-529.
[19] García-Roman J, Zentella-Dehesa A. Vascular permeability changes involved in tumor metastasis[J]. Cancer Lett, 2013,335(2):259.
[20] Sun L, Yu DH, Sun SY, et al. Expressions of ER, PR, HER-2, COX-2, and VEGF in primary and relapsed/metastatic breast cancers[J]. Cell Biochem Biophys, 2014,68(3):511-516.
10.3969/j.issn.1002-266X.2017.39.010
R737.9
A
1002-266X(2017)39-0036-03
蔡海峰(E-mail: 13303050005@163.com)
2017-06-10)

