干預(yù)FoxM1表達對食管癌細胞增殖、周期及凋亡的影響
陳 潔,嚴曉娣,張東升,錢紅運,陳瑞嬌,周方正
干預(yù)FoxM1表達對食管癌細胞增殖、周期及凋亡的影響
陳 潔1,嚴曉娣2,張東升1,錢紅運3,陳瑞嬌3,周方正1
目的探討干預(yù)FoxM1表達對食管癌細胞增殖、細胞周期及凋亡的影響。方法選擇FoxM1高表達食管癌細胞株,構(gòu)建FoxM1-shRNA干擾質(zhì)粒轉(zhuǎn)染食管癌細胞,觀察干預(yù)FoxM1表達對食管癌細胞增殖、細胞周期及凋亡的影響。結(jié)果成功轉(zhuǎn)染后細胞中FoxM1蛋白水平表達明顯降低(t=13.17,P<0.01),細胞增殖明顯受抑并呈時間依賴性,72 h抑制效果最顯著(68.0%±6.4%,P<0.05);干預(yù)組細胞增殖周期發(fā)生G1期阻滯(59.14%±1.69%vs40.51%±1.45%,t=14.23,P<0.01)、細胞凋亡增加(2.48%±0.49%vs35.37%±0.56%,t=76.56,P<0.01)。結(jié)論干預(yù)FoxM1表達使細胞周期發(fā)生G1期阻滯并能促進細胞凋亡,從而抑制TE1細胞增殖,F(xiàn)oxM1可能是食管癌基因治療潛在的有效靶點。
食管癌;叉頭框轉(zhuǎn)錄因子M1;基因沉默;細胞增殖;細胞凋亡
食管癌是最常見的惡性腫瘤之一,列腫瘤相關(guān)死亡因素第三位,全球每年新發(fā)病例約48萬,死亡病例約40萬,且發(fā)病率呈逐年上升的趨勢[1]。我國是全球食管癌高發(fā)地區(qū)之一,以食管鱗癌(esophageal squamous cell carcinoma,ESCC)占絕大多數(shù)[1, 2]。盡管采取積極手術(shù)、放化療等多途徑聯(lián)合治療,但絕大多數(shù)患者仍死于腫瘤局部復發(fā)及遠處轉(zhuǎn)移[3]。
新近研究發(fā)現(xiàn)叉頭框轉(zhuǎn)錄因子M1 ( forkhead box protein M1, FoxM1)作為一種增生相關(guān)的轉(zhuǎn)錄因子,在食管癌細胞中表達具有一定特異性及敏感性,被認為是食管癌特異性治療的潛在靶點[4]。本文采用RNA干擾(RNA interference, RNAi)技術(shù),以特異性shRNA下調(diào)FoxM1表達,觀察其對食管癌細胞增殖、周期等生物學活性的影響,探討其靶向治療價值,為食管癌靶向治療提供理論依據(jù)。
1 材料與方法
1.1 細胞株來源與細胞培養(yǎng) 正常食管上皮細胞株(HEEC)及食管癌細胞株(Eca109、TE1、TE7、TE2)均購自中國科學院上海生命科學研究院生物化學與細胞生物學研究所。用含10%胎牛血清的DMEM培養(yǎng)基培養(yǎng)液(美國Invitrogen公司),在孵箱(37 ℃、5%CO2)中貼壁培養(yǎng),細胞基本鋪滿瓶底時傳代。
1.2 細胞轉(zhuǎn)染及篩選 依據(jù)GenJetTM DNA In Vitro Transfection Reagent (美國SignaGen公司)試劑說明書進行轉(zhuǎn)染。細胞密度達到80%左右時,將細胞分為空白組(Untreated)、陰性組(shRNA-Neg)及干預(yù)組(shRNA),以GenJetTM轉(zhuǎn)染試劑分別將FoxM1-shRNA或neg-shRNA轉(zhuǎn)染至食管癌細胞。轉(zhuǎn)染48 h后在倒置熒光顯微鏡下計算轉(zhuǎn)染效率并收集細胞備用。
1.3 蛋白質(zhì)印跡法 收集足夠數(shù)量細胞依據(jù)試劑說明書進行蛋白抽提。每泳道加50 μg蛋白,在10%SDS 聚丙烯酰胺凝膠電泳,轉(zhuǎn)膜,封閉,加入兔抗人FoxM1(1∶500)或β-actin抗體(1∶1000),β-actin為內(nèi)參,4 ℃過夜,辣根過氧化物酶標記的羊抗兔IgG二抗(1∶1000) 37 ℃孵育1 h,洗滌后ECL顯色并拍照。
1.4 CCK-8法檢測細胞增殖 細胞轉(zhuǎn)染48 h后收集細胞,分別接種于96孔板(n=5),每組分調(diào)零、空白、陰性及干預(yù)孔,每組含復孔5個,分別在規(guī)定的時間點添加CCK-8試劑(日本同仁化學研究所),培養(yǎng)4 h,脫色搖床1 min,酶標儀檢測A450值。
1.5 細胞周期分析 轉(zhuǎn)染48 h后,換新鮮完全培養(yǎng)液繼續(xù)培養(yǎng)24 h后收集細胞,在-20 ℃ 70%預(yù)冷乙醇固定過夜,用預(yù)冷PBS洗滌沉淀后加0.5 ml碘化丙啶染色,避光溫浴30 min(37 ℃),再冰浴避光存放;流式細胞儀檢測紅色熒光(488 nm波長),利用Multicycle軟件(Beckman Coulter公司)收集、存儲和分析數(shù)據(jù)。
1.6 Annexin V-PE/7-ADD雙染檢測細胞凋亡 轉(zhuǎn)染48 h后換新鮮完全培養(yǎng)液繼續(xù)培養(yǎng)24 h后收集細胞,加入500 μl緩沖液懸浮細胞,再加1 μl Annexin V-PE混勻,室溫避光反應(yīng)15 min;最后加5 μl 7-ADD,輕輕混勻,室溫避光反應(yīng)15 min后用流式細胞儀檢測分析結(jié)果。
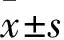
2 結(jié) 果
2.1 FoxM1蛋白在不同食管癌細胞株中表達情況 FoxM1/β-actin灰度強度比值分別為0.15±0.04、0.61±0.11、0、0.03±0.09及0.48±0.05;FoxM1蛋白在正常食管上皮細胞株中幾乎不表達,在食管癌細胞株(Eca109、TE1、TE2、TE7)中呈不同程度表達(圖1),其中TE1細胞株中表達水平最高,選擇TE1細胞株用于后續(xù)研究。

圖1 Western blotting分析不同食管癌細胞中FoxM1蛋白表達(n=3)
2.2 FoxM1-shRNA轉(zhuǎn)染食管癌細胞 倒置熒光顯微鏡下成功轉(zhuǎn)染的細胞帶綠色熒光(圖2),轉(zhuǎn)染效率為93%(n=5)。

圖2 FoxM1-shRNA轉(zhuǎn)染食管癌細胞后普通光鏡與熒光顯微鏡圖(×200)
2.3 FoxM1-shRNA下調(diào)食管癌細胞FoxM1表達水平 空白組(Untreated)、陰性組(shRNA-Neg)及干預(yù)組(shRNA)FoxM1/β-actin灰度強度比值分別為0.39±0.07、0.41±0.02和0.07±0.04(t=13.17,P<0.01),陰性組與空白組間未見統(tǒng)計學差異(t=0.48,P>0.05),見圖3。

圖3 shRNA下調(diào)食管癌細胞中FoxM1蛋白表達水平(n=3)
2.4 FoxM1-shRNA抑制食管癌細胞增殖 FoxM1-shRNA組24 h、48 h及72 h生長抑制率分別為(49.0±6.3)%、(56.0±4.5)%及(68.0±6.4)%,抑制作用呈時間依賴性,72 h作用最顯著。
2.5 FoxM1-shRNA影響食管癌細胞增殖周期 干預(yù)組G1期細胞明顯增多(t=14.23,P<0.01),S期細胞減少(t=14.08,P<0.01),G2期改變無統(tǒng)計學差異,陰性組與空白組間未見明顯差異。

表1 流式細胞術(shù)分析細胞周期含量改變 (n=3;;%)
注:與空白組比較,①P<0.01;與陰性組比較,②P<0.01
2.6 FoxM1-shRNA促進食管癌細胞凋亡 空白組、陰性組及干預(yù)組細胞凋亡率分別為(2.48±0.49)%、(2.56±0.71)%及(35.37±0.56)%,干預(yù)組細胞凋亡率顯著增高(t=76.56,P<0.01),陰性組與空白組間未見統(tǒng)計學差異。
3 討 論
手術(shù)及放、化療是食管癌的主要治療手段,但是其高復發(fā)率及轉(zhuǎn)移率,導致ESCC預(yù)后極差。尋找更加有效的早期診斷及治療方法是當前亟待解決的問題。
ESCC發(fā)生發(fā)展是一個復雜的多階段過程,但其具體分子機制尚不完全清楚。FoxM1是增生相關(guān)的轉(zhuǎn)錄因子,通過對多種基因轉(zhuǎn)錄調(diào)控實現(xiàn)G1/S轉(zhuǎn)換及G2/M轉(zhuǎn)換,促進有絲分裂進行,同時涉及DNA損傷修復、染色體組裝、蛋白合成等生物學過程,在生命現(xiàn)象中發(fā)揮重要作用[3, 5]。FoxM1在肺癌、乳腺癌、結(jié)腸癌、卵巢癌等多種惡性腫瘤中異常過度表達并與腫瘤發(fā)生及轉(zhuǎn)移密切相關(guān)[6-10],提示FoxM1可能在腫瘤增殖過程中扮演癌基因的角色。已有研究發(fā)現(xiàn)FoxM1在食管癌細胞中表達具有一定特異性及敏感性,被認為是食管癌特異治療的潛在靶點,本文采用RNAi技術(shù)[11, 12]構(gòu)建FoxM1-shRNA質(zhì)粒,特異性抑制食管癌細胞FoxM1表達,研究對細胞增殖、細胞周期及凋亡等生物學行為的影響,初步探討其應(yīng)用于靶向治療的可能。
FoxM1蛋白在4種食管癌細胞株(Eca109、TE1、TE2及TE7)中呈差異表達,其中TE1細胞株中表達水平最高,選擇TE1細胞株用于后續(xù)研究,與課題組前期研究FoxM1在食管鱗癌組織中呈高表達而在癌周正常組織不表達結(jié)果相一致。構(gòu)建特異性干擾序列FoxM1-shRNA成功轉(zhuǎn)染至TE1細胞,干預(yù)組FoxM1蛋白水平降低,提示該質(zhì)粒在體外能夠干預(yù)FoxM1表達,符合設(shè)計要求,用于后續(xù)實驗。
觀察干預(yù)FoxM1表達對TE1細胞增殖、周期及凋亡等生物學行為的影響。干預(yù)組細胞增殖受到抑制,呈時間依賴性,提示干預(yù)FoxM1能夠抑制TE1細胞增殖,該作用呈時間依賴性,與文獻[4]相關(guān)報道一致。為探討干預(yù)FoxM1所產(chǎn)生的生長抑制效應(yīng)是否涉及細胞凋亡及細胞周期進程的改變,利用流式細胞儀檢測干預(yù)后細胞DNA含量分布,干預(yù)組G1期細胞增多,S期細胞減少,G2期改變不明顯,提示細胞增殖周期發(fā)生G1期阻滯;利用流式細胞儀檢測干預(yù)后細胞分布,干預(yù)組細胞凋亡率顯著增高。
關(guān)于FoxM1在其他惡性腫瘤中的研究發(fā)現(xiàn)過表達FoxM1分子的腫瘤細胞,在敲除FoxM1后,腫瘤細胞增殖、抗凋亡及侵襲能力顯著受抑[13-16]。研究發(fā)現(xiàn)呼吸道上皮細胞中FoxM1的表達是肺癌形成及TOPO-2α表達的關(guān)鍵因素,在MCA/BHT誘導腫瘤形成之前,選擇性敲除FoxM1基因的轉(zhuǎn)基因小鼠FoxM1-/-的肺癌數(shù)量及體積均顯著下降,這可能與TOPO-2α(調(diào)節(jié)腫瘤細胞增殖的關(guān)鍵因子)基因表達下調(diào)有關(guān),F(xiàn)oxM1識別其啟動子序列,結(jié)合并誘導其表達,間接促進腫瘤細胞的增殖;后續(xù)研究證實肺部腫瘤形成后FoxM1缺失可延緩腫瘤的進展,進一步敘述了FoxM1促進腫瘤發(fā)生發(fā)展的機制[17]。應(yīng)用RNA干擾技術(shù)使乳腺癌的MDA-MB-231細胞系的癌細胞內(nèi)轉(zhuǎn)入PEI相關(guān)的物質(zhì)后可導致癌細胞內(nèi)FOXM1表達水平下調(diào),同時癌細胞內(nèi)蛋白表達水平下降,并且Cdc25B的mRNA的水平亦下降。本研究結(jié)果提示:在敲除FoxM1后,腫瘤細胞的增殖、抗凋亡及侵襲能力顯著受抑,表明調(diào)控FoxM1的表達水平,或許能控制腫瘤的生長。
綜上所述,干預(yù)FoxM1表達使細胞周期發(fā)生G1期阻滯并促進細胞凋亡,從而抑制TE1細胞增殖,F(xiàn)oxM1可能是食管癌基因治療潛在的有效靶點。
[1] Lam E W, Brosens J J, Gomes A R,etal. Forkhead box proteins: tuning forks fortranscriptional harmony [J]. Nat Rev Cancer,2013, 13(7): 482-495.
[2] Koo C Y, Muir K W, Lam E W. FOXM1: from cancer initiation to progression andtreatment [J]. Biochim Biophys Acta, 2012, 1819(1): 28-37.
[3] Wierstra I, Alves J. FoxM1, a typical proliferation associated transcription factor [J]. Biol Chem, 2007, 388(12): 1257-1274.
[4] 蓋 領(lǐng),茅國新,劉 軍,等.叉頭框轉(zhuǎn)錄因子M1蛋白在食管鱗癌細胞和組織中的表達及意義[J]. 中華腫瘤雜志, 2016,38(3):179-184.
[5] Wu X, Gu X, Han X,etal. A novel function for FoxM1 in interkinetic nuclear migration in the developing telencephalon and anxiety-related behavior [J]. J Neurosci, 2014, 34(4): 1510-1522.
[6] Huang C, Xie D, Cui J,etal. FOXM1c promotes pancreatic cancer epithelial to mesenchymal transition and metastasis via upregulation of expression of the urokinase plasminogen activator system [J]. Clin Cancer Res, 2014, 20(6): 1477- 1488.
[7] Xia L, Huang W, Tian D,etal. Overexpression of forkhead box C1 promotes tumor metastasis and indicates poor prognosis in hepatocellular carcinoma [J]. Hepatology, 2013, 57(2): 610-624.
[8] Kong F F, Qu Z Q, Yuan H H,etal. Overexpression of FOXM1 is associated with EMT and is a predictor of poor prognosis in non-small cell lung cancer [J]. Oncol Rep, 2014, 31(6): 2660-2668.
[9] Arora R, Yates C, Gary B D,etal. Panepoxydone targets NF-kB and FOXM1 to inhibit proliferation, induce apoptosis and reverse epithelial to mesenchymal transition in breast cancer [J]. PLoS One, 2014, 9(6): e98370.
[10] Wen N, Wang Y, Wen L,etal. Overexpression of FOXM1 predicts poor prognosis and promotes cancer cell proliferation, migration and invasion in epithelial ovarian cancer [J]. J Transl Med, 2014, 12(134): 1-13.
[11] Cheng A L, Kang Y K, Chen Z,etal. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial [J]. Lancet Oncol, 2009, 10(1): 25-34.
[12] Lee Y L, Ahn B C, Lee Y,etal. Targeting of hepatocellular carcinoma with glypican-3 targeting peptide ligand [J]. J Pept Sci, 2011, 17(11): 763-769.
[13] Li X R, Chu H J, Lv T,etal. miR-342-3p suppresses proliferation, migration and invasion by targeting FOXM1 in human cervical cancer [J]. FEBS Lett, 2014, 588(17): 3298-3307.
[14] Zhou J, Wang Y, Wang Y,etal. FOXM1 modulates cisplatin sensitivity by regulating EXO1 in ovarian cancer [J]. PLoS One, 2014, 9(5): e96989.
[15] Miao L, Xiong X, Lin Y,etal. Down-regulation of FoxM1 leads to the inhibition of the epithelial-mesenchymal transition in gastric cancer cells [J]. Cancer Genet, 2014, 207(3): 75-82.
[16] Chen T, Xiong J, Yang C,etal. Silencing of FOXM1 transcription factor expression by adenovirus-mediated RNA interference inhibits human hepatocellular carcinoma growth [J]. Cancer Gene Ther, 2014, 21(3): 133-138.
[17] Wang I C, Meliton L, Ren X,etal. Deletion of Forkhead Box M1 transcription factor from respiratory epithelial cells inhibits pulmonary tumorigenesis [J]. PLoS One, 2009,4(8):e6609.
Effectsofdown-regulationofFoxM1expressionsonproliferationandapoptosisofesophagealsquamouscellcarcinomacells
CHEN Jie1, YAN Xiaodi2, ZHANG Dongsheng1, QIAN Hongyun3, CHEN Ruijiao3, and ZHOU Fangzheng1.
1.Oncology Department of Suizhou Central Hospital, Affiliated Hospital of Hubei University of Medicine, Suizhou 441300, China;2.Tumor Radiotherapy Department of Affiliated Hospital of Nantong University, Nantong 22600, China; 3. Clinical Medicine Department of Hubei University of Medicine, Shiyan 442000, China
ObjectiveTo investigate the effects of down-regulation of forkhead box protein M1 (FoxM1) expressions by shRNA on proliferation and apoptosis of esophageal squamous cell carcinoma (ESCC) cells.MethodsPlasmid that highly expressed FoxM1-shRNA was successfully constructed and transfected with TE1 cell line. FoxM1 was analyzed by Western blot. Cell proliferation was tested by cell counting kit-8 while cell cycle and apoptosis were analyzed by flow cytometry and Annexin-V-PE/7-AAD staining kit.ResultsFoxM1 expressions in ESCC cells transfected with specific shRNA were significantly down-regulated at the protein level and cell proliferation was inhibited in a time-dependent manner. The inhibition rate was 68.0%±6.4% (P<0.05), with cell cycle arrested at G1phase arrest (59.14%±1.69%vs40.51%±1.45%,t=14.23,P<0.01)and the apoptosis rate of TE1 cells reached 35.37% (2.48%±0.49%vs35.37%±0.56%,t=76.56,P<0.01).ConclusionsInterventions with FoxM1 gene expressions can inhibit the proliferation and apoptosis of ESCC cells, suggesting that FoxM1 can be a novel therapeutic target for ESCC.
esophageal squamous cell carcinoma; forkhead box protein M1; gene silencing; cell proliferation; apoptosis
2016年湖北省教育廳科學研究計劃指導性項目(B2016120),2015年隨州市科研立項(2015SMR003),2016年隨州市科研立項(2016SZ32005)。
陳 潔,碩士,住院醫(yī)師。
1.441300, 湖北醫(yī)藥學院附屬隨州醫(yī)院 隨州市中心醫(yī)院腫瘤科;2.226001, 南通大學附屬醫(yī)院放療科;3. 422000 十堰,湖北醫(yī)藥學院臨床醫(yī)學系
周方正,E-mail: 918771802@qq.com
R735.1
(2017-06-02收稿 2017-07-16修回)
(責任編輯 武建虎)

