不同鄰居物種的基因型多樣性對冷蒿生長的影響
劉 磊, 辛曉靜, 王宇坤, 曲耀冰, 楊 雪, 李隔萍, 趙念席, 高玉葆
南開大學生命科學學院, 天津 300071
不同鄰居物種的基因型多樣性對冷蒿生長的影響
劉 磊, 辛曉靜, 王宇坤, 曲耀冰, 楊 雪, 李隔萍, 趙念席*, 高玉葆
南開大學生命科學學院, 天津 300071
植物物種多樣性與基因型多樣性對群落的結構和功能具有重要的生態作用,近年來植物基因型多樣性對植物間相互作用的影響已成為研究者關心的重要科學問題。實驗選擇退化草原優勢種冷蒿(Artemisiafrigida)為目標植物,穩定群落建群種羊草(Leymuschinensis)和群落伴生種洽草(Koeleriacristata)為鄰居植物,來研究基因型多樣性不同的鄰居植物對冷蒿生長表現(株高、地上生物量、地下生物量和總生物量)的影響,并通過測量植物相對競爭強度及鄰居植物性狀變異來進一步探究鄰居植物基因型多樣性對目標植物影響的內在機制。結果表明:(1)鄰居物種為羊草時,基因型多樣性對冷蒿的生長表現影響顯著,當鄰居為6基因型時,冷蒿的株高、地上生物量以及總生物量顯著低于單基因型和3基因型時的表現(P<0.05),且相對競爭強度高于其他兩種處理;而鄰居物種為洽草時,基因型多樣性對冷蒿所有觀測指標以及相對競爭強度的影響均不顯著(P>0.05)。(2)利用主成分分析法來分析基因型多樣性對自身性狀變異的影響發現,鄰居物種為羊草時,基因型多樣性對性狀變異響應顯著,主要表現為3基因型時,羊草種群的株高、總生物量、地上生物量顯著高于單基因型時的表現(P<0.05);而鄰居物種為洽草時,基因型多樣性對性狀變異影響不顯著(P>0.05)。(3)鄰居物種為羊草時,羊草總生物量和比葉面積與冷蒿的地上生物量和總生物量呈顯著負相關(P<0.05);鄰居物種為洽草時,洽草各性狀與冷蒿性狀間無顯著相關性(P>0.05)。實驗結果揭示,基因型多樣性對目標植物生長的效應受鄰居植物種類的影響,穩定群落建群種羊草高基因型組合能顯著抑制冷蒿的生長,這可能與羊草高基因型多樣性種群性狀變異大且對冷蒿有較高的相對競爭強度有關。所得結果為建群種基因型多樣性影響種間相互作用提供了實驗證據,為草原的合理利用和保護提供了理論指導。
鄰居植物;目標植物;植物間相互作用;基因型多樣性;競爭;性狀
群落植物多樣性(物種多樣性或者種內基因型多樣性)對群落的結構和功能具有重要的生態作用,多數研究表明高多樣性對增加群落或種群的生產力[1- 3]、維持生態系統的穩定性[4- 7]等方面具顯著的正效應。眾所周知,植物-植物相互作用(plant-plant interaction)隨環境條件的變化是塑造群落結構和動態特征的主要動力之一[8- 9],隨著全球氣候變化和人類活動的加劇,生物多樣性急劇降低,近年來,物種多樣性或者物種基因型多樣性是否會影響植物-植物相互作用進而影響群落結構逐漸成為生態學領域的熱點問題[10- 12]。
已有研究表明,植物多樣性作為重要的一個生物環境因子,會對鄰居植物(neighboring plant)產生影響[4,13-14]。Lipowssky 等對耶拿(Jena experiment)生物多樣性試驗田的研究顯示,處理組為高物種多樣性(60種植物)時,被移入的5種草本植物的生長會受到抑制,表現為株高降低、葉片數減少[13]。Parachnowitsch 等在研究目標植物(target plant)月見草(Oenotherabiennis)與不同基因型多樣性的鄰居植物月見草共同生長時發現,目標植物月見草的9個性狀(比葉面積、株高、生物量、節間長度等)的生長表現受到鄰居植物月見草基因型多樣性的影響,但未達顯著水平[14]。Crutsinger等對分別由1,3,6,12基因型組成的北美一枝黃花(Solidagoaltissima)樣方中外來植物的生長情況調查發現,北美一枝黃花的基因型多樣性顯著抑制外來物種的生長[4]。就目前的研究結果來看,鄰居植物多樣性對目標植物的影響結果并不完全一致,這可能與所選植物的種類有關。就已有的鄰居植物多樣性顯著影響目標植物表現的結果進行分析,其影響機制主要集中在兩個方面:一、鄰居物種的多樣性影響自身性狀的變異,進而影響了鄰居物種與目標物種的相互作用[15- 17];二、鄰居物種的多樣性改變了鄰居物種與目標物種的相對競爭強度,鄰居物種的多樣性能夠通過生態位互補增加種群的競爭強度[18- 20]。
典型草原是我國北方草原主要的草原類型之一,近半個世紀以來,頻繁的人類活動、氣候異常等使得典型草原退化加劇[21- 23],典型草原原生群落中作為伴生種的冷蒿(Artemisiafrigida)在群落中的多度逐漸增加,甚至成為優勢種或者建群種[24],從而改變草原的結構和功能。及時了解冷蒿與群落內其他物種的關系是否與它們的基因型多樣性有關聯,已經成為恢復生態學家亟需解決的問題。
因此,本研究選取冷蒿為目標植物,選取在典型草原原生群落中具有不同功能的兩個物種(群落建群種羊草(Leymuschinensis)以及群落伴生種洽草(Koeleriacristata)[25]作為鄰居植物,通過分析(1)鄰居植物的基因型多樣性對冷蒿生長表現以及冷蒿競爭能力的影響,(2)鄰居植物多樣性對自身性狀變異的影響,來探究物種基因型多樣性對植物種間關系的影響及其內在機制。已有研究表明建群種羊草不同基因型間變異很大,具有物種相似的生態功能[18],因此提出科學假設:基因型多樣性高的羊草種群性狀變異大,并且能顯著提高對冷蒿的相對競爭強度。
1 材料與方法
1.1 實驗材料
目標植物:冷蒿,由一粒種子萌發得到冷蒿基株,后通過扦插繁殖得到該基株的大量相同基因型分株。鄰居植物:羊草和洽草。其中,羊草由野外采集植株,經分子標記確定不同的基株后[26],在經分蘗繁殖得到大量的同一基因型的分蘗;洽草的基株由種子萌發得到,后通過分蘗繁殖得到大量的同一基因型的分蘗;因洽草的有性繁殖為風媒異交,不同種子為同一基因型的幾率非常低[25],因此未經分子標記鑒定。
1.2 實驗方法
1.2.1 實驗種群的構建
本實驗分別用羊草和洽草作為鄰居物種設置不同的基因型多樣性水平,包括單基因型(G1)、三基因型(G3)及六基因型(G6)3種基因型數目組合,2015年8月30日在直徑19 cm的塑料盆中,放入2500 g內蒙古典型草原區羊草草原原生生境地表新鮮土壤,土壤全C、全N含量分別為10.5、0.74 g/kg。每盆中央分別移栽同樣基因型的冷蒿1株,在距其周圍2 cm處,移栽6株羊草或洽草單株分蘗。移栽時,鄰居植物基株的分蘗(羊草需去除根莖)按基株來源進行標號,修剪使得地上部高度為10 cm,地下根系長度為10 cm,地上部葉片數為4片。鄰居物種為羊草時,G1、G3、G6組合各9盆,共27盆。鄰居物種為洽草時,G1、G3和G6組合各15盆,共45盆。為計算冷蒿在與不同基因型多樣性鄰居物種混種時相對競爭強度的變化,還設置了冷蒿單獨種植15盆,羊草單獨種植27盆(G1 9盆;G3 9盆;G6 9盆),洽草單獨種植42盆(G1 12盆;G3 15盆;G6 15盆)。對移栽1周內死去的分蘗重新種植。實驗共持續130 d,實驗期間,土壤含水量控制在(10±2)%,無營養添加,定期除去雜草,無高溫和遮陽等脅迫;所有盆隨機放置,每周更換位置以避免位置效應。
1.2.2 指標的測定
2016年1月6日,以盆為單位,分基株統計各物種的株高(cm);以基株為單位選擇從內向外第二片完全展開的向陽葉片,測量葉面積,然后80℃烘干至恒重,萬分之一天平稱重得到葉片的干重(g),計算比葉面積(SLA) = 葉片干重 / 葉面積。2016年1月7日,以盆為單位,分基株收獲地上部及地下部,用EPSON 1680掃描儀(Epson, Long Beach, USA)以400 dpi分辨率掃描獲取鄰居植物根系圖像,并以WinRHIZO軟件分析得到根長(cm);隨后將收獲的樣品放入烘箱中,105℃殺青2h,80℃烘干至恒重,用萬分之一天平稱量,得到地上生物量、地下生物量和總生物量(地上生物量+地下生物)(g)。
1.3 數據分析
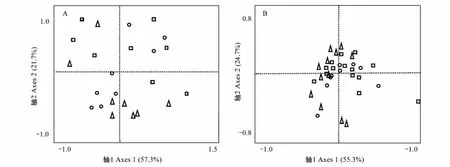
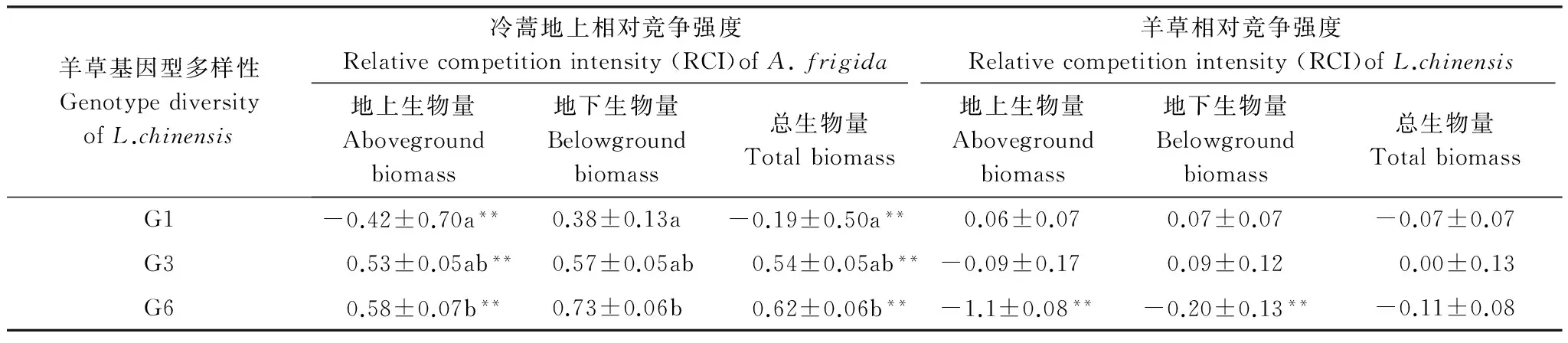
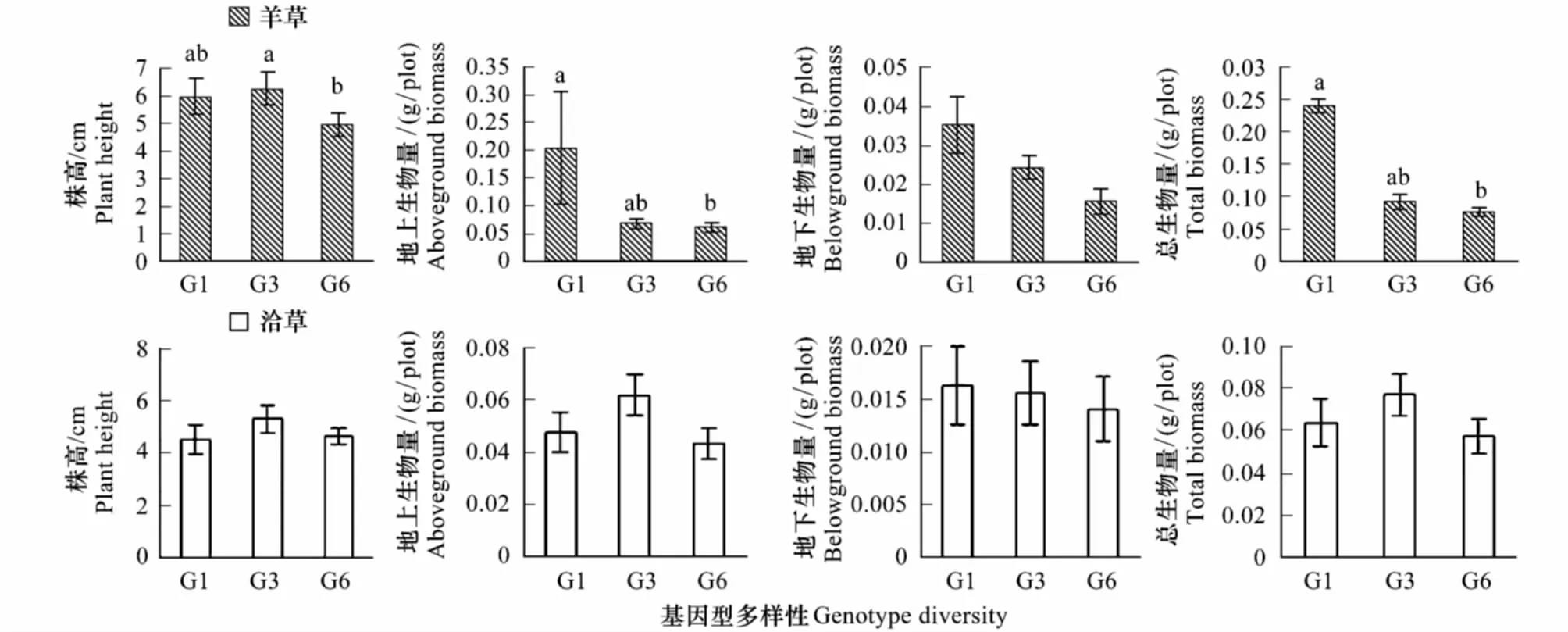
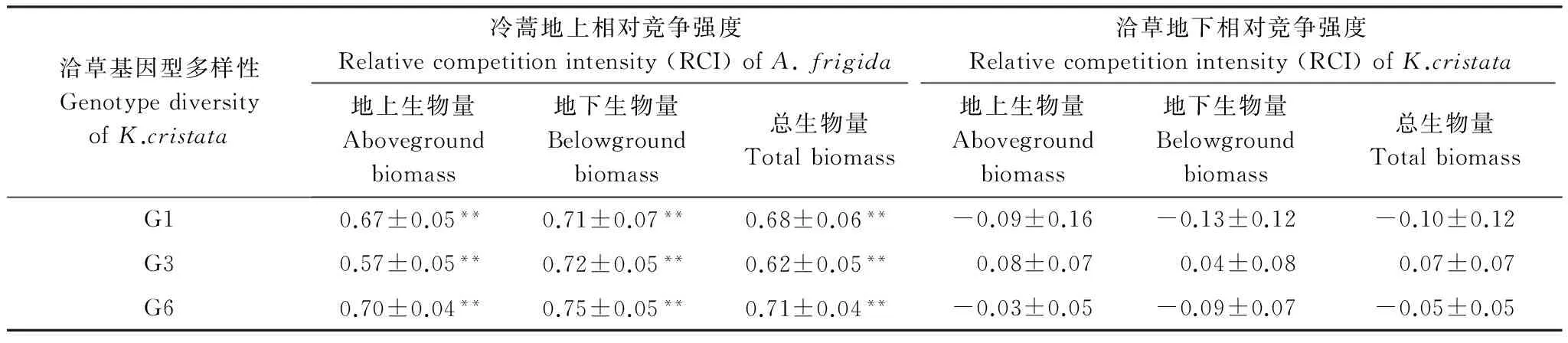
以盆為單位,利用公式RCI=Pmono-Pmix/Pmono計算相對競爭強度[27],式中Pmono為物種X(冷蒿、羊草或者洽草)單種時的生長表現(地上生物量、地下生物量和總生物量);Pmix為混種時物種X(冷蒿、羊草或者洽草)的生長表現。RCI可反映兩個植物(X和Y)個體之間競爭資源的能力,它所描述的是一個種群或群落中植物個體間的競爭過程,是植物表現的相對比值。由競爭強度值的大小可以得知以下兩個結果:(1)若RCIX= 0,則表明X、Y植物間不存在競爭;若0 采用單因素方差分析(one-way ANOVA)中的Duncan檢驗來檢測羊草(或洽草)基因型數目對冷蒿株高、地上生物量、地下生物量、總生物量4個生長指標的影響;用單樣本t-test檢驗檢測羊草(或洽草)與冷蒿在不同基因型多樣性下的相對競爭強度(地上相對競爭強度、地下相對競爭強度、總相對強度)與0差異的顯著性[27];利用主成分分析法(Principal Component Analysis,PCA)來分析不同基因型多樣性羊草(或洽草)所觀測指標(地上生物量、地下生物量、總生物量、株高、根長,SLA)的變異程度[28- 29];利用Kendall rank相關分析[30]檢測鄰居物種(羊草或洽草)性狀與目標物種冷蒿所測性狀之間的相關性。以上數據分析利用SPSS 21.0和Canoco 4.5完成,在進行統計檢驗之前對數據進行轉換以滿足正態分布和方差齊性。 2.1 鄰居物種基因型數目對冷蒿生長的影響 羊草的基因型多樣性對冷蒿的株高、地上生物量、總生物量具有顯著影響(P< 0.05),主要表現在冷蒿的株高隨羊草的基因型多樣性的增加而降低,在羊草種群的基因型數目為6(G6)時,冷蒿地上生物量和總生物量顯著低于羊草基因型數目為1(G1)時的相應指標(圖1)。洽草的基因型多樣性對冷蒿的各生長響應變量無顯著影響(圖1)。 2.2 冷蒿與羊草、洽草的相對競爭強度(RCI) 2.2.1 冷蒿、羊草的相對競爭強度 冷蒿-羊草混種時,冷蒿各指標(地上生物量、地下生物量和總生物量)的相對競爭強度(RCI)處于-0.42— 0.73之間,羊草種群為G1時,冷蒿地上和總生物量RCI<0,即羊草種群對冷蒿有顯著的促進作用,而在羊草種群為G3、G6時,冷蒿RCI>0,即羊草種群顯著抑制冷蒿的生長,并且羊草基因型多樣性對冷蒿的相對競爭強度影響顯著(P<0.05),主要表現為羊草種群為G6時,冷蒿各指標(地上生物量、地下生物量、總生物量)的RCI顯著大于羊草種群為G1時冷蒿的RCI。羊草種群為G6時,羊草的地上生物量和總生物量的RCI顯著小于0,即冷蒿對羊草種群具有促進作用(表1)。 表1 冷蒿與羊草混合種植時的相對競爭強度(RCI)(平均值±標準誤) G1:單基因型mono genotype;G3:三基因型three genotypic combinations; G6: 六基因型six genotypic combinations;用t測驗檢驗各值與0的差異,*P<0.05,**P<0.01, 同一列相同同字母表示處理間差異不顯著(P>0.05) 2.2.2 冷蒿、洽草的相對競爭強度 冷蒿-洽草混種時,冷蒿各指標(地上生物量、地下生物量、總生物量)的相對競爭強度處于0.57—0.75之間,且均顯著大于0,即洽草種群顯著影響冷蒿的生長,但洽草基因型多樣性對冷蒿競爭強度無顯著影響(P>0.05)。洽草各指標(地上生物量、地下生物量、總生物量)的相對競爭強度與0差異不顯著,即洽草種群的生長受冷蒿影響較小,洽草基因型多樣性對洽草的各指標的相對競爭強度無顯著影響。 圖1 不同基因型多樣性的羊草和洽草環境條件下,目標植物冷蒿株高、地上生物量、地下生物量、總生物量Fig.1 Plant height, aboveground biomass,belowground biomass, total biomass of A. frigida neighbored by L. chinensis or K. cristata 洽草基因型多樣性GenotypediversityofK.cristata冷蒿地上相對競爭強度Relativecompetitionintensity(RCI)ofA.frigida洽草地下相對競爭強度Relativecompetitionintensity(RCI)ofK.cristata地上生物量Abovegroundbiomass地下生物量Belowgroundbiomass總生物量Totalbiomass地上生物量Abovegroundbiomass地下生物量Belowgroundbiomass總生物量TotalbiomassG10.67±0.05**0.71±0.07**0.68±0.06**-0.09±0.16-0.13±0.12-0.10±0.12G30.57±0.05**0.72±0.05**0.62±0.05**0.08±0.070.04±0.080.07±0.07G60.70±0.04**0.75±0.05**0.71±0.04**-0.03±0.05-0.09±0.07-0.05±0.05 2.3 基因型多樣性對羊草、洽草性狀變異的影響 利用PCA對所得測定的羊草(或洽草)的性狀進行分析,結果顯示羊草PCA的第一軸長為-1.0—1.5,第二軸長為-1.0—1.0,洽草PCA第一軸長為-1.0—1.0,第二軸長為-0.8—0.8,表示羊草性狀變異大于洽草性狀變異。另外,羊草種群為G6時的個體性狀主要分布在第一軸的-0.8—1.0之間,G1時個體性狀主要分布在第一軸的-0.5—0之間, G3時個體性狀主要分布在第一軸的-0.2—0.7之間,表示G6羊草種群為G6性狀變異大于其為G1或G3時羊草種群的性狀變異。洽草種群在不同基因型多樣性下的性狀變異不顯著。 2.4 冷蒿與羊草(或洽草)的Kendall等級相關系數 Kendall等級相關分析結果顯示,羊草比葉面積、總生物量與冷蒿地上生物量和總生物量之間存在顯著負相關關系(P< 0.05),相關系數接近0.4,其相關關系較強;洽草的各性狀與冷蒿的性狀均無顯著相關性(P>0.05)(表3)。 關于植物多樣性(物種多樣性和種內基因型多樣性)對其他物種生長表現的影響的研究剛剛起步,本實驗發現鄰居植物基因型的增加是否會增強其對目標植物的抑制作用與鄰居植物的種類有關。其中,洽草為鄰居植物時,其基因型多樣性對冷蒿的生長表現無顯著影響(圖1);然而羊草為鄰居物種時,相對于羊草基因型數目為1(G1)時,基因型數目為6(G6)時顯著降低了冷蒿的株高、地上生物量及總生物量(圖1),這可能與建群種羊草具有與物種相似的生態功能有關,支持本文的科學假設,表明較高的基因型多樣性的鄰居植物會抑制目標植物生長,但這種影響與鄰居植物的種類有關。其他研究也有類似的結果,如Cook-Potton等在對植物多樣性對植物間作用影響的研究中,直接比較了鄰居植物的基因型多樣性和物種多樣性對目標植物—月見草的影響,發現在被植物物種多樣性高的群落包圍時,月見草的性狀表現顯著降低[31];然而Parachnowitsch 等在研究目標植物月見草與不同基因型多樣性的鄰居植物月見草共同生長時發現,雖然目標植物月見草的9個性狀(比葉面積、株高、生物量、節間長度等)的生長表現受到鄰居植物月見草基因型多樣性的影響,但是多數影響未達顯著水平[14]。 表3冷蒿性狀與鄰居植物(羊草或洽草)性狀的Kendall等級相關系數及顯著性檢驗(*P<0.05, **P<0.01) Table3SignificancetestandKendallcorrelationcoefficientbetweentraitsofneighboringplant(L.chinensisorK.cristata)andtraitsofA.frigida 性狀Trait冷蒿Artemisiafrigida株高Plantheight地上生物量Abovegroundbiomass地下部生物量Belowgroundbiomass總生物量Totalbiomass羊草L.chinensis地上生物量Abovegroundbio-mass-0.04-0.1-0.19-0.09地下生物量Belowgroundbio-mass0.16-0.12-0.04-0.11總生物量Totalbiomass-0.07-0.29-0.19-0.35*株高Plantheight0.040-0.17-0.03比葉面積SLA0.15-0.38**-0.17-0.35*根長Rootlength0.07-0.150.140恰草K.cristata地上生物量Abovegroundbio-mass-0.060.060.080.03地下生物量Belowgroundbio-mass-0.04-0.02-0.01-0.04總生物量Totalbiomass-0.020.03-0.090.02株高Plantheight0.17-0.06-0.06-0.03比葉面積SLA0.060.06-0.060.07根長Rootlength-0.19-0.10.15-0.1 植物多樣性影響鄰居植物的內在機制尚沒有明確解釋,但有一部分學者認為鄰居植物基因型多樣性可能通過改變種群本身的性狀及其變異程度,影響鄰居植物與目標植物間的相互作用。本實驗中的羊草不同性狀的主成份分析結果表明不同的基因型多樣性的各性狀變異差異很大,羊草種群為G6時的性狀變異顯著大于其G1或G3時的性狀變異(圖2A)。已有的研究中也出現過類似的報道[2,13,32- 33]。在同一個體或群落內,比葉面積與植物光合作用能力有關,因此可以用植物比葉面積的變化來衡量植物光資源的利用效率的變化。Lipowssky 等發現隨著物種多樣性的增加,群落總體的比葉面積顯著增加,并且各植物間的比葉面積的變異增大[13]。植物的根系數量和長度與其吸收土壤水分和養分的能力有關。Noguchi等研究溫帶闊葉林的物種多樣性的生態功能時發現,物種多樣性能夠通過生態位互補使群落中個體的根系數量和長度差異變大,分析得知物種多樣性能夠通過提高物種間性狀變異,拓寬種群生態位,獲取更多可利用資源,更好的適應環境變化[32]。生物量是植物積累能量的主要體現,其在各器官中的分配是植物對環境適應的結果,反映了植物的生長策略[33]。Fridley等研究在不同物種多樣性環境下,植物生物量變異時發現,高多樣性的群落生物量變異大于低物種多樣性的群落[2]。在本實驗中,我們發現羊草總生物量、比葉面積與冷蒿的地上生物量和總生物量呈顯著的負相關,而洽草各性狀與冷蒿個性狀無顯著相關性(表3),這進一步證明羊草基因型多樣性影響冷蒿生長的原因是羊草基因型多樣性通過改變羊草種群的性狀從而影響羊草與冷蒿間的相互作用。 圖2 羊草(A)或 洽草(B) 在不同基因型多樣性下的性狀PCA分析Fig.2 PCA biplots for traits of L. chinensis(A) and K. cristata (B) under the 3 levels of genotypic diversity圓圈、三角形、正方形分別代表基因型數目為1、3、6的種群下的個體性狀 另外,鄰居植物的基因型多樣性可通過改變目標植物在群落中的相對競爭強度影響植物間相互作用[34- 35]。Gruntman等研究發現入侵物種成功入侵基因型多樣性低的群落的幾率遠遠大于入侵基因型多樣性高的群落,其原因可能與基因型高的群落中,入侵物種受到本地物種的競爭作用大,資源獲取能力低,表現出生長劣勢[36]。Cook-Patton等通過計算不同基因型多樣性下目標植物的競爭強度,也證實了上述觀點[31]。冷蒿在鄰居物種為羊草時,羊草基因型多樣性能顯著改變冷蒿的相對競爭強度,證實隨著羊草基因型多樣性的增加,冷蒿受到羊草的抑制作用顯著增大(表1)。洽草與冷蒿同為群落伴生種,其對冷蒿的生長具有顯著影響,冷蒿的相對競爭強度顯著大于0,但這種影響與洽草的基因型多樣性無關(表2)。 羊草作為典型草原的優勢種[37-41],其基因型多樣性發揮著類似物種多樣性的生態功能,羊草基因型多樣性對維持種群穩定性、提高種群初級生產力、乃至維持生態系統多樣性和穩定性方面都具有非常重要的作用[42- 44]。本實驗中高基因多樣性的羊草種群能提高對冷蒿生長的抑制作用。另外,群落內其他物種(如洽草)在抑制冷蒿生長方面也有顯著作用,即維持群落內物種多樣性及建群種基因型多樣性對減緩草原退化具有重要的生態意義。 [1] Cardinale B J. Biodiversity improves water quality through niche partitioning. Nature, 2011, 472(7341): 86- 89. [2] Fridley J D, Grime J P. Community and ecosystem effects of intraspecific genetic diversity in grassland microcosms of varying species diversity. Ecology, 2010, 91(8): 2272- 2283. [3] Latta L C IV, Baker M, Crowl T, Parnell J J, Weimer B, DeWald D B, Pfrender M E. Species and genotype diversity drive community and ecosystem properties in experimental microcosms. Evolutionary Ecology, 2011, 25(5): 1107- 1125. [4] Crutsinger G M, Souza L, Sanders N J. Intraspecific diversity and dominant genotypes resist plant invasions. Ecology Letters, 2008, 11(1): 16- 23. [5] Altermatt F, Ebert D. Genetic diversity ofDaphniamagnapopulations enhances resistance to parasites. Ecology Letters, 2008, 11(9): 918- 928. [6] Zhu Y Y, Chen H R, Fan J H, Wang Y Y, Li Y, Chen J B, Fan J X, Yang S S, Hu L P, Leung H, Mew T W, Teng P S, Wang Z H, Mundt C C. Genetic diversity and disease control in rice. Nature, 2000, 406(6797): 718- 722. [7] Johnson M T J, Lajeunesse M J, Agrawal A A. Additive and interactive effects of plant genotypic diversity on arthropod communities and planttness. Ecology Letters, 2006, 9(1): 24- 34. [8] Connell J H. On the prevalence and relative importance of interspecific competition: evidence from field experiments. The American Naturalist, 1983, 122(5): 661- 696. [9] Goldberg D E, Barton A M. Patterns and consequences of interspecific competition in natural communities: a review of field experiments with plants. American Naturalist, 1992, 139(4): 771- 801. [10] Whitham T G, Young W P, Martinsen G D, Gehring C A, Schweitzer J A, Shuster S M, Wimp G M, Fischer D G, Bailey J K, Lindroth R L, Woolbright S, Kuske C R. Community and ecosystem genetics: a consequence of the extended phenotype. Ecology, 2003, 84(3): 559- 573. [11] Cardinale B J, Matulich K L, Hooper D U, Byrnes J E, Duffy E, Gamfeldt L, Balvanera P, O′Connor M I, Gonzalez A. The functional role of producer diversity in ecosystems. American Journal of Botany, 2011, 98(3): 572- 592. [12] Hooper D U, Chapin FS, Ewel J J, Hector A, Inchausti P, Lavorel S, Lawton J H, Lodge D M, Loreau M, Naeem S, Schmid B, Set?l? H, Symstad A J, Vandermeer J, Wardle D A. Effects of biodiversity on ecosystem functioning: a consensus of current knowledge. Ecological Monographs, 2005, 75(1): 3- 35. [13] Lipowsky A, Schmid B, Roscher C. Selection for monoculture and mixture genotypes in a biodiversity experiment. Basic and Applied Ecology, 2011, 12(4): 360- 371. [14] Parachnowitsch A L, Cook-Patton S C, McArt S H. Neighbours matter: natural selection on plant size depends on the identity and diversity of the surrounding community. Evolutionary Ecology, 2014, 28(6): 1139- 1153. [15] Caldeira M C, Ibáez I, Nogueira C, Bugalho M N, Lecomte X, Moreira A, Pereira J S. Direct and indirect effects of tree canopy facilitation in the recruitment of Mediterranean oaks. Journal of Applied Ecology, 2014, 51(2): 349- 358. [16] Hughes A R, Inouye B D, Johnson M T J, Underwood N, Vellend M. Ecological consequences of genetic diversity. Ecology Letter, 2008, 11(6): 609- 623. [17] Lankau R A. Rapid evolutionary change and the coexistence of species. Annual Review of Ecology, Evolution, and Systematics, 2011, 42(1): 335- 354. [18] Dostál P. Plant competitive interactions and invasiveness: searching for the effects of phylogenetic relatedness and origin on competition intensity. American Naturalist, 2011, 177(5): 655- 667. [19] Seifan M, Tielb?rger K, Kadmon R. Direct and indirect interactions among plants explain counterintuitive positive drought effects on an eastern Mediterranean shrub species. Oikos, 2010, 119(10): 1601- 1609. [20] Le Bagousse-Pinguet Y, Liancourt P, Gross N, Straile D. Indirect facilitation promotes macrophyte survival and growth in freshwater ecosystems threatened by eutrophication. Journal of Ecology, 2012, 100(2): 530- 538. [21] 高英志, 汪詩平, 韓興國, 陳全勝, 王艷芬, 周志勇, 張淑敏, 楊晶. 退化草地恢復過程中土壤氮素狀況以及與植被地上綠色生物量形成關系的研究. 植物生態學報, 2004, 28(3): 285- 293. [22] Raich J W, Schlesinger W H. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate. Tellus, 1992, 44(2): 81- 99. [23] 李永宏. 內蒙古錫林河流域羊草草原和大針茅草原在放牧影響下的分異和趨同. 植物生態學與地植物學報, 1988, 12(3): 189- 196. [24] 張汝民, 王玉芝, 侯平, 溫國勝, 高巖. 幾種牧草幼苗對冷蒿莖葉水浸提液化感作用的生理響應. 生態學報, 2010, 30(8): 2197- 2204. [25] 周澎, 王艷榮, 張瑋, 張峰. 栽培條件下野生洽草坪用特性初步研究. 內蒙古大學學報: 自然科學版, 2008, 39(1): 92- 96. [26] 王丹. 內蒙古中東部草原羊草(Leymuschinesis)種內變異與分化研究[D]. 天津: 南開大學, 2004: 39- 41. [27] 沈禹穎, 李昀, 陸妮. 4種牧草種間競爭力和種間關系的研究. 草業學報, 2002, 11(3): 8- 13. [28] De Vries F T, Bardgett R D. Plant community controls on short-term ecosystem nitrogen retention. New Phytologist, 2016, 210(3): 861- 874. [29] 朱宗河, 鄭文寅, 張學昆. 甘藍型油菜耐旱相關性狀的主成分分析及綜合評價. 中國農業科學, 2011, 44(9): 1775- 1787. [30] 李玉水. 隨機變量的Kendall相關系數的推廣. 莆田學院學報, 2009, 16(5): 15- 17. [31] Cook-Patton S C, Mcart S H, Parachnowitsch A L, Thaler J S, Agrawal A A. A direct comparison of the consequences of plant genotypic and species diversity on communities and ecosystem function. Ecology, 2011, 92(4): 915- 923. [32] Noguchi K, Nagakura J, Kaneko S. Biomass and morphology of fine roots of sugi (Cryptomeriajaponica) after 3 years of nitrogen fertilization. Frontiers in Plant Science, 2013, 4(1): 347. [33] Scurlock J M O, Johnson K, Olson R J. Estimating net primary productivity from grassland biomass dynamics measurements. Global Change Biology, 2002, 8(8): 736- 753. [34] Cardinale B J, Srivastava D S, Duffy J E, Wright J P, Downing A L, Sankaran M, Jouseau C, Cadotte M W, Carroll I T, Weis J J, Hector A, Loreau M. Effects of biodiversity on the functioning of ecosystems: a summary of 164 experimental manipulations of species richness: Ecology, 2009, 90(3): 854- 854. [35] Hughes A R, Stachowicz J J, Tilman G D. Genetic diversity enhances the resistance of a seagrass ecosystem to disturbance. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(24): 8998- 9002. [36] Gruntman M, Pehl A K, Joshi S, Tielb?rger K. Competitive dominance of the invasive plant Impatiens glandulifera: using competitive effect and response with a vigorous neighbour. Biological Invasions, 2014, 16(1): 141- 151. [37] 王煒, 劉鐘齡, 郝敦元, 梁存柱. 內蒙古草原退化群落恢復演替的研究Ⅱ. 恢復演替時間進程的分析. 植物生態學報, 1996, 20(5): 460- 471. [38] Johnson M T J, Dinnage R, Zhou A Y, Hunter M D. Environmental variation has stronger effects than plant genotype on competition among plant species. Journal of Ecology, 2008, 96(5): 947- 955. [39] 閆鐘清, 齊玉春, 董云社, 彭琴, 孫良杰, 賈軍強, 曹叢叢, 郭樹芳, 賀云龍. 草地生態系統氮循環關鍵過程對全球變化及人類活動的響應與機制. 草業學報, 2014, 23(6): 279- 292. [40] 代光爍, 余寶花, 娜日蘇, 董孝斌. 內蒙古草原生態系統服務與人類福祉研究初探. 中國生態農業學報, 2012, 20(5): 656- 662. [41] 劉鐘齡, 王煒, 郝敦元, 梁存柱. 內蒙古草原退化與恢復演替機理的探討. 干旱區資源與環境, 2002, 16(1): 84- 91. [42] Bai Y F, Wu J M, Clark C M, Naeem S, Pan Q M, Huang J H, Zhang L X, Han X G. Tradeoffs and thresholds in the effects of nitrogen addition on biodiversity and ecosystem functioning: evidence from Inner Mongolia Grasslands. Global Change Biology, 2010, 16(1): 358- 372. [43] Crawford K M, Rudgers J A. Plant species diversity and genetic diversity within a dominant species interactively affect plant community biomass. Journal of Ecology, 2012, 100(6): 1512- 1521. [44] 申俊芳, 任慧琴, 辛曉靜, 徐冰, 高玉葆, 趙念席. 羊草基因型多樣性能增強種群對干擾的響應. 生態學報, 2015, 35(23): 7682- 7689. EffectsofgenotypicdiversityofneighboringspeciesonthegrowthofArtemisiafrigidaplants LIU Lei, XIN Xiaojing, WANG Yukun, QU Yaobing, YANG Xue, LI Geping, ZHAO Nianxi*, GAO Yubao CollegeofLifeScience,NankaiUniversity,Tianjin300071,China Anthropogenic activities are dramatically altering patterns of biodiversity around the globe, triggering extensive research on the consequences of changes in biodiversity of ecosystem and community processes. Multiple investigations on the ecological effects of both plant genetics and species diversity have shown, for example, that more diverse systems are generally more productive, and support more abundant and more diverse animal communities. In recent years, some research have shown showed that the outcome of plant-plant interactions varies with the diversity of dominant neighbor genotypes. Plant diversity, either genotypic or species diversity, could mediate plant-plant interactions in communities via at least two mechanisms. First, increased relative competition intensity between neighboring plants and target species typically leads to higher productivity of neighboring plants. Alternatively, increased trait variation of neighboring plants rather than increased competition in different communities may explain the change in plant-plant interactions. In the present study, we hypothesized that genotypic diversity of the neighboring plants may affect the growth of the target species by changing the coefficient of trait variation of the community. In this study, we conducted a factorial microcosm experiment with three combinations of genotypes (1, 3, 6 genotypes = G1, G3, G6) of two neighboring plants (LeymuschinensisandKoeleriacristata), and one genotype of the target species,Artemisiafrigida. Furthermore, we investigated the growth performance (aboveground biomass, belowground biomass, total biomass, and plant height) and relative competition intensity (RCI) ofA.frigidawhen surrounded by different levels of genetic diversity forL.chinensisorK.cristata. We analyzed six traits (aboveground biomass, belowground biomass, total biomass, plant height, root length, and specific leaf area [SLA]) ofL.chinensisorK.cristataat different levels of genotypic diversity using principal component analysis (PCA). In addition, the correlations between the four traits ofA.frigidaand six traits ofL.chinensisorK.cristatawere calculated by means of Kendall rank correlation coefficient analysis. The results revealed the following: (1) The performance ofA.frigidawas dependent on neighboring plants. Higherg genotypic diversity ofL.chinensissignificantly decreased aboveground biomass, total biomass and plant height ofA.frigida, andA.frigidagrew the least when the genotype number ofL.chinensiswas six. For G6 ofL.chinensis, the RCI of aboveground, belowground and totalA.frigidawas significantly greater than that for the G1 treatment (P<0.05). However, forK.cristata, genotypic diversity did not exhibit significant effects on the performance or RCI ofA.frigida. (2) The trait variation of neighboring plants was also dependent on the species and their genotypic diversity. When the neighboring plant wasL.chinensis, genotypic diversity significantly affected trait variation, and trait variation increased with an increasing number of genotypes, whereas no significant differences were detected when the neighboring plant wasK.cristata. (3) The results of the Kendall correlation coefficient analysis revealed significant negative correlations between total biomass and SLA ofL.chinensisand aboveground biomass and total biomass ofA.frigida. These results provided experimental data on the effects of genotypic diversity of neighboring plants on the target species, and we outlined how more traits or relative competition intensity mediating plant-plant interactions could be identified. Future studies may use population genetic survey of genotype distribution in fields and methods from trait-based ecology to better quantify the impact of intraspecific genetic variation on plant-plant interactions, so as to facilitate and enhance ecological restoration in the typical steppe of northern China in the context of global change. neighboring plant; target plant; plant-plant interactions; genotypic diversity; competition; traits 國家自然科學基金項目(31570427) 2016- 07- 03; < class="emphasis_bold">網絡出版日期 日期:2017- 05- 27 *通訊作者Corresponding author.E-mail: zhaonianxi@nankai.edu.cn 10.5846/stxb201607031366 劉磊, 辛曉靜, 王宇坤, 曲耀冰, 楊雪, 李隔萍, 趙念席, 高玉葆.不同鄰居物種的基因型多樣性對冷蒿生長的影響.生態學報,2017,37(19):6544- 6551. Liu L, Xin X J, Wang Y K, Qu Y B, Yang X, Li G P, Zhao N X, Gao Y B.Effects of genotypic diversity of neighboring species on the growth ofArtemisiafrigidaplants.Acta Ecologica Sinica,2017,37(19):6544- 6551.2 結果與分析
3 討論