超聲引導下經皮微波消融與肝動脈化療栓塞治療原發性肝癌的臨床效果
侯鵬飛 陳永忠 劉 偉 焦連華 楊 軍
超聲引導下經皮微波消融與肝動脈化療栓塞治療原發性肝癌的臨床效果
侯鵬飛 陳永忠 劉 偉 焦連華 楊 軍
目的探討超聲引導下經皮微波消融與肝動脈化療栓塞治療原發性肝癌的臨床效果。方法選擇原發性肝癌患者86例作為研究對象,根據隨機數字表法分為觀察組與對照組各43例,對照組給予肝動脈化療栓塞治療,觀察組給予超聲引導下經皮微波消融治療,記錄兩組近遠期預后。結果兩組治療前ALT、AST水平比較均無明顯差異(P>0.05),治療后5 d觀察組的ALT、AST水平明顯低于對照組(P<0.05)。觀察組與對照組的治療總有效率分別為76.7%和53.5%,觀察組的總有效率明顯高于對照組(P<0.05)。兩組治療后3個月的感染、高熱、腹水、消化道出血等并發癥發生情況與對照組比較差異無統計學意義(P>0.05)。觀察組治療后6個月及1年的死亡率分別為2.3%與7.0%,對照組分別為14.0%和27.9%,觀察組明顯低于對照組(P<0.05)。結論相對于肝動脈化療栓塞,超聲引導下經皮微波消融治療原發性肝癌也具有很好的安全性,對肝臟損害較輕,能提高治療效果,延長患者的生存時間。
肝動脈化療栓塞;超聲;經皮微波消融;原發性肝癌;肝功能
(ThePracticalJournalofCancer,2017,32:1667~1670)
原發性肝癌是起源于肝臟上皮或間葉組織的惡性腫瘤,惡性程度較高,就診時大多為中晚期,死亡率比較高[1]。原發性肝癌的病因及機制尚未明確,主要認為與病毒性肝炎、酒精、環境、性激素、化學物質等因素有關[2-3]。我國作為乙肝高發國家,具有較高的肝癌發病率。手術切除既往治療原發性肝癌的首選手段,能夠有效延長患者的生存期。但是很多肝癌患者就診時大多為中晚期,失去了手術治療的機會[4-5]。在肝動脈灌注化療中,化療藥物經肝動脈直接到達肝臟,可達到栓塞腫瘤血管的作用。同時原發性肝癌的腫瘤供血以肝動脈為主,為此肝動脈化療栓塞在理論上可有比較好的效果[6]。近年來超聲引導下經皮微波消融因其微創、并發癥低、操作簡便及效果顯著等優點,在肝癌治療中得到廣泛應用[7]。微波消融產生的邊界清楚的橢圓壞死區,不僅保證腫瘤組織被有效消融,且能減少對周圍正常組織損失[8-9]。本研究探討了超聲引導下經皮微波消融與肝動脈化療栓塞治療原發性肝癌的臨床效果,現報告如下。
1 資料與方法
1.1 一般資料
2009年1月到2015年12月選擇在我院診治的原發性肝癌患者86例作為研究對象,納入標準:符合中華醫學會外科分會肝臟外科學組關于原發性肝癌診斷標準[1];均為初治原發性肝癌;無合并嚴重的心腦血管、腎肺等器官組織疾病;肝功能Child-Pugh A或B級;術后均接受隨訪且病例資料完整;均自愿參加并簽署知情同意書;研究得到醫院倫理委員會的批準;預計生存期≥3個月。排除標準:妊娠與哺乳期婦女;合并有嚴重的血液系統、免疫系統疾病者;術后失訪或隨訪資料不全者。根據隨機數字表法分為觀察組與對照組各43例,兩組患者的性別、年齡、腫瘤直徑、體重指數、病灶類型等對比無明顯差異(P>0.05)。見表1。

表1 兩組一般資料對比
1.2 治療方法
對照組:給予肝動脈化療栓塞治療,使用Seldinger方法行股動脈穿刺,將導管置于肝總動脈造影,選擇肝左、肝右動脈行灌注化療。
觀察組:給予超聲引導下經皮微波消融治療,在超聲引導下,將多極子母針消融電極準確刺入腫瘤部位,同時避免損傷肝內主要動脈及膽管,將電極針沿腫瘤長經插入底部,進行射頻消融治療。射頻消融儀在電子計算機控制下將射頻脈沖能量通過多極針傳導到腫瘤組織中,使腫瘤組織產生局部高溫,從而達到使腫瘤組織及其鄰近的可能被擴散的組織凝固壞死的目的,壞死組織在原位被機化或吸收。消融參數:頻率40 MHz,極板直徑25 cm左右,電容式無創加熱,每周1~2次,時間為1 h,治療功率約為600 W,反射功率控制在5%以內,將每次加熱時的溫度及功率曲線進行連續記錄,體表溫度41 ℃左右。
1.3 觀察指標
在治療前與治療后7 d進行肝功能谷丙轉氨酶(ALT)、谷草轉氨酶(AST)的測定。在治療后3個月進行近期療效判定,完全緩解:臨床癥狀及病灶消失。部分緩解:臨床癥狀明顯好轉,病灶縮小50%以上。穩定:臨床癥狀好轉,病灶縮小25%~50%。進展:臨床癥狀無明顯好轉,病灶無改變甚至出現新增病灶。治療總有效率=(完全緩解+部分緩解+穩定)/總數×100%。記錄兩組治療后3個月出現的并發癥情況,包括感染、高熱、腹水、消化道出血等。對比分析兩組患者6個月及1年的死亡率情況。
1.4 統計學方法
所有統計學資料都采用SPSS 21.00專業統計學軟件進行數據分析,計量資料以均數±標準差表示,計數資料以率(n%)表示,對比采用t檢驗與χ2檢驗等,P<0.05 評價為差異具有顯著性。
2 結果
2.1 肝功能變化對比
兩組治療前的ALT、AST水平比較均無明顯差異(P>0.05),治療后5 d觀察組的ALT、AST水平明顯低于對照組(P<0.05)。見表2。
2.2 兩組治療療效比較
觀察組與對照組的治療總有效率分別為76.7%和53.5%,觀察組的總有效率明顯高于對照組(χ2=5.772,P<0.05)。見表3。
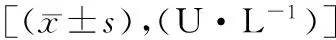
表2 兩組治療前后肝功能指標變化

表3 兩組治療療效對比/例
2.3 并發癥情況對比
兩組治療后3個月的感染、高熱、腹水、消化道出血等并發癥發生情況與對照組對比,差異無統計學意義(χ2=0.078,P>0.05)。見表4。

表4 兩組治療后并發癥發生情況對比/例
2.4 生存情況對比
觀察組治療后半年及1年死亡率分別為2.3%與7.0%,對照組為14.0%和27.9%,觀察組明顯低于對照組(P<0.05)。見表5。
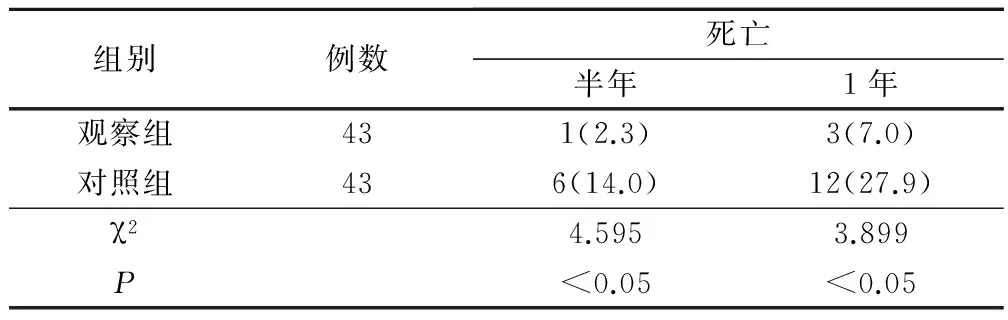
表5 兩組生存情況對比(例,%)
3 討論
原發性肝癌是臨床中最常見的惡性腫瘤,發病率為所有腫瘤中第五位,死亡率第三位。手術切除長期以來都被作為原發性肝癌的首選治療手段,通過對腫瘤的切除,延長患者的生存期,其臨床效果也被臨床所認可[10]。但是很多患者就診時已經發展至中晚期,可接受根治手術患者約不足20%,導致肝癌患者整體預后較差,生存期較短[11-12]。
肝臟具有特殊的解剖結構,有非常豐富的血供,由門靜脈及肝動脈雙重供血。肝動脈灌注化療是將化療和灌注技術緊密結合,不增加周圍正常組織的藥物濃度,也可增加病灶區域內的藥物濃度,促進腫瘤壞死[13]。肝動脈灌注化療也能通過損傷DNA誘導凋亡,使凋亡抑制基因失使腫瘤細胞進入凋亡程序。超聲引導下經皮微波消融屬于物理熱消融技術,主要通過針型電極在腫瘤內部釋放交流電磁波,當溫度高于60 ℃時即可使腫瘤出血壞死,腫瘤細胞蛋白變性死亡[14-15]。微波消融能增加腫瘤局部以及外周血免疫細胞抗腫瘤能力,并能減少腫瘤轉移風險[16]。微波消融的電極針只涉及直徑最大5 cm范圍,對其余的肝組織影響不大,特別是對于嚴重肝硬化患者盡量保存有功能的肝組織是非常重要的[17]。
本研究顯示,兩組治療前的ALT、AST水平比較均無明顯差異(P>0.05),治療后5 d觀察組的ALT、AST水平明顯低于對照組(P<0.05);觀察組與對照組的治療總有效率分別為76.7%和53.5%,觀察組的總有效率明顯高于對照組(P<0.05),表明微波消融的應用對肝臟的損傷比較輕,也能提高治療療效。
肝動脈灌注化療主要是增加病灶區域內的藥物濃度,對正常組織的影響小;并且由于化療藥物殺傷癌細胞的效果與藥物濃度呈正相關,因而被殺傷的癌細胞數目明顯增多,全身的毒性反應比較小[18]。超聲引導下經皮微波消融能避免開腹創傷,特別適用于肝功能不良、手術風險大或無法手術切除的肝癌患者。特別是熱療可通過阻止DNA單鏈斷裂的修復從而阻斷放射受損細胞的修復,其協同機制在于熱療有效降低了DNA聚合酶的作用,阻止了DNA單鏈斷裂的修復[19]。本研究顯示兩組治療后3個月的感染、高熱、腹水、消化道出血等并發癥發生情況與對照組對比差異無統計學意義(P>0.05),表明兩種治療方法都有很好的安全性。特別是在亞高溫情況下,腫瘤的血流量迅速增加,同時增加了氧分壓,相關周圍器官也可以接受超聲引導下射頻熱療不會對周圍組織造成損害[20-21]。本研究顯示觀察組治療后6個月及1年的死亡率分別為2.3%與7.0%,對照組為14.0%和27.9%,觀察組明顯低于對照組(P<0.05)。這與治療的微創性相關,超聲引導下經皮微波消融能避免對正常組織的損傷,進而減少手術風險,促進術后恢復[17]。
綜上所述,相對于肝動脈化療栓塞,超聲引導下經皮微波消融治療原發性肝癌也具有很好的安全性,對肝臟損害較輕,能提高治療效果,延長患者的生存時間。
[1] 中華醫學會外科學分會肝臟外科學組.原發性肝癌外科治療方法的選擇(2004年第1次修訂)〔J〕.中國微創外科雜志,2005,5(2):91-93.
[2] 陸世鋒.原發性肝癌外科治療及非手術治療研究進展〔J〕.醫學綜述,2014,20(12):2151-2153.
[3] Feng K,Yan J,Li X,et al.A randomized controlled trial of radiofrequency ablation and surgical resection in the treatment of small hepatocellular carcinoma〔J〕.J Hepatol,2012,57(4):794-802.
[4] 徐智鋒,潘江華,胡逸人,等.腹腔鏡B超引導下微波消融術治療特殊部位肝癌的療效觀察〔J〕.浙江醫學,2017,39(2):120-121,129.
[5] Huang G,Chen X,Lau WY,et al.Quality of life after surgical resection compared with radiofrequency ablation for small hepatocellular carcinomas〔J〕.Br J Surg,2014,101(8):1006-1015.
[6] 李 遠,孫 揚,單華超,等.微波消融結合病灶刮除術治療長骨轉移癌的療效分析〔J〕.中華醫學雜志,2016,96(19):1500-1504.
[7] Takaki H,Imai N,Thomas CT,et al.Changes in peripheral blood T-cell balance after percutaneous tumor ablation〔J〕.inim Invasive Ther Allied Technol,2017,18(2):1-7.
[8] 楊曉環,黃十佳,于 杰,等.超聲引導經皮微波消融治療鄰近血管的原發性肝癌的長期療效〔J〕.腫瘤學雜志,2016,22(1):24-28.
[9] Peng B,Gong J.Sunitinib Enables a Clinical and Pathological Complete Remission of Metastatic Renal Cell Carcinoma (mRCC)〔J〕.Urol Case Rep,2017,12:78-80.
[10] 李麗珍,鐘秋紅,黃昌輝,等.超聲引導下經皮微波消融與CT超聲引導下腫瘤射頻消融治療原發性肝癌的臨床比較〔J〕.中國CT和MRI雜志,2017,15(1):76-78,82.
[11] Park WK,Maxwell AW,Frank VE,et al.Evaluation of a Novel Thermal Accelerant for Augmentation of Microwave Energy during Image-guided Tumor Ablation〔J〕.Theranostics,2017,7(4):1026-1035.
[12] Han JB,Kong FW,Ding H,et al.Hepatectomy combined with microwave ablation of the spleen for treatment of hepatocellular carcinoma complicated with splenomegaly:A retrospective study〔J〕.Mol Clin Oncol,2017,6(2):204-208.
[13] 張 勇,申淑群,葛乃建,等.無法手術原發性肝癌30例經微波消融的治療效果及預后分析〔J〕.貴州醫藥,2017,41(2):163-164.
[14] de Baere T,Tselikas L,Yevich S,et al.The role of image-guided therapy in the management of colorectal cancer metastatic disease〔J〕.Eur J Cancer,2017,75(2):231-242.
[15] De Cobelli F,Marra P,Ratti F,et al.Microwave ablation of liver malignancies:comparison of effects and early outcomes of percutaneous and intraoperative approaches with different liver conditions:New advances in interventional oncology:state of the art〔J〕.Med Oncol,2017,34(4):49.
[16] Diaz-Nieto R,Fenwick S,Malik H,et al.Defining the Optimal Use of Ablation for Metastatic Colorectal Cancer to the Liver Without High-Level Evidence〔J〕.Curr Treat Options Oncol,2017,18(2):8.
[17] Frühling P,Nilsson A,Duraj F,et al.Single-center nonrandomized clinical trial to assess the safety and efficacy of irreversible electroporation (IRE) ablation of liver tumors in humans:Short to mid-term results〔J〕.Eur J Surg Oncol,2017,43(4):751-757.
[18] Feng Q,Chi Y,Liu Y,et al.Efficacy and safety of percutaneous radiofrequency ablation versus surgical resection for small hepatocellular carcinoma:a meta-analysis of 23 studies〔J〕.J Cancer Res Clin Oncol,2015,141(1):1-9.
[19] 趙 鵬,鄭加生,張洪海,等.肝動脈導管化療栓塞聯合 CT 引導精準微波消融治療原發性肝癌的療效及影響因素〔J〕.中華腫瘤雜志,2016,38(2):138-145.
[20] Cheng Z,Liang P,Yu X,et al.Percutaneous microwave ablation for benign focal liver lesions:Initial clinical results〔J〕.Oncol Lett,2017,13(1):429-434.
[21] Hakime A,Yevich S,Tselikas L,et al.Percutaneous Thermal Ablation with Ultrasound Guidance.Fusion Imaging Guidance to Improve Conspicuity of Liver Metastasis〔J〕.Cardiovasc Intervent Radiol,2017,40(5):721-727.
ClinicalEffectsofUltrasound-guidedPercutaneousMicrowaveAblationandTranscatheterArterialChemoembolizationforPrimaryLiverCancer
HOUPengfei,CHENYongzhong,LIUWei,etal.
PuyangOilfeildGeneralHospital,Puyang,457001
ObjectiveTo investigate the clinical effects of ultrasound-guided percutaneous microwave ablation and transcatheter arterial chemoembolization in the treatment of primary liver cancer.Methods86 cases of primary liver cancer patients were selected as the research object,all the cases were randomly divided into the observation group and the control group,with 43 cases in each group.The control group
transcatheter arterial chemoembolization therapy,the observation group received ultrasound guided percutaneous microwave ablation treatment,The short-term and long-term prognosis in the 2 groups were recorded.ResultsThere were no significant difference in the levels of ALT and AST compared between the 2 groups before treatment (P>0.05).The ALT and AST levels in the observation group after treatment 5d were significantly lower than those of the control group (P<0.05).The total effective rate of the observation group and the control group were 76.7% and 53.4%,respectively.The total effective rate of the observation group was significantly higher than that of the control group (P<0.05).There were no significant difference compared between the 2 groups in the treatment of infection,high fever,ascites,gastrointestinal bleeding and other complications 3 months after treatment (P>0.05).The 6-month and 1-year mortality rates of the observation group were 2.3% and 7.0%,and the control group were 14% and 27.9%,respectively.The observation group was significantly lower than that of the control group (P<0.05).ConclusionCompared with hepatic artery chemoembolization,ultrasound guided percutaneous microwave ablation for hepatocellular carcinoma also has good safety,it has less damage to the liver,and can improve the therapeutic effect and prolong the survival time of patients.
Transcatheter arterial chemoembolization;Ultrasound;Percutaneous microwave ablation;Primary liver cancer;Liver function
457001 河南省濮陽市油田總醫院(侯鵬飛,劉 偉,焦連華,楊 軍);450000 鄭州大學第一附屬醫院(陳永忠)
10.3969/j.issn.1001-5930.2017.10.030
R735.7
A
1001-5930(2017)10-1667-04
2017-05-08
2017-06-19)
(編輯吳小紅)

