試分析高中化學電極方程式的書寫技巧
◆吳季洹
試分析高中化學電極方程式的書寫技巧
◆吳季洹
本文就電極方程的相關概念進行了簡述,在原電池方程以及電解池電極方程兩個方面入手,詳細的闡述了電極方程式的書寫技巧。
高中化學;電極方程式;書寫技巧
一、電極方程式的相關概念
在電化學反應裝置中,經過原子或者是離子在電極中得失電子而發生氧化或是還原反應的方程式,這種方程式就被稱之為電極方程式。我們對其方程式進行書寫的時候,經常會因為電子移動的流入出問題而導致了方程式錯誤書寫。流入的一級反應是還原反應,而流出的一級反應是氧化反應。在這個過程中將原電池分成了正負兩個極,在電極方程是中,氧化一般是負極,而還原則是正極。電解池中則是分成了陰陽兩個極,而在電極方程式中,氧化是陽極,還原是陰極。
二、化學電極方程式書寫技巧
(一)原電池電極方程。原電池電極方程是依據難易程度進行分類,在這個基礎上分成了簡單和復雜兩種:其一是依據題目的實際情況,在已知的圖片案例以及文說明中,直接性的將電極反應方程式書寫出來。這種題目比較簡單,我們在理解的時候也十分容易,只用在題目中提供的相關線索中尋找關鍵突破口,這樣就能夠簡單輕松的解答題目。在一般情況下,原電池電極方程式均是負極和電解溶液產生電極反應。因此,要精確的找準正極與負極,在這個基礎上準確的判斷出氧化反應與還原反應,這是解答這種題型的關鍵。
負極材料-ne?=金屬陽離子
正極材料+ne?=單質
其二是題目只是給出了電極反應總反應方程式,或者是離子方程式,需要依據已知信息寫出正負極電極反應方程式。這種題目相對復雜,在解題的時候步驟也很多,需要我們對題目進行仔細的觀察以及總結。其首先也是要找到原電池正負極,以此判斷出氧化反應中氧化劑與還原反應中的還原劑。之后主要根據電解質存在的特點,在這個基礎上對氧化反應之后的氧化產物進行判斷,同時還要對還原反應之后的還原反應物進行判斷。之后就根據公式兩邊電子的得失數值變化書寫出電極反應方程式,對這種題目進行總結歸納就能夠得到下面結論:
還原劑+氧化劑+介質=氧化產物+還原產物+其他
負極:還原劑-ne?(+介質)=氧化產物
正極:氧化劑+ne?(+介質)=還原產物
除此之外,還有一種通用式的結論能夠使用在這種復雜的題型解答中:在總化學反應方程式中消除簡單的電極反應方程式,就可以獲得正確的電極反應方程式。
(二)電解池電極方程式。根據規定的解題方式對題目進行觀察與推導,就能夠書寫出正確的反應方程式,首先要先詳細觀察電極,要區分出電極正負極。陽極和電源正極+相連,陰極和電源負極-相連。若是陽極材料是除開Au、Pt、C之外的金屬單質,則材料自身就能夠參與到化學反應的活性電極中,失去電子之后就成為性質穩定的金屬陽離子。陰極材料不會參與反應。若是陽極材料是Pt、Au以及C這3中單質中的一個,則反應方程式就要寫成陽極電極反應方程式。依據放電順序判斷,根據原電池反應方程式書寫規范,就可以正確寫出陰陽兩極反應方程式。
(三)化學電極式方程書寫步驟。將電池燃料CH4?O2?KOH作為例子,電極方程式詳細書寫步驟能夠分成四個部分:
其一是寫出電極反應的總化學方程式,當有例子反應時要把總化學方程式改寫為離子反應方程式:
其中總反應化學方程式如下:
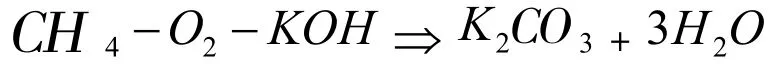
而離子反應化學方程式是:
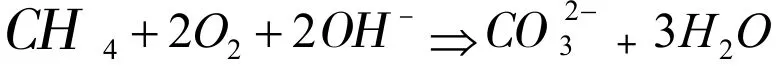
其二是在總反應化學方程式中標出化合價出現變化的原子,依據電子實際得失情況分成氧化反應方程式與還原反應方程式:
其三是根據化合價變化情況和電子轉移相關數量,以此判斷出氧化反應與還原反應。失去電子為氧化反應,得到電子為還原反應。氧化反應方程式中,力碳元素化合價是-4,而碳元素化合價是+4。因此,氧化反應方程式左邊失去8個原子。
還原反應方程式中,O2的氧元素化合價是0,OH-的氧元素化合價是-2,兩個電子轉移到一個氧原子上,因此四個氧原子得到8個電子。
其四是全部化學公式在等號或者是箭頭兩端的總數值,均要遵循質量守恒定律以及電子守恒。
結束語
綜上所述,在學習化學理論知識時,化學反應方程式是十分關鍵的構成,對其進行正確的書寫能夠加深我們對各種化學反應的深入認知。而電化學在整個化學知識中占比很大,其難度也很大,在對這方面知識進行學習時要重視對化學方程式的正確書寫,正確的判斷陰陽兩極以及電子得失,在這個基礎上進行化學反應方程是的書寫,從而提升化學學習能力。
[1]陶小虎.試分析高中化學電極方程式的書寫技巧[J].同行,2016(15).
(作者單位:長沙市明德中學)

