吉西他濱對人肝癌HepG2不同濃度吉西他濱對肝癌及其可能機制
宋彬妤
(山西醫科大學汾陽學院科技中心,汾陽 032200)
吉西他濱對人肝癌HepG2不同濃度吉西他濱對肝癌及其可能機制
宋彬妤
(山西醫科大學汾陽學院科技中心,汾陽 032200)
目的 探討吉西他濱對人肝癌HepG2細胞的抑制作用以及機制。 方法 采用CCK-8法檢測細胞的存活率,將不同濃度(0.4,0.8,1.6,3.2 μg/ml)的吉西他濱作用于人肝癌HepG2細胞24 h、48 h,觀察細胞的生長抑制作用,根據結果計算得知細胞的半數抑制濃度(IC50)為1.57 μg/ml,然后在1.57 μg/ml的吉西他濱的基礎上加入自噬抑制劑3-MA,觀察細胞的生長抑制情況,流式細胞術檢測吉西他濱作用于人肝癌HepG2細胞后細胞的凋亡情況,熒光顯微鏡觀察MDC染色后細胞自噬的形態學變化,RT-PCR檢測自噬相關基因Beclin-1和LC-3表達的變化。 結果 CCK-8結果顯示不同濃度的吉西他濱對人肝癌HepG2細胞有明顯的抑制作用,呈現時間和濃度的劑量依賴性,用藥后細胞存活率明顯下降,與對照組相比較差異具有統計學意義(P<0.01)。在1.57 μg/ml吉西他濱作用基礎上加入自噬抑制劑后,細胞的存活率明顯上升,由(48.7±1.23)%變為(61.22±2.17)%(P<0.01)。流式細胞術結果顯示吉西他濱誘導肝癌HepG2細胞發生凋亡,隨著吉西他濱濃度升高,細胞的凋亡率明顯上升,MDC染色以及實時熒光定量PCR結果顯示吉西他濱可以誘導HepG2細胞發生自噬,引起自噬相關基因基因的Beclin-1和LC-3表達的增加。 結論 吉西他濱對人肝癌HepG2細胞有明顯的抑制作用,其機制可能通過誘導細胞發生凋亡和自噬來導致細胞最終死亡。
吉西他濱; HepG2細胞; 細胞自噬; 細胞凋亡; Beclin-1; LC-3
吉西他濱(gemcitabine)是一種抗代謝類的嘧啶核苷類似物,已作為多個國家的臨床批準用藥。NCCN指南推薦,對于部分轉移或者不能切除的肝膽類腫瘤患者可以選用吉西他濱作為基礎的一線化療藥物;對于可以切除的腫瘤患者可以選用吉西他濱作為一種輔助的治療方案[1]。但是由于化療藥的廣泛使用以及耐藥性的出現,導致化療藥物的療效有一定的限制[2]。化療藥物對腫瘤細胞的生長抑制通過誘導細胞產生Ⅰ型死亡,即細胞的凋亡。也有部分藥物是通過導致細胞發生Ⅱ型程序性細胞死亡,即細胞自噬[3,4]。關于吉西他濱對肝癌細胞的抑制機制的探討報道較少。本研究旨在探討吉西他濱對人肝癌HepG2細胞的抑制作用及其可能的機制。
1 材料與方法
1.1 細胞株、主要試劑及儀器
肝癌HepG2細胞(上海細胞庫);吉西他濱(武漢東康源科技有限公司);DEME高糖培養液、胰蛋白酶、胎牛血清(Hyclone公司);CCK-8(碧云天beyotime);自噬誘導劑3-MA(Sigma公司);Anexin Ⅴ-FITC/PI雙染細胞凋亡檢測試劑盒(南京凱基生物);自噬體染料MDC(南京凱基生物);細胞RNA提取試劑盒(全式金生物技術有限公司);RNA反轉錄試劑盒(Thermo Fisher Scientific);PCR擴增試劑盒(TaKaRa)。細胞培養箱(美國Thermo Fisher Scientific公司,型號Labserv CO-150)、倒置生物顯微鏡(日本Olympus公司,型號CX-41)、酶標儀(上海永創醫療器械有限公司,型號SM800)、流式細胞儀(美國BD公司,型號FACSCalibur)。
1.2 細胞培養及處理
人肝癌HepG2細胞培養于37 ℃、5% CO2培養箱中,動態觀察細胞的生長情況,使用DMEM培養基傳代培養。
1.3 CCK-8法檢測藥物作用后細胞的存活率
對數生長期的細胞以1×105個/ml的濃度接種于96孔板中,分別設立加吉西他濱的實驗組、不加吉西他濱的對照組以及不加細胞的空白組。實驗組的吉西他濱終濃度為0.4,0.8,1.6,3.2 μg/ml。將96孔板放入培養箱中恒溫孵育,藥物作用24 h和48 h立即加入總體積10%的CCK-8試劑,在酶標儀下檢測450 nm處的吸光度值,根據結果計算細胞的抑制率,以及分別計算藥物24 h和48 h的半數抑制濃度(IC50)值。根據軟件計算得出24 h的IC50值,加入IC50值濃度的吉西他濱,同時設置另一組在加入相同濃度吉西他濱的基礎上加入100 μl濃度為5 mmol/L的3-MA試劑,同樣,檢測吸光度值。抑制率=(A對照孔-A實驗孔)/(A對照孔-A空白孔)×100%。
1.4 流式細胞術檢測細胞凋亡
對數生長期的細胞以1×106個/ml的濃度接種于6孔板中,分別設立加入吉西他濱的實驗組以及不加藥物的對照組。實驗組的吉西他濱藥物終濃度為0.4,0.8,1.6,3.2 μg/ml。將6孔板放入培養箱中恒溫孵育,培養24 h立即收集細胞并用PBS清洗細胞兩次。將細胞重懸于100 μl含Annexin Ⅴ-FITC和PI的binding buffer,室溫避光孵育15 min,上機前再加入200 μl的binding buffer,然后上機檢測。
1.5 熒光顯微鏡觀察自噬
對數生長期的細胞以1×106個/ml的濃度接種于6孔板中,分別設立加入吉西他濱的實驗組以及不加藥物的對照組。根據CCK-8結果計算出的IC50值,實驗組加入吉西他濱藥物的終濃度為1.57 μg/ml。將6孔板放入培養箱中恒溫孵育,培養24 h棄去上清,加入0.05 mmol/L濃度的MDC試劑,37 ℃孵育30 min,用PBS緩沖液洗去未結合的熒光染料,在熒光顯微鏡下觀察自噬顆粒。
1.6 實時熒光定量PCR檢測藥物作用后細胞內自噬基因的表達水平
對數生長期的細胞以1×106個/ml的濃度接種于6孔板中,分別設立加入吉西他濱的實驗組以及不加入藥物的對照組,實驗組的吉西他濱藥物終濃度為0.4,0.8,1.6,3.2 μg/ml。將6孔板放入培養箱中恒溫孵育,培養24 h收集細胞,采用TransZol Up法提取細胞內的總RNA。將RNA反轉錄為cDNA,使用核酸定量儀分析后,通過實時熒光定量PCR法,比較各組之間細胞內基因表達的相對含量。
1.7 統計學分析
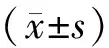
2 結果
2.1 CCK-8結果顯示吉西他濱對HepG2細胞具有明顯的抑制作用
結果顯示,不同濃度的吉西他濱對于肝癌HepG2細胞有明顯的抑制作用,并且抑制率隨著濃度的上升不斷增大,呈現劑量依賴性。吉西他濱對肝癌HepG2細胞24 h的IC50值為1.57 μg/ml,48 h的IC50值為0.72 μg/ml。1.57 μg/ml吉西他濱組對肝癌HepG2細胞的存活率為(48.7±1.23)%,1.57 μg/ml吉西他濱+3-MA組對肝癌HepG2細胞的存活率為(61.22±2.17)%,差異具有統計學意義(t=15.872 5,P<0.01,見圖1)。

同時點與對照組(0 μg/ml)相比,*P<0.01圖1 不同濃度吉西他濱對肝癌HepG2細胞的抑制作用Figure 1 Inhibitory effects of gemcitabine at different concentrations on survival rate of HepG2 cells
2.2 流式細胞術檢測吉西他濱作用于HepG2細胞后的凋亡情況
與對照組比較,不同濃度的吉西他濱組細胞凋亡率明顯升高,差異具有統計學意義(P<0.01,見表1),呈現明顯的劑量依賴性。
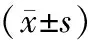

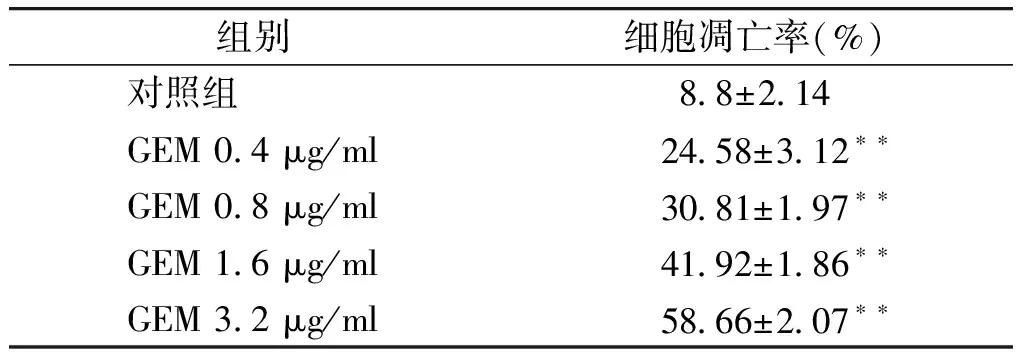
組別細胞凋亡率(%)對照組88±214GEM04μg/ml2458±312??GEM08μg/ml3081±197??GEM16μg/ml4192±186??GEM32μg/ml5866±207??
與對照組相比,**P<0.01
2.3 熒光顯微鏡檢測吉西他濱作用后細胞的自噬情況
細胞經MDC染色,熒光顯微鏡下觀察可見吉西他濱組中自噬顆粒(黃色箭頭示)多于對照組細胞,吉西他濱組細胞在胞質及核周區域可見清晰明亮的點狀自噬顆粒(見圖2)。
2.4 熒光定量PCR檢測吉西他濱作用后細胞自噬基因的表達
與對照組相比,不同濃度的吉西他濱處理組Beclin-1的基因表達量呈上升趨勢(P<0.05,見圖3),且呈現劑量依賴效應。同樣,不同濃度的吉西他濱處理組,LC-3基因的表達水平也呈現上升的趨勢(P<0.05,見圖4)。結果提示吉西他濱可能誘導HepG2細胞自噬的發生。

A.對照組 B.1.57 μg/ml吉西他濱組圖2 熒光顯微鏡觀察經MDC染色后細胞自噬情況Figure 2 Observation of autophagy after MDC staining under fluorescence microscopy
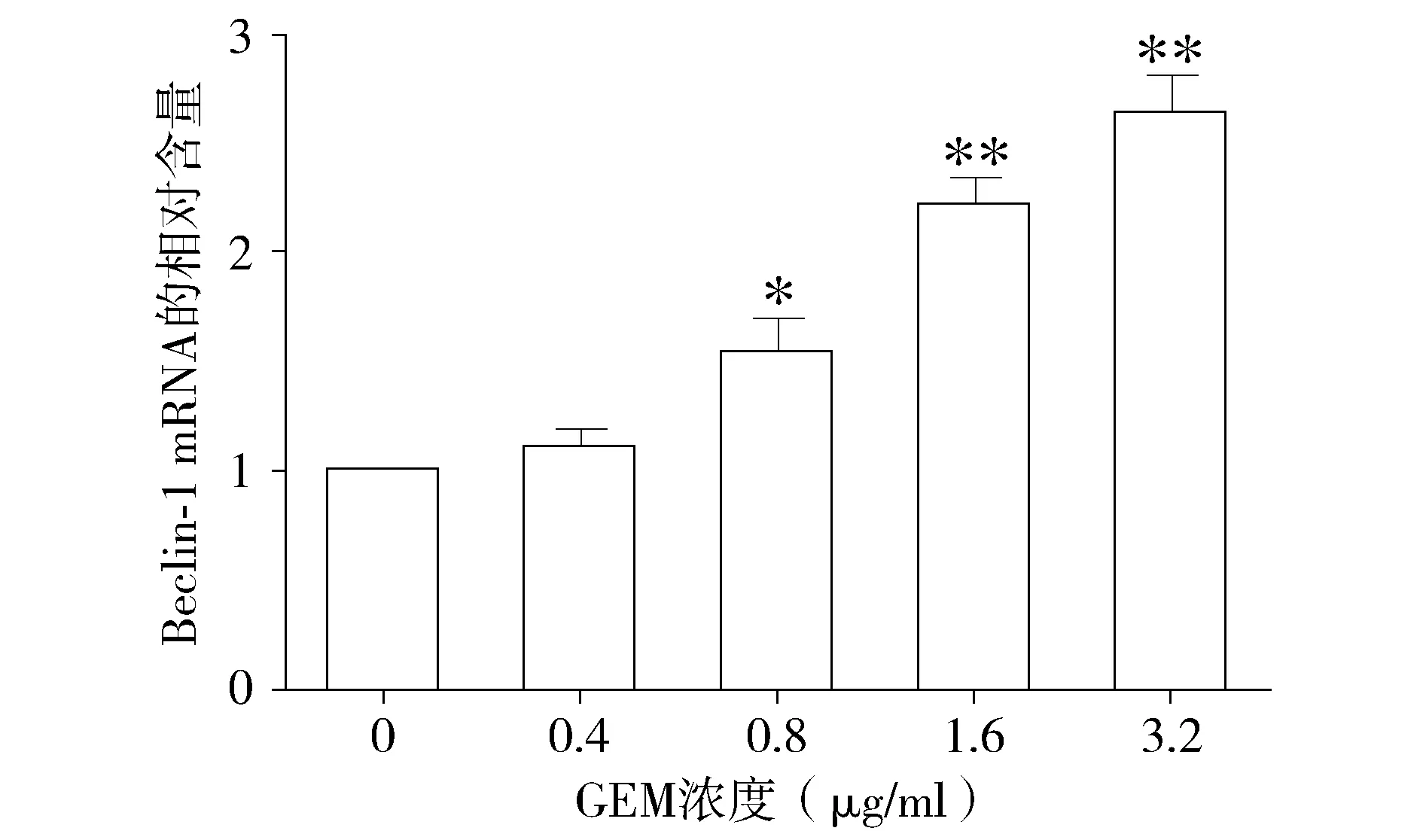
與對照組(0 μg/ml)相比,*P<0.05,**P<0.01圖3 不同濃度的吉西他濱對HepG2細胞Beclin-1基因表達的影響Figure 3 Effect of different concentrations of gemcitabine on the expression of Beclin-1 gene in HepG2 cells
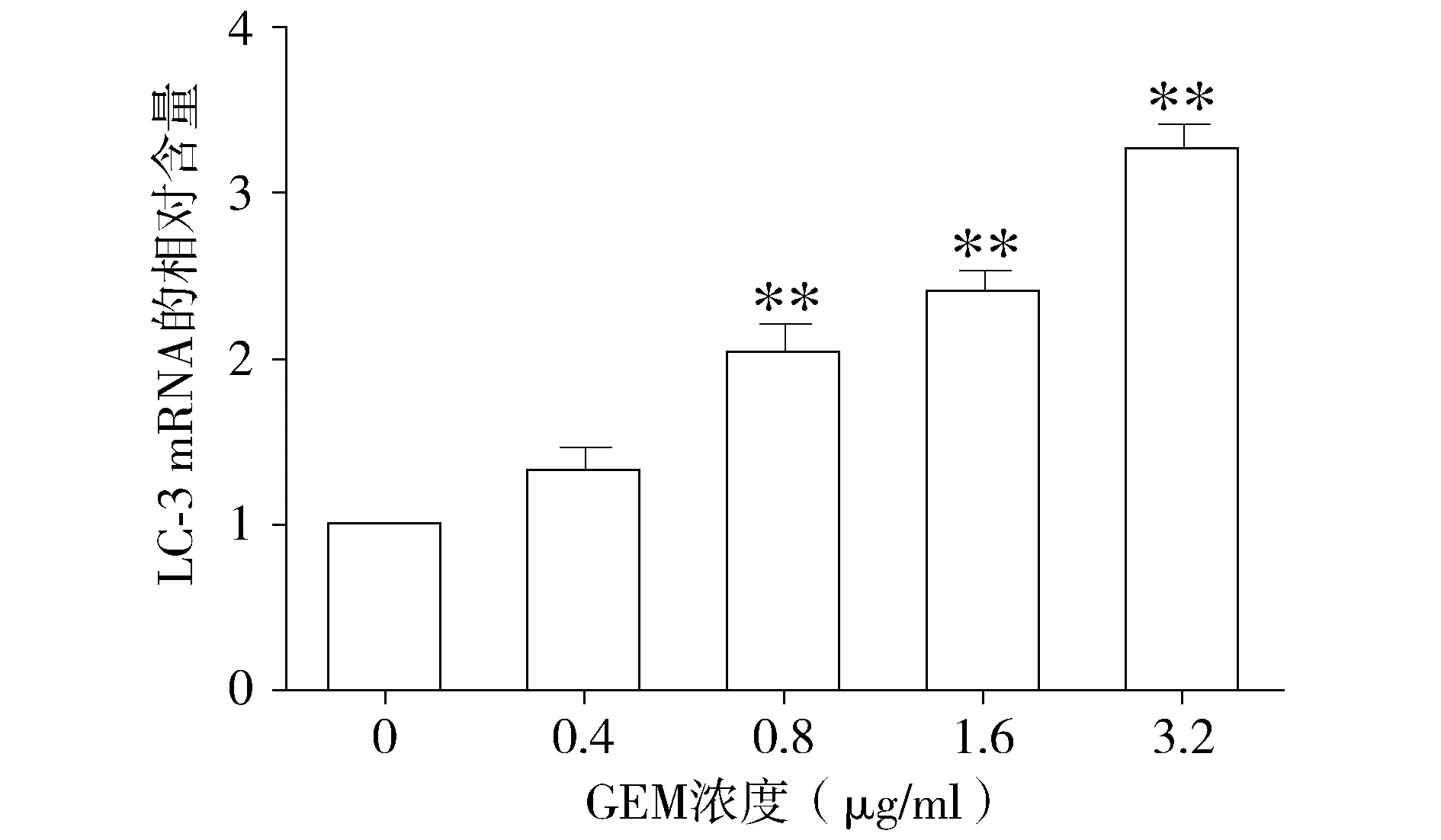
與對照組(0 μg/ml)相比,*P<0.05,**P<0.01圖4 不同濃度的吉西他濱對HepG2細胞LC-3基因的表達的影響Figure 4 Effect of different concentrations of gemcitabine on the expression of LC-3 gene in HepG2 cells
3 討論
肝癌是目前全球癌癥致死率極高的疾病,患病初期就診率較低,確診時往往已經進入晚期[5],多數患者因手術耐受性較差只能進行化療,部分經過手術治療的患者術后復發仍舊需要化療[6]。因此,為了改善肝癌患者的治療現狀,臨床上需要更多的有效藥物來治療肝癌。吉西他濱是一種水溶性的脫氧胞苷類似物,主要功能為抗代謝,以三磷酸鹽和脫氧胞苷三磷酸競爭性地結合DNA,影響細胞的代謝,已經廣泛的應用于多種腫瘤[7]。由于原發性肝癌的治療效果受限,因此如何進一步提高吉西他濱在肝癌細胞治療中的療效,深入研究其作用機制是研究者探索的目標。
自噬是一種進化上高度保守的溶酶體降解通路,是一種細胞的自我消化過程,是細胞為了自身發展、分化、生存,維持穩定的一種生理過程。自噬包括3種形式:一種為巨自噬,一種為微自噬,還有分子伴侶介導的自噬[8]。一般情況下,自噬即為巨自噬,形成典型的雙層膜囊自噬體。自噬對腫瘤細胞具有雙重作用,一方面可以幫助細胞度過不良的生活環境,另一方面自噬可以直接導致細胞死亡[9]。目前,關于肝癌中自噬與藥物的關系的研究已經有部分報道,但是吉西他濱作為治療肝癌的新藥,凋亡和自噬在研究中的關系尚未完全清楚,本研究旨在初步探討吉西他濱對于肝癌細胞的自噬和凋亡的作用。
Beclin-1與LC-3在自噬的發生中起著重要的作用,Beclin-1是自噬過程的起始信號,參與激活自噬的信號通路。LC-3是自噬體膜上的重要分子,被廣泛的公認為是自噬的一種可靠的標志物[10]。本研究采用熒光定量PCR檢測Beclin-1與LC-3基因的表達量,結果顯示,與對照組相比較,不同濃度的吉西他濱組Beclin-1,LC-3的基因表達量均有所上升,并且隨著濃度的升高表達量逐漸上升。結合MDC染色中出現的自噬泡,可見,吉西他濱可以誘導人肝癌HepG2細胞發生自噬。本研究流式細胞術的結果顯示,吉西他濱可以明顯地促進人肝癌HepG2細胞發生凋亡。MTT結果顯示,吉西他濱對于人肝癌細胞有著明顯的抑制作用,通過應用3-AM自噬抑制劑,抑制率明顯降低,說明吉西他濱對于誘導的自噬可以抑制肝癌細胞的生長。
早在1995年Huang等[11]學者就發現吉西他濱可以通過抑制細胞內DNA的合成來誘導細胞發生凋亡,后續學者又發現吉西他濱可以誘導多種細胞發生自噬。自噬在腫瘤的不同階段發揮著不同的作用,大量研究表明自噬的紊亂在腫瘤細胞中發揮著較大的作用[12]。但是吉西他濱是否同時通過誘導肝癌細胞發生自噬和凋亡來共同促進對肝癌細胞的殺傷作用,并沒有研究。總而言之,根據本實驗的研究結果證明,吉西他濱可以抑制人肝癌HepG2細胞的生長,一部分是通過誘導細胞凋亡,另外一部分是通過誘導細胞自噬。
[1] Zheng Y, Xu D, Bu Z. Chinese version of NCCN Clinical Practice Guidelines in Oncology officially authorized by NCCN [J]. Chin J Cancer Res, 2016, 28(1):144-145.
[2] 吳孟超.原發性肝癌在中國的治療和研究現狀[J].成都醫學院報,2012,7(2):161-162.
[3] 張武德,程衛東,鮑英存,等.扶正抑瘤湯對肝癌Hu-7細胞誘導凋亡及自噬的作用[J].中國老年學雜志,2015,35(21):6036-6039.
[4] 陸立鶴,吳偉康.細胞死亡方式研究進展[J].國際病理科學與臨床雜志,2005,25(6):507-510.
[5] 尹咪咪,張建華,張萍萍,等.基于BP算法的血液指標聯合檢測在肝癌及肝炎診斷中的應用[J].鄭州大學學報(醫學版),2016,51(2):190-193.
[6] 湯釗猷.肝癌治療的“消滅與改造并舉”策略[J].實用肝臟病雜志,2015,(2):113-114.
[7] 闞朝輝,闞慶生.吉西他濱與卡培他濱聯合治療晚期膽管細胞癌的近期效果及隨訪[J].中國普通外科雜志,2016,25(8):1219-1223.
[8] 左全庭,吳成翰,高麗麗,等.自噬與卒中[J].國際腦血管病雜志,2010,18(7):548-552.
[9] 劉輝,李曉強,朱人大,等.自噬激活如何影響大鼠內皮祖細胞凋亡、增殖和周期的變化?[J].中國組織工程研究,2015,7(1):67-71.
[10] Hu YF, Lei X, Zhang HY,etal. Expressions and clinical significance of autophagy-related markers Beclin1, LC3 and EGFR in human cervical squamous cell carcinoma[J]. Onco Targets Ther,2015,8:2243-2249.
[11] Huang P, Plunkett W. Induction of apoptosis by gemcitabine[J]. Semin Oncol,1995,22:19-25.
[12] Alec CK, Eileen W. Autophagy and tumor metabolism[J]. Cell Metab, 2017, 25(5):1037-1043.
TheinhibitoryeffectofgemcitabineonhumanhepatocellularcarcinomaHepG2cellsanditspossiblemechanism
SONG Binyu
(ScienceandTechnologyCenter,FenyangCollegeofShanxiMedicalUniversity,Fenyang032200,China)
ObjectiveTo investigate the inhibitory effect of gemcitabine on human hepatocellular carcinoma HepG2 cells and its possible mechanism.MethodsCCK-8 method was used to detect the HepG2 cell growth after treated with different concentrations of gemcitabine(0.4, 0.8, 1.6, 3.2 μg/ml) for 24 h and 48 h. Based on the treatment of gemcitabine(the half inhibitory concentration of the cell,1.57 μg/ml), the autophagy inhibitor 3-MA was added to observe the inhibition of cell growth. The apoptosis of HepG2 cells was detected by flow cytometry after exposed to gemcitabine. The morphological changes of MDC cell autophagy after staining were observed under fluorescence microscopy. RT-PCR was used to detect the expression of autophagy-related genes LC-3 and Beclin-1.ResultsThe results of CCK-8 showed that gemcitabine had a great growth inhibitory effect on human hepatoma HepG2 cells in a concentration- and time-dependent manner. After the administration, the cell survival rate decreased significantly compared with control group (P<0.01) When adding autophagy inhibitor 3-MA based on 1.57 μg/ml gemcitabine treatment, the survival rate of the cells was significantly increased from (48.7±1.23)% to (61.22±2.17)%(P<0.01). Flow cytometry showed that the apoptosis of hepatoma HepG2 cells increaced after exposed to gemcitabine in a concentration-dependent manner. MDC staining and real-time fluorescence quantitative PCR results showed that gemcitabine induced the autophagy of HepG2 cells and increased the expression of autophagy-related genes Beclin-1 and LC-3.ConclusionGemcitabine has a significant inhibitory effect on human hepatocellular carcinoma cell line HepG2, which may lead to the eventual death of cells by inducing the apoptosis and autophagy.
gemcitabine; HepG2 cells; cell autophagy; cell apoptosis; Beclin-1; LC-3
R735.7
A
1007-6611(2017)09-0875-04
10.13753/j.issn.1007-6611.2017.09.001
山西醫科大學汾陽學院科技發展基金資助項目(2016B02)
宋彬妤,女,1980-03生,碩士,實驗師,E-mail:yanbeipan@sina.com
2017-04-12

