miR-106a在腎癌組織中的表達及對腎癌細胞系A498增殖的影響
馬亞東,白世安,宋紅雄,強亞勇,胡海峰
(延安大學附屬醫院泌尿外科,延安 716000;*通訊作者,E-mail:wangziming201415@126.com)
miR-106a在腎癌組織中的表達及對腎癌細胞系A498增殖的影響
馬亞東*,白世安,宋紅雄,強亞勇,胡海峰
(延安大學附屬醫院泌尿外科,延安 716000;*通訊作者,E-mail:wangziming201415@126.com)
目的 研究miR-106a在腎癌、癌旁正常組織表達情況及其在腎癌細胞系A498中的作用。 方法 運用real-time PCR檢測33例腎癌及相應的癌旁正常組織中miR-106a的表達,分析其與臨床病理特征的相關性;在腎癌A498細胞中轉染miR-106a過表達載體及其抑制劑,實驗分為4組:空載體對照組、miR-106a過表達載體組、陰性對照組、miR-106a抑制劑組;MTT實驗檢測miR-106a對腎癌A498細胞增殖的影響;應用流式細胞儀分析miR-106a對細胞周期的影響。 結果 miR-106a在腎癌組織中的表達顯著上調(P<0.01),并與腎癌的T分期有相關性(P<0.05)。miR-106a過表達載體與空載體對照組相比,促進了細胞增殖,G0/G1期細胞數量顯著減少(P<0.01),S和G2/M期細胞數量顯著增加(P<0.01);而miR-106a抑制劑組與陰性對照組相比,細胞增殖抑制,G0/G1期細胞數量顯著增加(P<0.01),S和G2/M期細胞數量顯著減少(P<0.01)。 結論 miR-106a在腎癌組織中上調,通過促使細胞進入S和G2/M期而促進腎癌細胞分裂、增殖。
miR-106a; 細胞增殖; 細胞周期; 腎癌
腎癌是泌尿系統常見的惡性腫瘤之一,在泌尿系統腫瘤中發病率僅次于膀胱癌位居第二位,占腎臟惡性腫瘤的85%[1]。腎癌的發病率逐年升高,早期沒有特異性癥狀,許多患者發現時已進入晚期[2]。目前,手術仍然是腎癌的主要治療方法,而放療、化療和生物靶向治療效果差強人意。因此,加強對腎癌發生發展機制和早期診斷相關的分子標志物的研究尤為重要。
微小RNAs(microRNAs,miRNAs,miR)是一類高度保守的非編碼單鏈RNA分子,約由21-25個核苷酸組成[3]。miRNAs與靶mRNA特異性地堿基互補配對結合,促進靶基因mRNA的降解或者抑制其翻譯,從而在轉錄后水平調控基因表達,參與細胞存活、增殖、分化、凋亡,機體的發育、代謝,及腫瘤的發生發展等多種生物學過程[4]。在腫瘤的發生發展過程中,miRNAs會通過調控與腫瘤相關的癌基因或抑癌基因的表達來發揮其作用[5]。因此,本研究采用real-time PCR方法檢測miR-106a在腎癌組織與癌旁正常對照組織中的表達情況,在腎癌細胞中轉染miR-106a過表達載體及miR-106a抑制劑,分析miR-106a對腎癌細胞增殖的影響,為探索腎癌發病機制及診斷治療的研究提供新的研究思路。
1 材料與方法
1.1 材料
收集2015-03~2016-05延安大學附屬醫院泌尿外科手術切除的腎癌組織及其相對應的癌旁正常組織33對,手術后均經病理檢查確認。收集的樣本在液氮中長期保存。采集樣本前經過醫院倫理委員會批準以及獲得患者知情同意。人腎癌細胞系A498購于西安交通大學第一附屬醫院轉化醫學中心。
1.2 主要試劑與儀器

1.3 實時熒光定量PCR(real-time PCR)
將臨床腎癌樣本組織、癌旁正常組織、A498細胞(分別轉染空載體、miR-106a過表達載體、陰性對照、miR-106a抑制劑)利用RNA提取試劑盒,提取細胞RNA。分別加入特異性莖環引物(內參U6-RT:5′-CGCTTCACGAATTTGCGTGTCAT-3′;miR-106a-RT:5′-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATACGACCTACCTG-3′),依照試劑盒說明書操作逆轉錄cDNA,反應溫度:37 ℃ 15 min,85 ℃ 5 s。real-time PCR反應,按照序列設計引物。內參U6引物Forward:5′-GCTTCGGCAGCACATATACTAAAAT-3′,U6引物Reverse:5′-CGCTTCACGAATTTGCGTGTCAT-3′;miR-106a引物Forward:5′-ATCCAGTGCGTGTCGTG-3′,Reverse:5′-TGCTAAAAGTGCTTACAGTG-3′。擴增條件:95 ℃變性30 s,60 ℃退火30 s,72 ℃延伸30 s,40個循環,72 ℃延伸5 min終止反應。所有樣品均設立4個復孔,通過2-ΔΔCt法分析real-time PCR數據。腎癌組織中miR-106a相對值>1認定為高表達,≤1認定為低表達。分析miR-106a表達與臨床病理特征的關系。
1.4 構建miR-106a過表達載體及合成其抑制劑
從miRbase數據庫獲得hsa-miR-106a的前體序列(5′-CCTTGGCCATGTAAAAGTGCTTACAGTGCAGGTAGCTTTTTGAGATCTACTGCAATGTAAGCAC-TTCTTACATTACCATGG-3′),在兩端分別構建EcoRⅠ和HindⅢ酶切位點,將該序列插入到真核表達載體pcDNA6.2-GW/EmGFP質粒中,再由上海生工生物工程有限公司進行篩選、測序鑒定。miR-106a抑制劑的陰性對照(5′-CAGUACUUUUGUGUAGUACAA-3′)和miR-106a抑制劑(5′-CUACCUGCACUGUAAGCACUUUU-3′)由上海生工生物工程有限公司合成。
1.5 細胞培養與轉染
人腎癌細胞系A498細胞采用10%胎牛血清的DMEM培養基,在5%CO2,37 ℃培養箱中培養,取對數生長期的A498細胞進行后續實驗。實驗分組為:空載體對照組、miR-106a過表達載體組、陰性對照組、miR-106a抑制劑組(僅轉染miR-106a抑制劑)。細胞在培養24 h時,各組依照TurboFect轉染說明書瞬時轉染。
1.6 MTT實驗檢測miR-106a對A498細胞增殖的影響
轉染前24 h以5 000個/孔將A498細胞種植于96孔板。分別轉染空載體、miR-106a過表達載體、陰性對照、miR-106a抑制劑,每組設5個復孔。轉染后24,48,72 h分別加入5 mg/ml MTT溶液20 μl,繼續培養4 h后吸棄上清液,活細胞線粒體中的琥珀酸脫氫酶能使外源性MTT還原為不溶于水的藍紫色結晶甲瓚,而死細胞無有活性的琥珀酸脫氫酶,然后加入150 μl DMSO溶解甲瓚,用微板測試儀在490 nm波長處檢測OD值,以此來分析細胞生長活力。OD值越高表示細胞的生長活力增加,反之則表示細胞的生長活力降低。
1.7 流式細胞儀檢測miR-106a對A498細胞周期的影響
上述各組細胞轉染48 h時收集單細胞懸液,每組均3個復孔,預冷的PBS洗滌,用75%乙醇固定12 h;再加入濃度為100 μg/ml碘化丙啶染液0.5 ml染色,室溫下靜置10 min;采用流式細胞儀檢測,利用隨機軟件Modfit LT分析A498細胞的DNA含量變化,進而分析細胞周期變化。
1.8 統計學分析
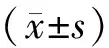
2 結果
2.1 腎癌中miR-106a的表達及其與臨床病理特征的關系
應用real-time PCR檢測33對腎癌組織及癌旁正常組織miR-106a的表達變化。結果表明,miR-106a在腎癌組織中有24例高表達,9例低表達;統計分析顯示,與癌旁正常組織相比,miR-106a在腎癌組織中表達顯著上調(P<0.01,見圖1)。miR-106a的表達與腎癌的T分期有關(P<0.05),而在不同年齡、性別、組織類型、M分期和N分期等患者中miR-106a表達差異均無統計學意義(見表1)。
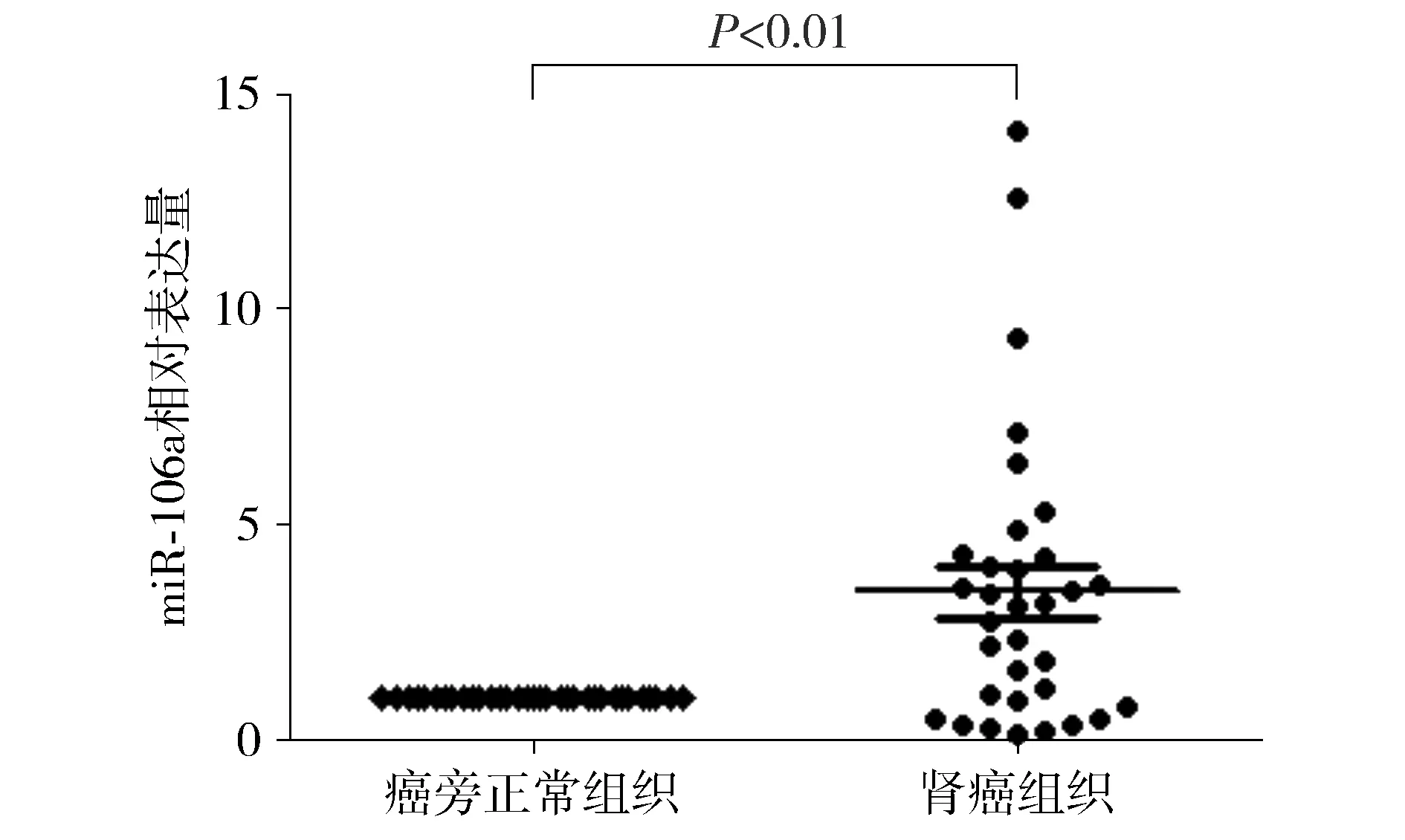
圖1 miR-106a在腎癌組織中表達上調Figure 1 The miR-106a expression increases in renal carcinoma tissues
表1miR-106a的表達與臨床病理特征的關系
Table1CorrelationofmiR-106aexpressionwithclinicopathologicalcharacteristics
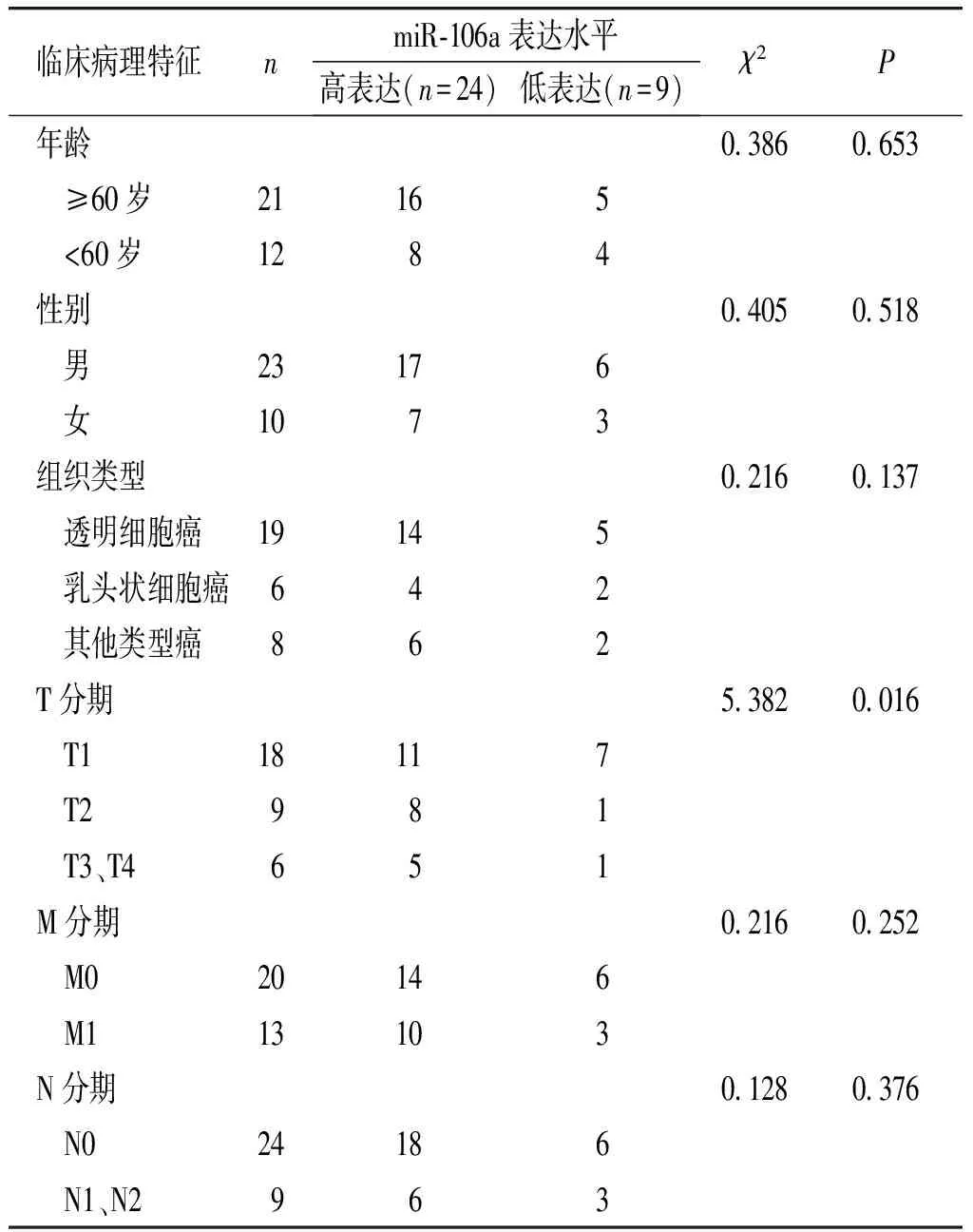
臨床病理特征nmiR?106a表達水平高表達(n=24)低表達(n=9)χ2P 年齡03860653 ≥60歲21165 <60歲1284 性別04050518 男23176 女1073 組織類型02160137 透明細胞癌19145 乳頭狀細胞癌642 其他類型癌862 T分期53820016 T118117 T2981 T3、T4651 M分期02160252 M020146 M113103 N分期01280376 N024186 N1、N2963
2.2 miR-106a對腎癌A498細胞增殖的影響
結果表明,與空載體對照組相比,miR-106a過表達載體組miR-106a表達顯著上調(P<0.01),上調至73.62倍;轉染抑制劑后miR-106a表達顯著下調(P<0.05),下調至0.71倍(見圖2)。應用MTT比色法實驗分析miR-106a對腎癌A498細胞增殖活力的影響,結果顯示,與空載體對照組相比,miR-106a過表達載體在轉染48,72 h時A498細胞的增殖活力顯著增強,促進了細胞增殖(P<0.01);與陰性對照組相比,轉染miR-106a抑制劑48,72 h時A498細胞的增殖活力顯著降低,抑制了細胞增殖(P<0.01,見圖3),這證明miR-106a可促進腎癌A498細胞的增殖。
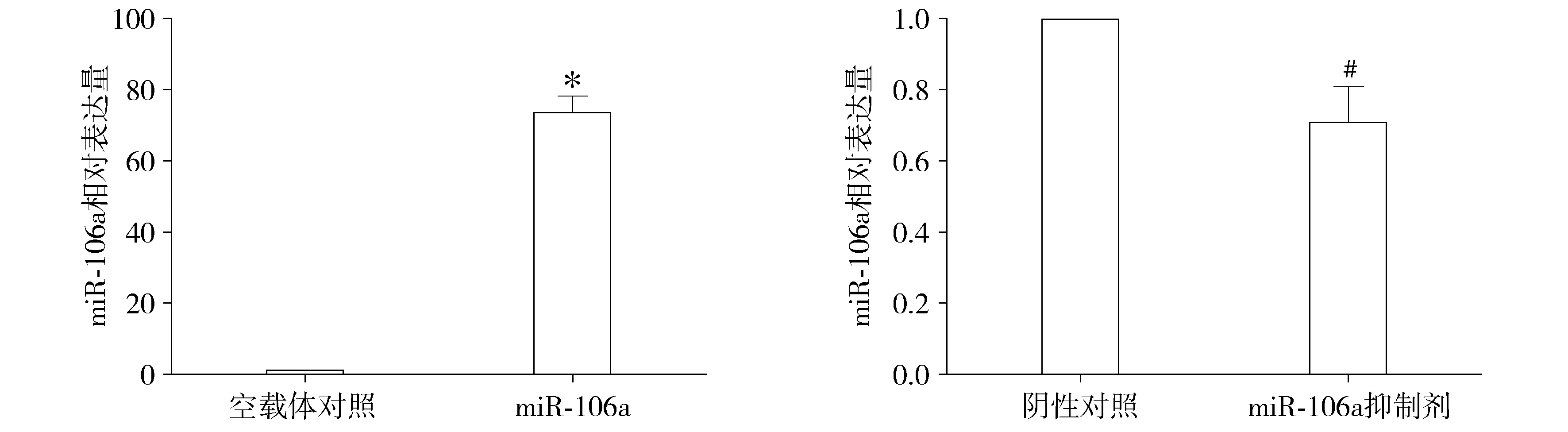
與空載體對照比較,*P<0.01A.轉染miR-106a表達載體后miR-106a表達 與陰性對照比較,#P<0.05B.轉染miR-106a抑制劑后miR-106a表達圖2 在腎癌A498細胞中轉染miR-106a過表達載體和抑制劑后miR-106a表達Figure 2 The miR-106a expression after transcription miR-106a overexpression vector and inhibitor in renal carcinomaA498 cells
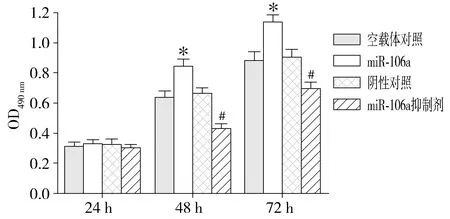
同時點與空載體對照組相比,*P<0.01;同時點與陰性對照組相比,#P<0.01圖3 MTT比色法分析miR-106a對A498細胞增殖的影響Figure 3 Effect of miR-106a on the A498 cell proliferation by MTT assay
2.3 miR-106a對腎癌A498細胞周期的影響
在分別轉染miR-106a過表達載體和抑制劑48 h時,采用流式細胞儀檢測細胞周期。miR-106a過表達載體組與空載體對照組相比,G0/G1期細胞數量顯著減少(P<0.01),S期細胞數量顯著增加(P<0.01),G2/M期細胞數量也顯著增加(P<0.01);miR-106a抑制劑組與陰性對照組相比,G0/G1期細胞數量顯著增加(P<0.01),S期細胞數量顯著減少(P<0.01),G2/M期細胞數量也顯著減少(見圖4)。結果表明,miR-106a可促進腎癌A498細胞跨過在G0/G1-S期節點,使腎癌A498細胞進入S和G2/M期進行分裂和增殖。
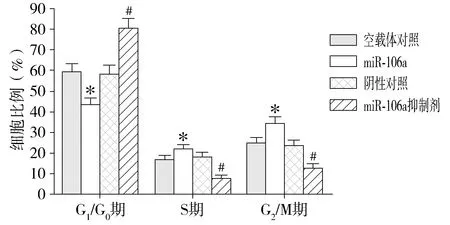
與空載體對照組相比,*P<0.01;與陰性對照組相比,#P<0.01圖4 miR-106a對A498細胞周期的影響Figure 4 Effect of miR-106a on the cell cycle of A498 cells
3 討論
MiRNAs是一類小片段非編碼的單鏈RNA分子。MiRNAs可通過與靶基因的非翻譯區(untranslated region,UTR)結合,在轉錄后水平調控其靶基因的表達。近年來研究表明,哺乳動物內大多數基因表達受miRNAs的調節,miRNAs廣泛參與細胞存活、生長、發育、分化、代謝、凋亡等多種生理活動[6]。MiRNAs的表達異常與胃癌、食管癌、肺癌、肝癌、前列腺癌、結直腸癌等多種惡性腫瘤的發生發展關系密切[7-9]。例如,miR-19b-1、miR-193b-3p、miR-21、miR-27a、miR-99b-5p等在腎癌中表達異常,并與腎癌的進展相關[10,11]。近期的研究發現,miR-106a在肺癌、結直腸癌、胃癌、卵巢癌等多種類型的腫瘤組織中表達上調,并通過調控不同的信號通路來調節細胞的增殖、分化、凋亡等生物學過程。然而,miR-106a在腎癌中的表達水平及其作用仍不清楚,對miR-106a的研究將加深對腎癌發病機制的理解,為腎癌的早期診斷和治療提供新的思路。
本研究發現,與癌旁正常組織相比,miR-106a在腎癌組織中高表達,并與腎癌的T分期相關。在腎癌細胞系A498細胞的體外實驗中,通過轉染miR-106a過表達載體和抑制劑,進一步觀察其對A498細胞增殖能力及細胞周期的影響。結果發現,與空載體組相比(排除空質粒載體對細胞的影響),轉染miR-106a過表達載體可促使A498細胞進入S和G2/M期進行分裂和增殖;而與陰性對照組相比(由于采用無效的RNA序列,則可排除RNA本身對細胞的影響),轉染miR-106a抑制劑可使A498細胞阻滯在G0/G1期,抑制了細胞增殖。從而證明了miR-106a可影響腎癌A498細胞的生物學功能,可能與腎癌的發病機制及進展密切相關。
腎癌大約占成年人惡性腫瘤3%,并且其發病率呈現逐年上升趨勢[12]。腎癌的早期無特異性癥狀,僅有少部分患者會出現腎癌三聯征(疼痛、血尿、腫塊)。大多數患者發現時已經為晚期,且預后極差。目前影響腎癌發生發展的分子機制尚未闡明。miRNAs主要是通過作用于下游的靶基因發揮作用。在非小細胞肺癌中,miR-106a通過靶向調控PTEN表達促進腫瘤生長和轉移[10]。在結直腸癌中,miR-106a通過靶向調控ATG7表達抑制腫瘤細胞凋亡[11]。在胃癌中,miR-106a通過靶向調控FAS表達抑制胃癌細胞凋亡[13]。下一步將通過生物信息學工具(miRbase Target,PicTar和TargetScan)預測miR-106a可能的靶基因,進一步研究miR-106a影響腎癌細胞增殖的分子機制,揭示腎癌進展的作用靶點。如能通過miR-106a尋找到腎癌發生發展的分子機制,將可能為腎癌的早期診斷提供分子標志物以及治療提供分子靶點,從而提高腎癌的早期診斷率及提供更加有效的新治療方案。
[1] Feng H, Zhang W, Li J,etal. Different patterns in the prognostic value of age for bladder cancer-specific survival depending on tumor stages[J]. Am J Cancer Res, 2015, 5(6):2090-2097.
[2] Montagnac R, Champion J, Pradel J,etal. Muscular metastases from renal cellcarcinoma[J]. Nephrol Ther,2016,12(7):539-542.
[3] Vaira V, Verdelli C, Forno I,etal. MicroRNAs in parathyroid physiopathology[J]. Mol Cell Endocrinol, 2016, 11(2):256-262.
[4] 馬欽,楊烈,王存,等.應用微陣列芯片分析結腸癌組織中miRNA差異性表達[J].四川大學學報(醫學版),2011,42(3):344-348.
[5] Li Y, Chen L, Chan TH,etal. Hepatocellular carcinoma: transcriptome diversity regulated by RNA editing[J]. Int J Biochem Cell Biol, 2013, 45(8):1843-1848.
[6] Virtanen E, Pietila T, Nieminen P,etal. Low expression levels of putative HPV encoded microRNAs in cervical samples[J]. Springerplus, 2016, 5(1):1856-1866.
[7] Volinia S, Calin GA, Liu CG,etal. A microRNA expression signature of human solid tumors defines cancer gene targets[J]. Proc Natl AcadSci USA, 2006, 103(7):2257-2261.
[8] Wang T, Ma S, Qi X,etal. Long noncoding RNA ZNFX1-AS1 suppresses growth of hepatocellular carcinoma cells by regulating the methylation of miR-9[J]. Onco Targets Ther,2016,9:5005-5014.
[9] Chen X, Zhu L, Ma Z,etal. Oncogenic miR-9 is a target of erlotinib in NSCLCs[J]. Sci Rep, 2015, 5:17031.
[10] Xie X, Liu HT, Mei J,etal. miR-106a promotes growth and metastasis of non-small cell lung cancer by targeting PTEN[J]. Int J Clin Exp Pathol, 2015, 8(4):3827-3834.
[11] Hao H, Xia G, Wang C,etal. miR-106a suppresses tumor cells death in colorectal cancer through targeting ATG7[J]. Med Mol Morphol, 2017, 50(2):76-85.
[12] Yu TM, Chuang YW, Yu MC,etal. Risk of cancer in patients with polycystic kidneydisease-Authors' reply[J]. Lancet Oncol, 2016, 17(11):e476.
[13] Wang Z, Liu M, Zhu H,etal. miR-106a is frequently upregulated in gastric cancer and inhibits the extrinsic apoptotic pathway by targeting FAS[J]. Mol Carcinog, 2013, 52(8):634-646.
ExpressionofmiR-106ainrenalcancertissuesanditseffectontheproliferationofrenalcancercelllineA498
MA Yadong*,BAI Shian,SONG Hongxiong,QIANG Yayong,HU Haifeng
(DepartmentofUrology,AffiliatedHospitalofYan’anUniversity,Yan’an716000,China;*Correspondingauthor,E-mail:wangziming201415@126.com)
ObjectiveTo investigate the expression of miR-106a in human renal cancer tissues and its role in renal cancer cell line A498.MethodsThe miR-106a expression was detected in 33 cases of renal cancer by real-time PCR. The correlation of miR-106a expression with clinicopathological characteristics was analyzed. MiR-106a overexpression vector and miR-106a inhibitor were transfected into A498 cells. A498 cells were divided into four groups: empty vector control group, miR-106a overexpression vector group, negative control group and miR-106a inhibitor group. The proliferation of A498 cells was examined by MTT assay.The effect of miR-106a on the cell cycle of A498 cells was observed by flow cytometer.ResultsThe expression of miR-106a was significantly up-regulated in renal cancer tissues(P<0.01). High miR-106a expression was associated with T stage(P<0.05). Compared with empty vector control group, A498 cell proliferation was promoted in miR-106a overexpression vector group, the proportion of G1/G0phase cells was decreased(P<0.01), and the proportion of S and G2/M phase cells was increased(P<0.01). Compared with negative control, miR-106a inhibitor suppressed A498 cell proliferation, increased the proportion of G1/G0phase cells(P<0.01), and decreased the propor-tion of S and G2/M phase cells(P<0.01).ConclusionThe expression of miR-106a may increase in renal cancer tissues, and promote the division and proliferation of renal cancer A498 cells through driving cells into S and G2/M phases.
miR-106a; cell proliferation; cell cycle; renal cancer
R737.11
A
1007-6611(2017)09-0935-05
10.13753/j.issn.1007-6611.2017.09.015
國家自然科學基金資助項目(81660492);陜西省自然科學基金資助項目(2014JM4122)
馬亞東,男,1975-04生,博士,副主任醫師,講師,E-mail:wangziming201415@126.com.
2017-06-14

