木質纖維素分解復合菌系的分解特性與細菌組成多樣性分析
何水清 艾士奇 王建豪
摘要:利用木質纖維素分解復合菌系BYND-8對稻稈進行生物處理,研究其分解特性及其細菌組成多樣性,為應用微生物方法處理木質纖維素類資源提供理論依據。通過測定復合菌系在分解稻稈的過程中木質纖維素各成分含量的變化,同時測定分解過程中培養基pH值的變化趨勢,研究其分解特性。運用高通量測序技術對復合菌系rRNA基因的V3-V4區進行測序,分析其細菌組成多樣性。結果表明,復合菌系BYND-8具有較高的木質纖維素分解能力,對培養基的pH值具有自我調節能力;在綱、目、科3個分類水平上,分別將復合菌系中的細菌分成了73個綱、132個目和226個科,復合菌系中細菌在科的分類水平上比較豐富,其中相對量較高、占優勢的細菌為紫單胞菌科(Porphyromonadaceae,1873%)、柄桿菌科(Caulobacteraceae,1203%)和理研菌科(Rikenellaceae,1196%)。木質纖維素分解復合菌系BYND-8具有較高的細菌組成多樣性。
關鍵詞:木質纖維素;分解;復合菌系;高通量測序;多樣性分析;木質纖維素分解機理
中圖分類號: Q9399;S182文獻標志碼:
文章編號:1002-1302(2017)16-0241-06
收稿日期:2016-09-20
基金項目:黑龍江省大學生創新創業訓練計劃(編號:20141022311);國家科技支撐計劃(編號:2015BAD21B04、2016YFD0800602);黑龍江農墾總局科技攻關項目(編號:HNK125B-11-06A、HNK125B-11-11A、JCTG17-04)。
作者簡介:何水清(1994—),男,江西寧都人,主要從事農業廢棄物資源化利用與環境微生物分子生態學的研究。E-mail:616022790@qqcom。
通信作者:王偉東,博士,教授,主要從事農業廢棄物資源化利用與環境微生物分子生態學的研究。E-mail:wwdcyy@126com。
為了減少化石燃料的過度開采而帶來的環境污染,木質纖維素這一重要的生物質資源越來越受到重視。中國是一個農業大國,每年作物秸稈產量約8億t,其中含有大量的木質纖維素資源。這些秸稈中約有30%沒有得到資源化利用,大部分被就地焚燒,不僅造成了資源的浪費,而且引起了嚴重的環境污染。近年來,秸稈等木質纖維素類廢棄物資源化利用越來越受到政府和科研工作者的重視,其中高效、環保、廉價的生物處理法被日益采用[3]。崔宗均等從堆肥樣品中富集篩選、馴化得到1組可高效穩定分解木質纖維素的復合菌系MC1[4-5];趙聽等得到了能分解小麥秸稈的復合菌群FWD1,小麥秸稈的分解率達到7692%;劉長莉篩選馴化出復合菌系NSC-7,稻稈的分解率達447%。同樣也有分解木質纖維素的單菌與復合菌系分解能力比較的研究報道,張曉倫等從垃圾堆腐物中分離得到了3株具有較強纖維素分解能力的真菌,發現由2種不同菌株組成的混合菌系比任何單一菌株的纖維素分解能力強,CMC酶活性是單一菌株的15倍[8];陳耀寧等將1株黃孢原毛平革菌和1株歧皺青霉混合培養,發現木質纖維素的分解率較單一菌株大大提高[9];溫雪等將2株具有較強木質纖維素分解能力的菌株與2株無分解能力的菌株進行組合,發現組合菌群的纖維素分解能力較單獨的菌株分解能力穩定而高效[10]。Kato 等通過對復合系MC1中關鍵菌株的重新組合發現其纖維素的分解能力高于單一菌株[11]。單一菌株對木質纖維素的分解能力遠不及多種菌株協同作用[12-13]。因此,利用微生物復合菌系各菌株之間的協同作用來高效穩定地分解木質纖維素并分析其分解機理具有重要意義。
本研究以實驗室構建的中溫木質纖維素分解復合菌系BYND-8為研究對象,運用高通量測序技術分析其細菌組成多樣性,為復合菌系分解木質纖維素的機理奠定基礎。
1材料與方法
11培養條件
纖維素蛋白胨培養基(PCS):蛋白胨50 g,NaCl 50 g,CaCO3 20 g,酵母粉10 g,木質纖維素(稻稈)50 g,蒸餾水1 L,pH自然,1×105 Pa滅菌15 min,按培養基體積的10%接種,30 ℃靜止培養。
稻稈預處理方法:將稻稈剪切成5 cm的小段,用1%的NaOH溶液浸泡24 h,然后用自來水沖洗稻稈,再用鹽酸(1 mol/L)浸泡,之后用自來水沖洗并浸泡12 h,至pH值為70左右,105 ℃烘干至恒重備用。
12復合菌系的篩選
把旺盛產沼氣的培養液10 mL接種到裝有90 mL PCS培養基的三角瓶內,提前放入濾紙條作為分解的外觀指標,將05 g經預處理的稻稈作為碳源,30 ℃靜止培養。當濾紙條完全分解、稻稈軟化時,按體積10%的接種量接種到同樣的培養基中傳代培養。在繼代培養過程中,留下分解能力強的培養物,淘汰失去分解能力的培養物。如果培養物分解能力下降,則把不同的培養物相互組配,繼續傳代培養。保留分解能力高效且穩定的培養物,用作后續研究。
13復合菌系中稻稈及其木質素、纖維素、半纖維素分解率的變化
取三角瓶,將10 g稻稈加入90 mL PCS培養基中,按體積比接種10%的復合菌系,30 ℃靜止培養。將培養0、1、2、3、4、5、6、7 d的稻稈分別取出,每天取3瓶,5 000 r/min離心,棄上清,為消除菌體用硝酸和鹽酸的混合溶液沖洗稻稈,離心,用清水沖洗,離心,105 ℃烘干至恒重后稱質量,計算每瓶稻稈的失重量和分解率[14],最后計算平均值。烘干后的稻稈經粉碎過篩后用于測定木質素、纖維素和半纖維素的含量。在纖維素分析儀(美國ANKOM220)上,用改良的范式洗滌法測定木質素、纖維素和半纖維素的含量[15],計算分解率。
14復合菌系pH值的動態變化
141復合菌系pH值的變化
100 mL三角瓶內分裝 90 mL PCS培養基,按體積比接種10%的復合菌系,30 ℃靜止培養。每天按時取3瓶復合菌系,用pH計(日本HORIBA)測定其pH值,連續測定10 d。
142不同的起始pH值對復合菌系培養基pH值的影響
將PCS培養液的初始pH值分別調至4、5、6、7、8、9、10,按體積比接種10%的復合菌系,30 ℃靜止培養。每天按時取3瓶復合菌系,用pH計(日本HORIBA)測定其pH值,連續測定 7 d。
15復合菌系的高通量測序
151獲取測序樣品
取稻稈分解能力旺盛階段(接種培養5 d)的液態培養物和稻稈表面的微生物。
培養基中微生物的獲取方法:取適量培養基 12 000 r/min 離心10 min可得到菌體。
稻稈表面微生物的獲取方法:取適量復合菌系處理5 d的稻稈,加入適量PBS緩沖液,150~200 r/min振蕩30~60 min,超聲5 min,再150~200 r/min振蕩30~60 min。取上清液加入到50 mL離心管中,120 00 r/min離心10 min得菌體。
將所得培養基中的微生物和稻稈表面的微生物混合備用。
152提取總DNA
取適量所得的菌體,用氯化芐法提取其總DNA[16]。所提取的總DNA要保證濃度大于10 ng/μL,總量超過500 ng,D260 nm/280 nm在18~22之間。瓊脂糖凝膠電泳主帶清晰。
15316s rDNA基因V3-V4區PCR擴增及測序
提取樣品總DNA后,根據細菌V3-V4區設計得到引物,合并引物接頭,進行PCR擴增,對其產物進行純化、定量及均一化,最后形成測序文庫。對構建好的文庫進行質檢,質檢合格的文庫用Illumina MiSeq PE300進行測序。
154細菌多樣性數據分析
對序列進行聚類,將相似性超過97%的序列劃分到同一個OTU(operational taxonomic units)。按眾數原則對序列進行物種注釋。統計樣品在各個分類水平上的構成,用餅圖進行可視化。對統計樣品中在綱、目、科分類水平上的菌群作聚類,用相同顏色表示該分類水平所含的OTU序列豐度的相對高低。
2結果與分析
21復合菌系中稻稈及其木質素、纖維素、半纖維素分解率的變化
經過連續的傳代培養,已構建出具有高效穩定分解木質纖維素能力的復合菌系BYND-8。經前期的試驗驗證,復合菌系經傳代培養和保存后,菌種組成和功能都已達到穩定。在復合菌系培養過程中,可明顯觀察到濾紙分解,稻稈軟化成細絲狀。
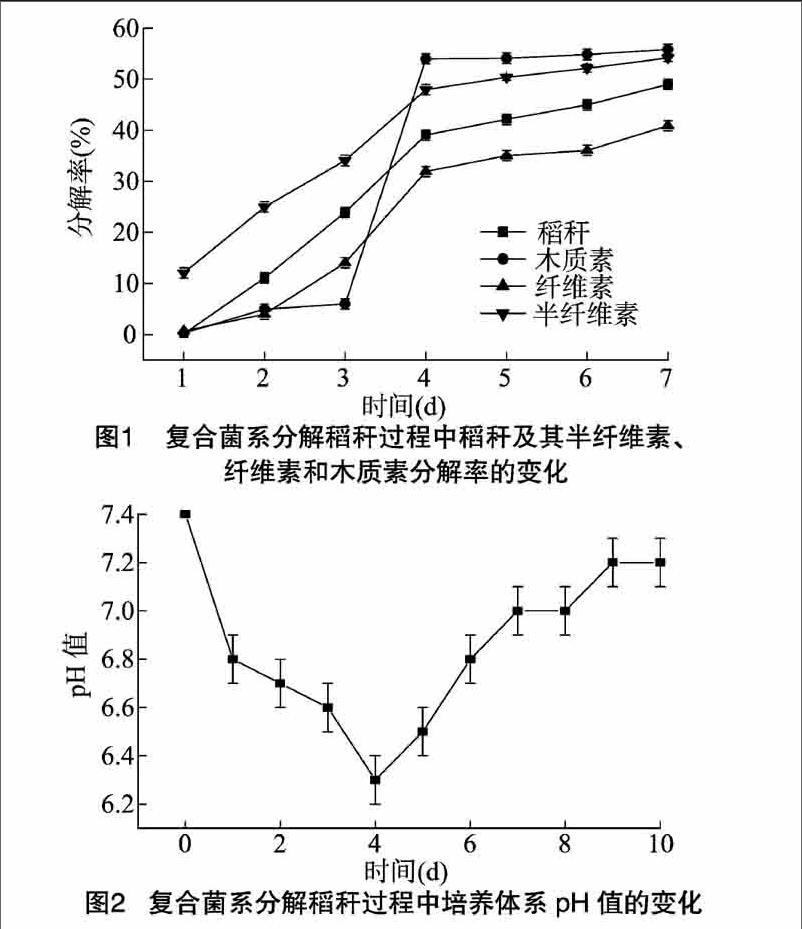
稻稈和稻稈中木質素、纖維素、半纖維素的分解率的變化結果如圖1所示。在培養的前4 d秸稈被旺盛分解,4 d后分解能力減弱基本不再分解。在培養4 d時分解率達到最高值,稻稈和稻稈中木質素、纖維素、半纖維素的分解率分別為392%、540%、317%、480%。稻稈經過復合菌系處理7 d后,稻稈和稻稈中木質素、纖維素、半纖維素的分解率分別為490%、555%、407%、536%。
22復合菌系培養體系pH值的動態變化
221復合菌系分解稻稈過程中培養體系pH值的變化
由圖2可知,在培養的前4 d,培養基的pH值呈下降趨勢,到培養4 d時,pH值降到最低,從起始的74降到63。從培養5 d開始,培養基的pH值開始回升,到培養7 d時,培養基的pH值回升到70左右,并保持相對穩定狀態,一直到培養 10 d,培養基的pH值保持在72左右,與培養基的起始pH值相差不大。
222不同的起始pH值條件下復合菌系培養基pH值的變化
由表1可知,當培養基的初始pH值為4時,接種復合菌系1 d后培養基的pH值上升至61,直至接種7 d時,培養基的pH值一直保持在61左右。當培養基的初始pH值為5和6時,接種復合菌系1 d后培養基的pH值分別上升至62和65,分別在培養5、4 d時pH值達到最低值,但是到培養 6 d 時培養基的pH值回升到61并保持相對穩定。當培養基的初始pH值為7和8時,接種復合菌系1 d后培養基的pH值明顯下降,到培養4 d時培養基的pH值達到最低值,分別為62、63,到接種后6 d,培養基的pH值回升到70左右并保持相對穩定狀態。當培養基的初始pH值為9和10時,接種復合菌系1 d后培養基的pH值呈現明顯下降,且一直維持這一下降趨勢,到接種后7 d時,培養基的pH值分別達到63、60左右。
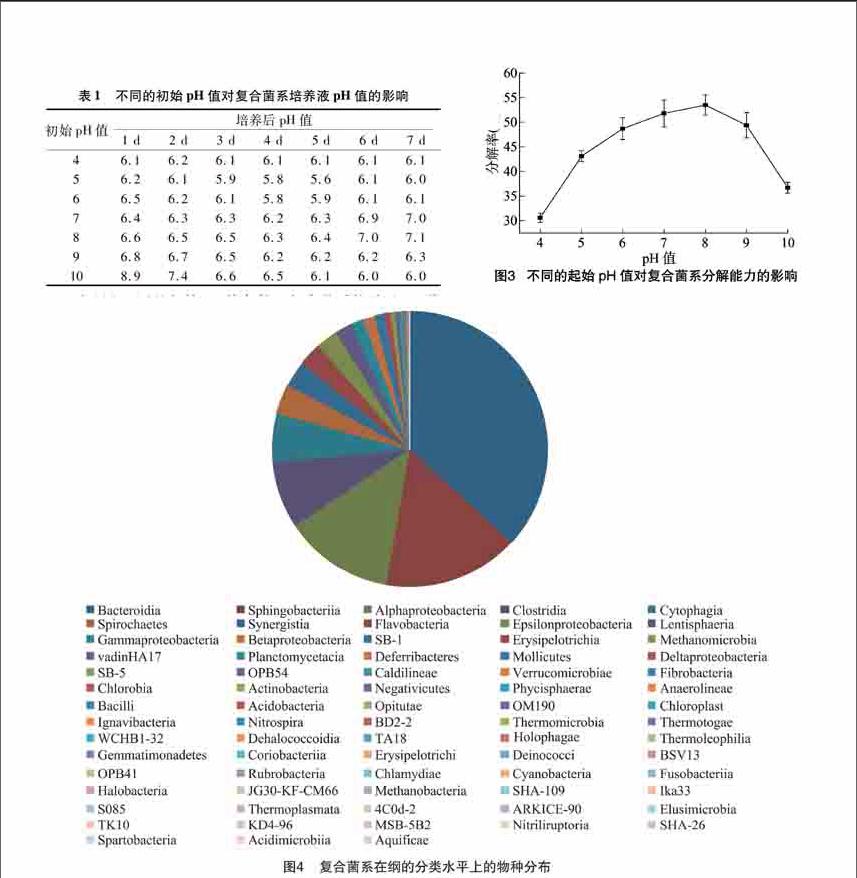
在研究不同的起始pH值條件下復合菌系培養基pH值變化的同時,對不同的起始pH值條件下稻稈的分解率進行了試驗。由圖3可知,當pH值在40~100范圍內時,稻稈都會發生分解,但是復合菌系對稻稈的分解程度各不相同。當pH值為80時,稻稈的分解率最高,可達到535%;其次是[CM(25]當pH值為70時,稻稈的分解率為518%;當pH值為4和100時,稻稈的分解率則明顯下降。
綜合以上結果可知,在培養基的起始pH值為4~10時,復合菌系的pH值隨著稻稈的分解而自動調節,最終的pH值都保持在6~7之間,接近中性。在木質纖維素分解的旺盛時期,培養基的pH值均可降到最低值。當木質纖維素分解完成后,培養基的pH值均可自動回升。當培養基的初始pH值為4~10時,稻稈呈現不同的分解狀態,分解率各不相同,而適宜復合菌系分解稻稈的初始pH值接近中性,培養基過酸過堿都不適宜復合菌系分解稻稈。
23復合菌系的細菌組成多樣性
對復合菌系進行16s rDNA擴增子高通量測序,將復合菌系在微生物的綱、目、科3個分類水平給出分類。復合菌系在微生物分類單元綱的水平上的物種相對豐度統計結果如圖4所示。
復合菌系的細菌組成在綱的水平上包含73個綱的細菌,其物種相對豐度高于100%的可分類菌綱共有13個,包括擬桿菌綱(Bacteroidia)、鞘脂桿菌綱(Sphingobacteriia)、α-變形菌綱(Alphaproteobacteria)、梭菌綱(Clostridia)、纖維黏網菌綱(Cytophagia)、螺旋體綱(Spirochaetes)、互養菌綱(Synergistia)、黃桿菌綱(Flavobacteria)、ε-變形菌綱(Epsilonproteobacteria)、黏膠球形菌綱(Lentisphaeria)、γ-變形菌綱(Gammaproteobacteria)、β-變形菌綱(Betaproteobacteria)和未培養細菌,其物種相對豐度分別為3675%、1600%、1284%、789%、581%、344%、307%、277%、253%、195%、148%、141%、107%。
復合菌系在微生物分類單元目的水平上的物種相對豐度統計結果如圖5所示。
復合菌系的細菌組成在目的水平上包含132個目的細菌,其物種相對豐度高于100%的可分類菌目共有9個,包括擬桿菌目(Bacteroidales)、鞘脂桿菌目(Sphingobacteriales)、柄桿菌目(Caulobacterales)、梭菌目(Clostridiales)、嗜纖維菌目(Cytophagales)、螺旋體目(Spirochaetales)、Synergistales、黃桿菌目(Flavobacteriales)、彎曲菌目(Campylobacterales),其物種相對豐度分別為3816%、1661%、1197%、818%、602%、357%、319%、287%、263%。
復合菌系在微生物分類單元科的水平上的物種相對豐度統計結果如圖6所示。
對復合菌系進行高通量測序后發現細菌的組成在科的水平上比較豐富。復合菌系的細菌組成在科的水平上包含226個科的細菌,其物種相對豐度高于100%的可分類菌科共有14個,包括紫單胞菌科(Porphyromonadaceae)、柄桿菌科(Caulobacteraceae)、理研菌科(Rikenellaceae)、海滑菌科(Marinilabiaceae)、嗜纖維菌科(Cytophagaceae)、瘤胃菌科(Ruminococcaceae)、互養菌科(Synergistaceae)、彎曲菌科(Campylobacteraceae)、螺旋體科(Spirochaetaceae)、黃桿菌科(Flavobacteriaceae)、Christensenellaceae和3個未培養的細菌,其物種相對豐度分別為1873%、1203%、1196%、733%、603%、371%、323%、266%、258%、219%、123%,3個未培養的細菌相對豐度共占了1628%。復合菌系中相對豐度低于1%的可分類菌科共有212個,由于這些細菌在復合菌系中的相對豐度極小,共占復合菌系的1205%。
3討論
利用限制性培養技術從產沼氣旺盛的沼液中篩選具有分解木質纖維素分解能力的復合菌系BYND-8,用稻稈的分解率作為指標,培養7 d后,稻稈及稻稈中木質素、纖維素和半纖[CM(25]維素的分解率分別為490%、555%、407%、536%。雖[CM)]
然與已報道的復合菌系相比其木質纖維素能力相對較低[2,4,7,11,14],但BYND-8與它們的篩選樣品來源不同,是從沼氣發酵體系中篩選得到,沼氣發酵體系是厭氧環境,在此也證明不同的培養條件對于纖維素分解能力影響較大。該復合菌系可能應用于將來的以稻稈為原料的沼氣發酵的預處理。
通過復合菌系在分解稻稈過程中pH值變化趨勢、調節培養基的不同起始pH值復合菌系對稻稈的分解率來看,復合菌系可以自我調節培養環境的pH值,這充分體現了該復合菌系較純培養菌株分解木質纖維素的優勢所在。崔宗均等構建的木質纖維素分解復合菌系的pH值隨著培養時間先下降后升高最后趨于穩定并與初始pH值較一致[4,17],這與本研究的結果相吻合。復合菌系培養體系的pH值對于木質纖維素的分解具有明顯的影響。
不同菌株協同作用可高效穩定地分解木質纖維素,宋亞彬曾通過傳統的平板分離法和變性梯度凝膠電泳法分析了復合菌系的菌種組成多樣性,她發現復合菌系的微生物組成主要分為腸桿菌科(Enterobacteriaceae)、產堿桿菌科(Alcaligenaceae)、黃單胞菌科(Xanthomonadaceae)、芽孢桿菌科(Bacillaceae)和一個未知的菌科[18]。但是通過對復合菌系進行16S rDNA擴增子高通量測序,分析復合菌系的細菌組成及多樣性,發現高通量測序技術與傳統的分子生物學手段相比,更加全面、準確,它將復合菌系在科的分類水平上分成226個科的細菌,遠遠高于傳統的多樣性分析方法。而且通過高通量測序分析可知,腸桿菌科、產堿桿菌科、黃單胞菌科、芽孢桿菌科的相對豐度分別為011%、086%、006%、0008%,遠低于高通量測序得到的優勢菌株。說明傳統的分析方法存在一定的局限性,不能表征復合菌系涵蓋的全部微生物。而高通量測序可以揭示不同種類的細菌在木質纖維素分解過程中的功能,分析不同菌種之間存在的協同關系。通過對復合菌系進行高通量測序,可以得到復合菌系中相對量較高的占優勢的菌株,進而可以揭示分解木質纖維素的功能菌。紫單胞菌科屬于擬桿菌門,適宜在中溫厭氧條件下生長,能發酵多種單糖和二糖,產生有機酸,如丙酸、乙酸和少量丁酸等[19],曾在石油烴污染土壤及肥育豬后腸分離得到,參與了烴類的厭氧降解及纖維降解[20-21]。蘇增建等從石油污染土壤樣品中得到以石油烴為唯一生長碳源的細菌菌株,研究了其石油降解能力,結果表明柄桿菌具有一定的石油降解能力[22],推測柄桿菌在復合菌系中起到分解木質纖維素中長鏈烷烴的作用。高鳳芹對馴化后的瘤胃液和傳統的沼液進行高通量測序分析,結果表明瘤胃液的細菌主要分布在瘤胃球菌科、理研菌科等,而沼液中含量大于8%的細菌群落只有理研菌科和瘤胃球菌科,發揮了高效降解纖維素和甲烷生成的功能[23]。而本研究復合菌系正是從產沼氣旺盛的沼液中富集篩選得到,理研菌科與瘤胃菌科同樣起到分解木質纖維素的作用。瘤胃菌科適合厭氧生長,部分細菌可氫化不飽和脂肪酸,有的能分解芳香族化合物、肉桂酸和巴豆酸酯[24]。嗜纖維菌科能溶解植物纖維及水解纖維素[25]。黃桿菌科專性需氧。螺旋體科也具有專一性降解半纖維素的作用[26]。互養菌科的細菌屬于厭氧發酵菌,可以利用有機酸發酵產生乙酸,利于菌系的對烴的降解[27]。在對復合菌系中優勢菌株的分析后發現,分解木質纖維素的細菌在分解木質纖維素時,產生了大量的有機酸,由于有機酸的積累導致復合菌系在分解木質纖維素旺盛時期pH值降到最低。在這些優勢菌中既有好氧細菌又有厭氧細菌,而起木質纖維素分解作用的主要都是厭氧細菌,好氧細菌的存在是將整個體系創造成無氧環境,進而厭氧纖維素分解細菌發揮作用。正是由于復合菌系具有較高的微生物組成多樣性,才使得復合菌系具有較高的分解木質纖維素的能力。
4結論
木質纖維素分解復合菌系BYND-8具有高效穩定的分解能力,初始培養基接近中性時其分解效果最好。復合菌系BYND-8中細菌在科的分類水平上相對量較高,占優勢的細菌為紫單胞菌科(Porphyromonadaceae)、柄桿菌科(Caulobacteraceae)和理研菌科(Rikenellaceae),主要參與木質纖維素的分解。本研究為進一步研究復合菌系協同分解木質纖維素的機理奠定理論基礎。
參考文獻:
Jnsson L J,Martin C Pretreatment of lignocellulose:formation of inhibitory by-products and strategies for minimizing their effects[J] Bioresource Technology,2016,199:103-112
溫博婷,袁旭峰,華彬彬,等 纖維素分解菌系WSD-5常溫產酶高溫糖化小麥秸稈研究[J] 中國農業大學學報,2014,19(2):36-42
[3]Venkatesh C,Pradeep V An overview of key pretreatment processes employed for bioconversion of lignocellulosic biomass into biofuels and value added products[J] Biotech,2013,3(5):415-431
[4]崔宗均,李美丹,樸哲,等 一組高效穩定纖維素分解菌復合系MC1的篩選及功能[J] 環境科學,2002,23(3):36-39
[5]Guo P,Wang X F,Zhu W B,et al Degradation of corn stalk by the composite microbial system of MC1[J] Journal of Environmental Sciences,2008,20(1):109-114
[6]趙聽,張凱煜,谷潔,等 復合菌群FWD1的木質纖維素降解特性及其微生物多樣性研究[J] 農業環境科學學報,2015,34(8):1582-1588
[7]劉長莉 木質纖維素分解復合菌群NSC-7菌種組成及種間協作機理[D] 哈爾濱:東北林業大學,2008
[8]張曉倫,劉旭,饒澤昌 高效纖維素分解菌混合培養及其降解能力[J] 南昌大學學報:理科版,2005,29(5):500-502
[9]陳耀寧,曾光明,喻曼,等 與黃孢原毛平革菌協同降解稻草的混合菌篩選[J] 中國環境科學,2007,27(2):189-193
[10]溫雪,付博銳,王彥杰,等 纖維素分解復合菌系WSC-9中厭氧細菌的分離[J] 東北農業大學學報,2013,44(2):47-52
[11]Kato S,Haruta S,Cui Z J,et al Stable coexistence of five bacterial strains as a cellulose degrading community[J] Applied and Environmental Microbiology,2005,71(11):7099-7106
[12]Yan L,Gao Y M,Wang Y J,et al Diversity of a mesophilic lignocellulolytic microbial consortium which is useful for enhancement of biogas production[J] Bioresource Technology,2012,111(5):49-54
[13]Wang W D,Yan L,Cui Z J,et al Characterization of a microbial consortium capable of degrading lignocellulose[J] Bioresource Technology,2011,102(19):9321-9324
[14]王偉東,崔宗均,牛俊玲,等 一組木質纖維素分解菌復合系的篩選及培養條件對分解活性的影響[J] 中國農業大學學報,2004,9(5):7-11,44
[15]何江,毛忠貴,張慶華,等 高效木薯渣分解復合菌群RXS的構建及其發酵特性研究[J] 環境科學,2012,33(3):1020-1027
[16]Zhu H,Qu F,Zhu L H Isolation of genomic DNAs from plants,fungi and bacteria using benzyl chloride[J] Nucleic Acids Research,1993,21(22):5279-5280
[17]王偉東,王小芬,劉長莉,等 木質纖維素分解菌復合系WSC-6分解稻稈過程中的產物及pH動態[J] 環境科學,2008,29(1):219-224
[18]宋亞彬 中溫木質纖維素降解復合菌系及其對沼氣產量的影響[D] 大慶:黑龍江八一農墾大學,2009
[19]王學華,黃俊,宋吟玲,等 高效水解酸化UASB活性污泥的菌群結構分析[J] 環境科學學報,2014,34(11):2779-2784
[20]張文靜 烴類厭氧降解過程中互營細菌的分布特征和系統發育研究[D] 北京:中國農業科學院,2011
[21]馮平 肥育豬對不同類型纖維消化適應性及其后腸發酵與微生物菌群變化研究[D] 北京:中國農業科學院,2013
[22]蘇增建,李敏,鄺春蘭 熱帶地區石油污染土壤中降解菌的篩選[J] 安全與環境學報,2008,8(1):86-88
[23]高鳳芹 柳枝稷發酵產甲烷過程中纖維素降解機制及微生物多樣性變化[D] 北京:中國農業大學,2015
[24]王繼文,王立志,閆天海,等 山羊瘤胃與糞便微生物多樣性[J] 動物營養學報,2015,27(8):2559-2571
[25]布坎南,吉本斯 伯杰細菌鑒定手冊[M] 8版北京:科學出版社,1984:116-117
[26]張翔飛 活性干酵母對肉牛瘤胃發酵、纖維降解及微生物菌群的影響[D] 雅安:四川農業大學,2014
[27]周蕾 厭氧烴降解產甲垸菌系的組成及其代謝產物的特征[D] 上海:華東理工大學,2012

