偏腫革裥菌錳過氧化物酶的分級純化*
張玉龍 池玉杰 馮連榮,2
(1. 東北林業大學林學院 哈爾濱 150040; 2. 遼寧省楊樹研究所 蓋州 115213)
偏腫革裥菌錳過氧化物酶的分級純化*
張玉龍1池玉杰1馮連榮1,2
(1. 東北林業大學林學院 哈爾濱 150040; 2. 遼寧省楊樹研究所 蓋州 115213)
【目的】 研究白腐菌偏腫革裥菌(Lenzitesgibbosa)錳過氧化物酶(MnP)的分級純化,以期得到L.gibbosaMnP的純品和進行后續酶學性質研究。【方法】 在對L.gibbosa所產MnPs進行優化培養、獲得大量MnPs粗酶液的基礎上,通過硫酸銨(NH4)2SO4分級鹽析、聚乙二醇(PEG)沉淀進行粗酶液濃縮、在起始緩沖液中進行透析、經DEAE-瓊脂糖 CL-6B離子交換柱層析進行梯度洗脫和葡聚糖G-75凝膠過濾柱層析等方法對MnPs粗酶液進行純化,并對分級純化方法進行優化,對純化濃縮后的純酶樣品采用SDS-PAGE方法進行酶純度檢驗。【結果】 在75%、80%和85%這3種(NH4)2SO4飽和度中,85%的(NH4)2SO4是沉淀MnPs的適宜飽和度,在該飽和度下測得上清液中酶活為3.63 U·L-1,蛋白濃度為0.132 mg·mL-1,表明MnPs已基本沉淀完全; 試管小試法確定離子交換柱層析中上樣的最適緩沖體系為pH7的Na2HPO4-NaH2PO4起始緩沖液; 離子交換柱層析后收集的洗脫液檢測到3個蛋白吸收峰,其中只在第2個蛋白吸收峰中檢測出MnP活性,該MnP活性值變化曲線與蛋白吸光值一致。這個活性峰經凝膠過濾柱層析后,洗脫結果只出現1個明顯的蛋白吸收峰,在其中檢測出較高的MnP活性; 濃縮后的凍干樣品經SDS-PAGE電泳檢測只在約40 kDa處有1條清晰的蛋白譜帶,表明對MnP的純化已達到電泳純。【結論】 篩選出85%飽和度的(NH4)2SO4鹽析法是初期沉淀與純化L.gibbosa所產MnPs的最適方法; PEG濃縮法簡便、易行、有效; 初期濃縮后再經過離子交換柱層析和凝膠過濾柱層析可以得到電泳純的MnP純化樣品。
偏腫革裥菌; 錳過氧化物酶; 純化; 離子交換柱層析; 電泳純
Abstract: 【Objective】 This study aims to obtain pure manganese peroxidase produced by white-rot basidiomyceteLenzitesgibbosastrain CB-1 and study its characterizations in enzymology. 【Method】 On the basis of optimizing the culture ofL.gibbosaand obtaining massive crude manganese peroxidases (MnPs) solutions which were salted out by (NH4)2SO4, concentrated by polyethylene glycol (PEG) precipitation, and dialyzed against the initial buffer. The DEAE-Sepharose CL-6B ion exchange column chromatography, and Sephadex G-75 gel filtration column chromatography were used to purify MnP, and the purity of the purified MnP sample was detected by SDS-PAGE. 【Result】Among the three (NH4)2SO4concentrations of 75%, 80%, and 85%, 85% (NH4)2SO4was the optimum saturation for precipitation of MnPs. With 85% (NH4)2SO4precipitation, the MnP activity and protein concentration in the supernatant were only 3.63 U·L-1and 0.132 mg·mL-1, respectively, indicating that most MnPs had been precipitated. The initial buffer of Na2HPO4-NaH2PO4(pH=7) was fixed to be the optimal buffer system by small test tube method. Two higher and one lower protein absorption peaks were detected in the samples after ion exchange column chromatography, and the MnP activity was detected only in the second higher peak. After the second higher peak sample went through Sephadex G-75 gel filtration column and was eluted, one distinct protein absorption peak was detected in which there was a high MnP activity. A single and distinct MnP protein band around 40 kDa in concentrated lyophilized sample was detected by SDS-PAGE, indicating that the purity of purified MnP had come up to the electrophoresis pure. 【Conclusion】 The salting out method with 85% (NH4)2SO4was the optimal method for precipitating and purifying MnPs produced byL.gibbosain initial stage. PEG concentration method was proved simple, easy and effective. The purified MnP samples could be come up to the electrophoresis pure by the means of ion exchange chromatography and gel filtration chromatography after initial concentration.
Keywords:Lenzitesgibbosa; manganese peroxidases(MnPs); purification; ion exchange chromatography; electrophoresis pure
白腐菌分泌的錳過氧化物酶(MnPs)和漆酶能夠降解木質素、多環芳烴、多氯聯苯等含有芳香環的化合物和高聚物,在木質素天然聚合物的再利用及治理由農藥、染料、軍火、石油和煤殘渣造成的環境污染方面有較好的應用前景(Novotnyetal., 1999; Tsutsumietal., 2001)。近年來國內外很多研究者進行了白腐菌的酶學研究,既包括產酶條件(Gilletal., 2003; Lankinenetal., 2005),也包括木質素降解酶的分離、純化、特性和作用機制方面的研究(謝慧芳等, 2003; 程曉濱, 2007)。MnPs能氧化木質素的酚和非酚結構,是一種高效的木質素降解酶,其商品化應用具有很大的市場潛力,而酶制劑生產需要獲得純度較高的酶。目前已分離純化到一些白腐菌的MnPs,如黃孢原毛平革菌(Phanerochaetechrysosporium)(Minoetal., 1988; Sundaramoorthyetal., 1994)、云芝栓菌(Trametesversicolor)(張連慧等, 2005)、乳白耙齒菌(Irpexlacteus)(Baborováetal., 2006)等。白腐菌偏腫革裥菌(Lenzitesgibbosa)能夠產生漆酶和MnPs,是一種對木材和木質素降解能力較強的白腐菌,本實驗室前期對其產MnPs的發酵條件進行優化并得到了大量的酶(張玉龍等, 2011),在實驗室條件下對MnPs進行了分離純化,可為進一步研究酶的催化特性及作用機制提供參考。本研究以期摸索如何提高酶的純度,為實現純酶在工業上的大規模實際應用酶的商品化生產奠定基礎。
1 材料與方法
1.1菌種來源及活化、MnPs產酶培養與粗酶液的收集制備
L.gibbosa由東北林業大學林學院森林保護學科森林病蟲病理實驗室提供,試驗前挑取冷藏于4 ℃冰箱試管內的菌種,接種于PDA平板培養基上,于28 ℃下進行活化培養7天。
優化后的產酶培養基(L-1)與培養條件: KH2PO40.2 g,MgSO4·7H2O 0.35 g,琥珀酸1.18 g,CaCl2·2H2O 0.1 g,果糖5 g,酒石酸銨15 mmol,Mn2+200 μmol,礦質元素溶液(不含Mn2+)10 mL,維生素溶液1.0 mL,Tween-80 0.25 mL,用4 mol·L-1NaOH調節pH至4.5,250 mL三角瓶中裝液量為110 mL,用Ф=8 mm的打孔器打取在PDA平板培養基上生長的菌落邊緣,將菌餅轉接至滅菌后的三角瓶中,每個三角瓶加入5塊菌餅,于27 ℃、150 r·min-1搖瓶,進行發酵產酶擴大培養。
粗酶液的收集: 在培養到15天達到產酶高峰時,將足夠多的培養液收集在一起,用潔凈紗布過濾,取濾液再用定性濾紙過濾即得到粗酶液,檢測MnPs活性和蛋白濃度后用于純化。
1.2MnPs活性檢測、樣品蛋白含量的測定與酶比活力的計算
用紫外分光光度計在470 nm處檢測2,6-二甲氧基苯酚(2,6-DMP)在1 min氧化過程中吸光度的變化值,測定體系1 mL,其中pH4.5的丙二酸鈉緩沖液(50 mmol·L-1)840 μL,MnSO4(10 mmol·L-1)50 μL,2,6-DMP(10 mmol·L-1)50 μL,酶液樣品50 μL,H2O2(10 mmol·L-1)10 μL,反應起始于10 mmol H2O2的加入,以1 mL去離子水作為對照,酶活單位(U·L-1): 每分鐘催化1 μmol 2,6-DMP所需的酶量。酶活性值=[106×V1×ΔA×N]/[V2×ε×Δt],式中:V1為反應總體積;V2為酶液的體積;N為酶液稀釋倍數;ε為摩爾消光系數,ε470=49 600 mol·L-1cm-1; Δt為反應時間; ΔA為反應時間內吸光度的增量值。
在粗酶液濃縮過程中采用Bradford(1976)的考馬斯亮蘭法測定總蛋白含量,以牛血清白蛋白(BSA)為標準繪制標準直線,共測定5個樣品,每個樣品3次重復,以1.00 mL水溶液加入5.00 mL的考馬斯亮蘭工作液作為對照,得到標準直線方程。將未知樣品液進行適當稀釋,并記錄稀釋倍數。取1.00 mL稀釋液放入試管中,加入5.00 mL考馬斯亮藍工作液,在分光光度計上測出在595 nm處的吸光值A595,帶入標準直線方程,得出蛋白濃度。在柱層析洗脫液的快速連續檢測時,采用紫外吸收法檢測A280以獲得蛋白含量變化的相對值。
樣品中MnPs的總酶活力值(U)與總蛋白含量(mg)的比值即為酶的比活力。
1.3粗酶液濃縮與MnPs的純化
通過硫酸銨鹽析、透析、PEG濃縮、離子交換柱層析和凝膠過濾柱層析進行MnP的純化。
1.3.1 粗酶液初期沉淀方法 用2種方法摸索粗酶液初期沉淀的最適方法后又進行了驗證試驗。1) 聚乙二醇(PEG)沉淀法 將105.6 mL 500 g·L-1的PEG 6000加入到收集的88 mL粗酶液中,緩慢攪拌60 min,至沉淀完全。然后在5 000g下離心30 min,收集上清液測定MnP酶活。
2) 硫酸銨逐級鹽析法 按照4 ℃飽和度表(陸健等, 2005),準確稱取與等濃度對應的研磨后的(NH4)2SO4粉末125、9.0和9.25g,將裝有250 mL粗酶液的燒杯放在冰盒內,向杯內緩慢加入第1份(NH4)2SO4粉末,同時攪拌,使粗酶液中(NH4)2SO4飽和度達到75%。將此溶液分別裝入50 mL潔凈的離心管中,在12 000g下冷凍離心20 min,收集上清液測定MnP酶活后留作下一級沉淀用,依次使飽和度達到80%、85%。硫酸銨分級鹽析分析在各個飽和度時上清液酶活和沉淀溶解液的酶活和蛋白含量。當上清液酶活變得非常小、沉淀溶解量以及沉淀溶解液的蛋白含量和酶活不再增加時,此時的(NH4)2SO4飽和度為鹽析MnPs的最佳飽和度,該飽和度下透析濃縮后的樣品液用于離子交換柱層析。
3) 85%飽和度的硫酸銨沉淀驗證試驗 用200 mL粗酶液進行沉淀效果的進一步驗證。
1.3.2 透析與濃縮 將上述方法離心后的沉淀用盡可能少量的離子交換柱層析起始緩沖液(約2 mL)溶解后,測定沉淀溶解液中蛋白含量及MnP酶活并進行透析。透析過程在冰上進行,是將沉淀溶解液置于截留分子質量為8 000~14 000 Da的透析袋內,再浸入裝有緩沖液的大燒杯內透析過夜,期間更換數次緩沖液并用磁力攪拌器攪拌,以除去其中的小分子鹽類,并使蛋白溶解液在pH和離子強度上與離子交換柱層析的起始緩沖系統相一致。透析后在透析袋外面涂布PEG粉末濃縮到需要的體積(蘇東海等, 2008),測定其中的蛋白含量和MnPs酶活后,用于離子交換柱層析。
1.3.3 試管小試法確定起始緩沖液和pH 根據本課題組已經克隆到的L.gibbosaMnP基因,得知3個成熟MnPs都有略大于4的酸性等電點,進一步通過試管小試法確定起始緩沖液及pH。取9支15 mL試管,每管加入1.5 mL瓊脂糖離子交換劑; 配制9種濃度為0.5 mol·L-1和0.02 mol·L-1pH5.0~9.0的緩沖液(表1)。各取10 mL 0.5mol·L-1不同pH的緩沖液,加入9支試管中以平衡交換劑,混合一段時間后棄去上清液,再分別加入10 mL新鮮緩沖液,反復10次后可以使試管內的交換劑在pH上完全與緩沖液達到平衡; 再用10 mL 0.02 mol·L-1同一pH的緩沖液洗滌各試管中的交換劑,反復5次可確保試管內的交換劑在離子強度方面與起始緩沖液保持一致; 各試管中加入相同數量的(NH4)2SO4沉淀透析后酶活為104.23 U·L-1的樣品液,混合放置5~10 min。使離子交換劑沉降,檢測上清液中MnPs酶活,如果酶活接近于0說明MnPs完全被離子交換劑所吸附,沉降于底部; 若上清液中有少量酶活說明MnPs沒有完全被交換劑吸附,上清液中存在少量MnPs。選擇酶活接近于0和少量酶活之間的特定pH緩沖液作為起始緩沖液。
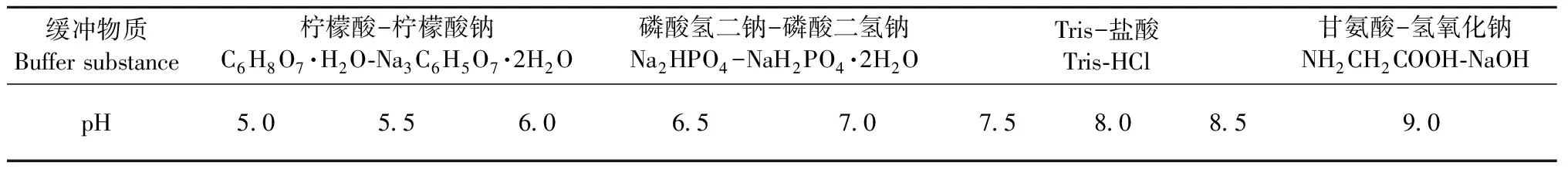
表1 試管小試法9種pH緩沖溶液Tab.1 Nine kinds of pH buffers in small test tube method
1.3.4 DEAE-Sepharose CL-6B離子交換柱層析 采用2.6 cm×20 cm的玻璃層析柱,用起始緩沖液清洗平衡整個系統并排除空氣。按離子交換劑DEAE-瓊脂糖凝膠 CL-6B濕膠∶起始緩沖液=3∶1的體積比攪勻后,用起始緩沖液調節pH到7,裝柱12.5 cm,用至少2倍色譜柱體積的起始緩沖液平衡過夜,用槍小心將樣品加到床面上,采用2種離子強度的洗脫緩沖液進行梯度洗脫,梯度混合器離出口近的容器放置的是離子強度為0.02 mol·L-1起始緩沖液,另一個放置的是1.5 mol·L-1NaCl極限緩沖液(87.75 g NaCl加入到1 000 mL起始緩沖液中)。2.5 mL·min-1流速洗脫至基線,在此期間離子強度從0.02~1.5 mol·L-1之間呈“S”形緩慢上升,自動收集器收集每管5 mL。測定各試管中的蛋白含量和MnPs酶活,合并相同的洗脫峰后,PEG濃縮同1.3.2,測定其中蛋白含量和MnPs酶活后,用于凝膠過濾柱層析。
1.3.5 Sephadex G-75凝膠過濾柱層析 采用1.6 cm×50 cm的玻璃層析柱,用0.07 mol·L-1NaCl洗脫液清洗平衡整個系統后灌膠,裝柱高為29 cm。用移液槍吸取樣品貼柱內壁旋轉緩慢加入小于3.75 mL樣品液,用洗脫液洗脫,54 s·mL-1流速洗脫至基線,自動收集器收集每管3 mL。檢測各試管中的蛋白含量和MnPs酶活后合并相同的洗脫峰,PEG濃縮同1.3.2,測定其蛋白含量和酶活。此樣品用液氮速凍后,用TFD5505型冷凍干燥機將樣品凍干,之后的固體用極少量去離子水溶解,振蕩均勻,在12 000 r·min-1下離心10 min得上清液,至此得到蛋白純化樣品,測定其蛋白含量和MnP酶活。
1.4SDS-PAGE電泳檢測蛋白純度
對1.3.5中得到的蛋白純化樣品,采用SDS-PAGE凝膠電泳法,以蛋白質Marker作為對照,檢測L.gibbosaMnP的純度。
2 結果與分析
2.1粗酶液初期沉淀的最適方法
PEG沉淀、硫酸銨逐級鹽析和85%硫酸銨沉淀驗證的結果見表2,其中回收率和純化倍數分別為沉淀或透析后的總酶活力和比活力與粗酶液總酶活力和比活力的比值。酶比活力是酶純度的量度,對于一種酶來說,其比活力越大純度越高。雖然在PEG沉淀中酶的比活力很高,但酶的回收率過低,僅為15.3%,而用3種濃度的硫酸銨沉淀回收率都在43%以上。在硫酸銨逐級鹽析中,用75%的(NH4)2SO4沉淀后,溶液呈乳黃色,渾濁,有細小泡沫浮在液面上,但仍不黏稠,表明仍有蛋白沒有被沉淀下來; 取其離心后的上清液,繼續向其中加入(NH4)2SO4粉末使飽和度達到80%時,溶液清亮; 繼續經85%(NH4)2SO4沉淀后的上清液酶活僅為3.63 U·L-1,蛋白濃度為0.1 318 mg·mL-1,MnPs比活力僅為0.03,表明溶液內雖然還有較多的雜蛋白存在,但目的蛋白MnPs已基本沉淀完全,因此選擇85%的濃度作為(NH4)2SO4沉淀MnPs的最適濃度。85%飽和度的(NH4)2SO4沉淀驗證試驗表明其回收率高達69.7%,作為分離純化初期的步驟,應盡量使蛋白損失少而回收率高,因此選擇85%飽和度的(NH4)2SO4作為初期沉淀MnPs的最適方法。
2.2起始緩沖液和pH篩選
以加入離子交換劑內的樣品液酶活104.23 U·L-1為對照,不同試管內各緩沖液的pH與離子交換劑沉降后上清液中相對酶活的對比情況見圖1,由于離子交換劑在緩沖液pH9的環境中無法沉淀,大部分懸浮于液體上部,并有泡沫出現,故去掉不計。由圖1可知,經不同pH緩沖液平衡后的離子交換劑對MnP的吸附程度有明顯差異。上清液中MnPs活力越高,表明該pH條件下離子交換劑對目的蛋白的吸附能力越弱; 反之酶活越低,則吸附能力越強。pH在6.5~8.5之間時離子交換劑對目的蛋白的吸附能力都較強,以pH 8時最高。考慮到使目的蛋白的靜電荷量既可保證其結合在離子交換劑上,又不需在洗脫時洗脫液的離子強度很大或與原溶液pH相差懸殊等苛刻條件,本試驗選擇pH 7、離子強度為0.02 mol·L-1的Na2HPO4-NaH2PO4緩沖液作為離子交換層析的上樣緩沖體系。
2.3離子交換柱層析洗脫峰蛋白含量和酶活檢測
離子交換柱層析洗脫峰蛋白含量和酶活的檢測結果見圖2。為形成前面2個高的和后面1個低的蛋白吸收峰,重點檢測這3個蛋白峰附近試管中的MnPs活性,結果在第2個蛋白吸收峰試管中檢測到MnP活性并與蛋白吸光值大小相一致,收集其中32~42號試管中的流出洗脫液合并再濃縮,測得總蛋白含量為3.53 mg,總酶活力為68.37 U,MnPs比活力高達19.37,表明MnPs的純度已經較高(表3)。DEAE-Sepharose CL-6B陰離子交換劑的電荷基團二乙基氨乙基帶正電,裝柱平衡后,與緩沖溶液中帶負電的平衡離子PO43-結合。加樣后采用改變離子強度的梯度洗脫方式,直接由緩沖物質提供離子強度,不額外往緩沖液中添加非緩沖鹽,緩沖物質的濃度決定了離子強度,目的蛋白MnPs在低離子強度下被吸附,在高離子強度下被洗脫。樣品液中可能還含有其他正電、負電和中性基團,負電基團可以與平衡離子PO43-進行可逆的置換反應而結合到離子交換劑上,而正電和中性基團則不能與離子交換劑結合,隨流動相首先流出而先被去除。洗脫緩沖液的pH 7大于MnPs的等電點,目的蛋白MnPs分子羧基游離帶負電,在低離子強度下能夠很好地吸附于離子交換劑上,而其他一些等電點大于7的雜蛋白因為帶有正電荷不能形成有效吸附,所以會首先被洗脫下來。隨著洗脫液離子強度增加,洗脫液中的Cl-離子可以逐步與結合在離子交換劑上的各種負電基團進行交換,而將包括目的蛋白MnPs在內的各種負電基團置換出來,隨洗脫液流出。與離子交換劑結合力小的負電基團先被置換出來,而與離子交換劑結合力強的稍后被置換出來,這樣等電點介于4~7之間的各種蛋白和負電基團就會按其與離子交換劑結合力從小到大的順序逐步被洗脫下來,從而達到分離目的。另一些等電點小于MnPs的雜蛋白吸附得比較牢固,在高離子強度下在MnPs之后被洗脫下來。
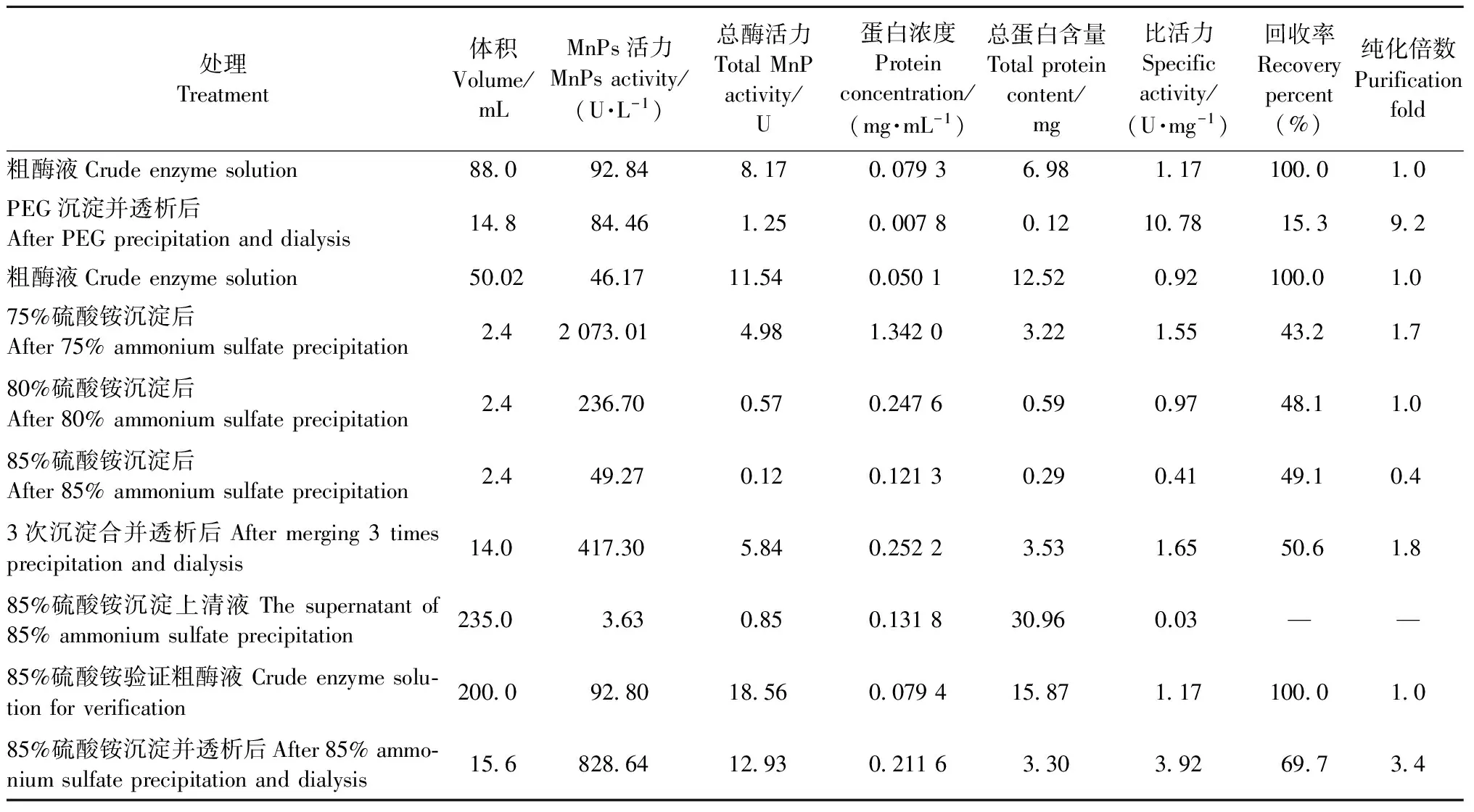
表2 不同處理方法粗酶液初期沉淀Tab.2 The results of different initial precipitation methods to crude MnPs solutions
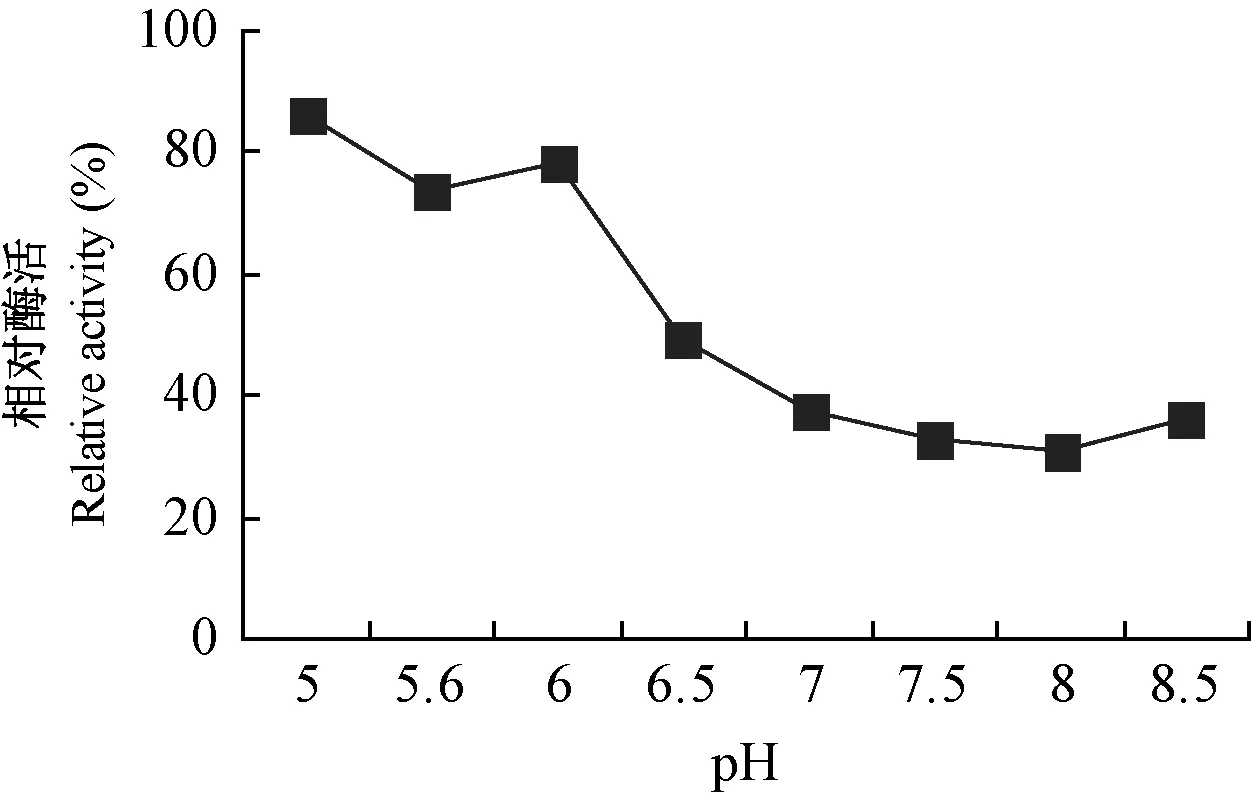
圖1 試管小試法篩選起始緩沖液和pHFig.1 The initial buffer and its pH screened by small test tube method
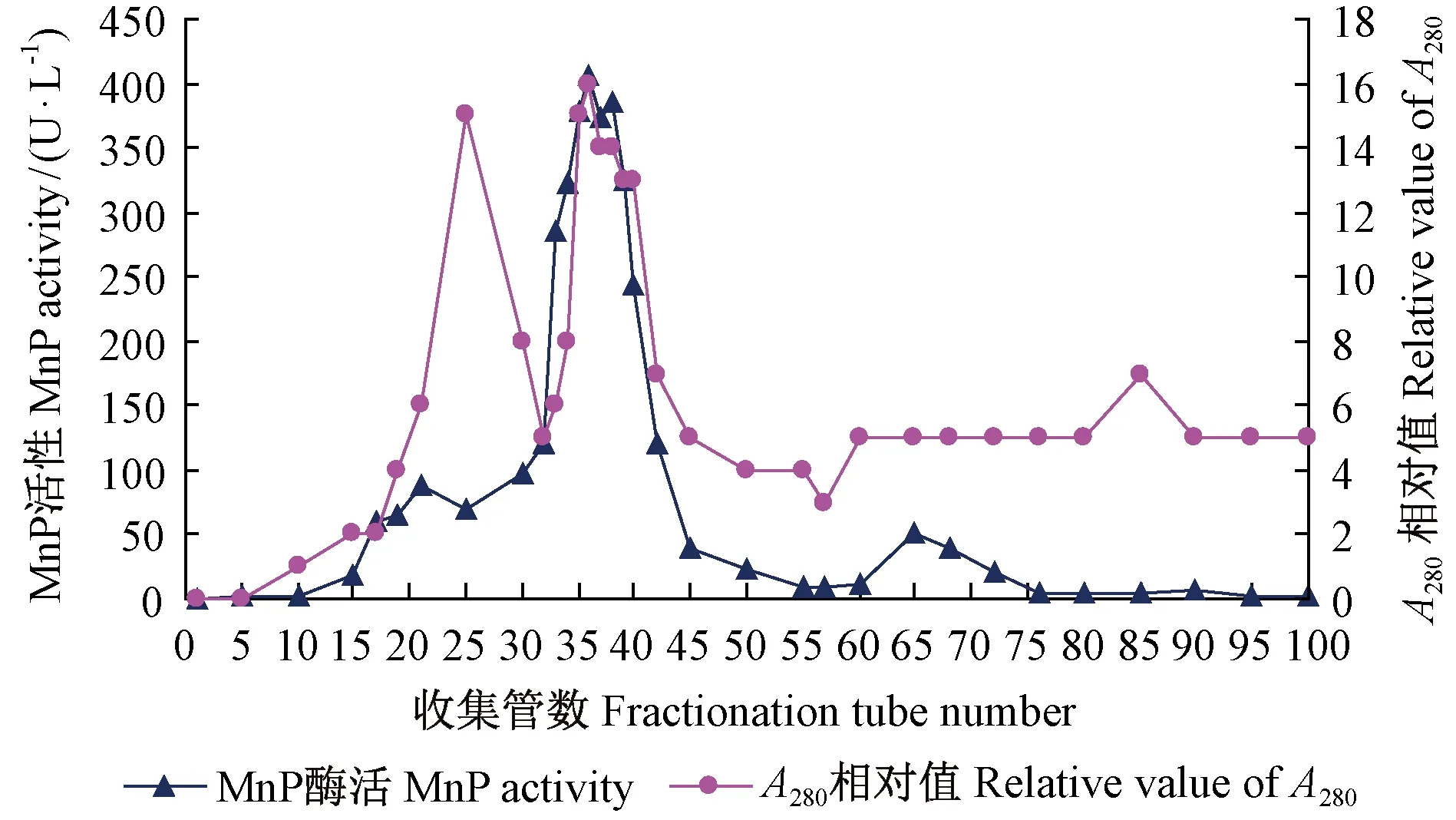
圖2 離子交換柱層析洗脫蛋白吸收峰和MnP活性Fig.2 The protein absorption peak and MnP activity in the samples after ion exchange chromatography
2.4凝膠過濾柱層析洗脫峰蛋白含量和酶活檢測結果
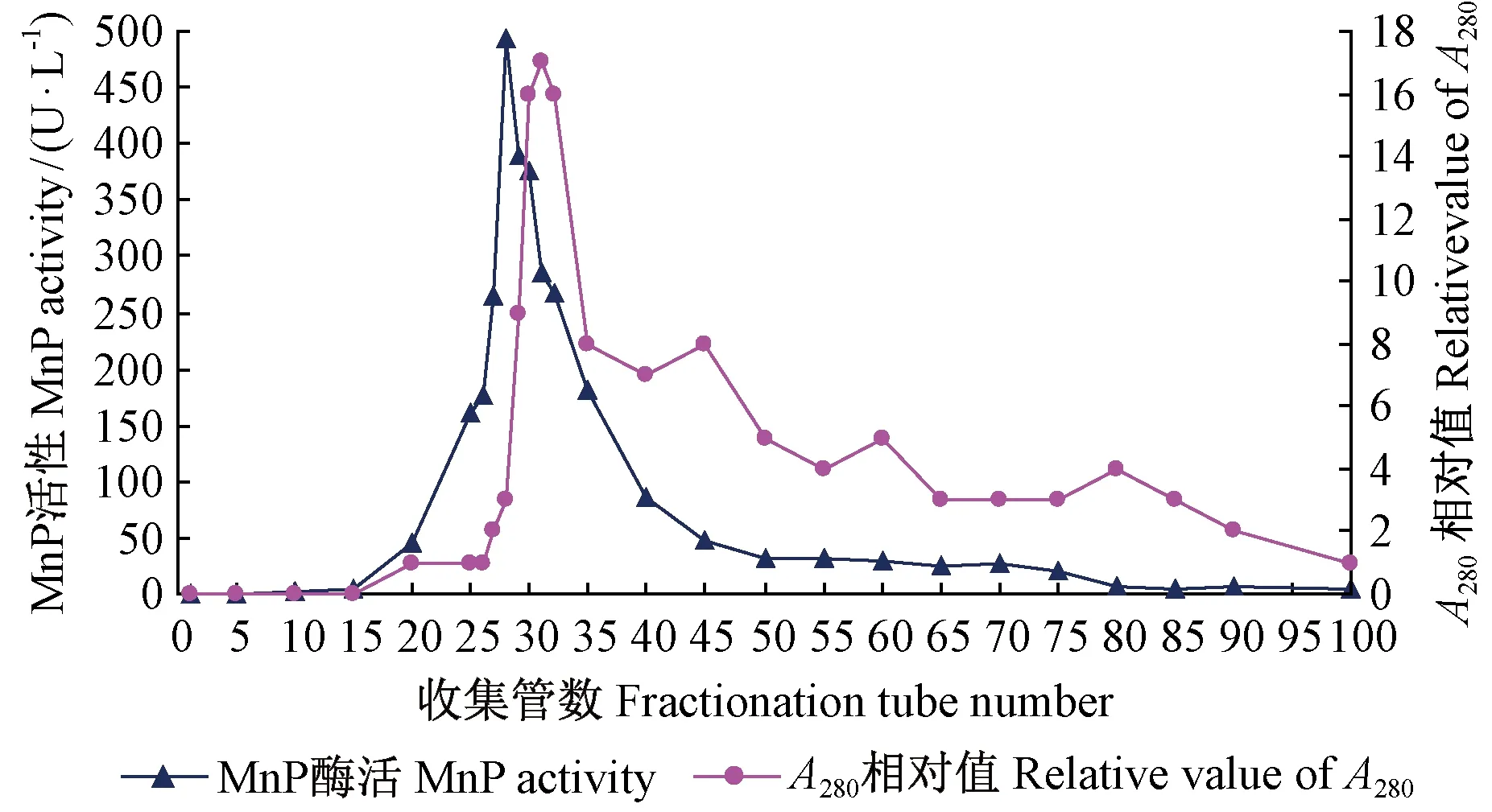
圖3 凝膠過濾柱層析洗脫蛋白吸收峰和MnP活性Fig.3 The protein absorption peak and MnP activity in the samples after gel filtration chromatography
將離子交換柱層析第2個蛋白吸收峰的32~42號試管中所收集的洗脫液合并,經PEG濃縮后的樣品繼續進行Sephadex G-75凝膠過濾柱層析的洗脫結果見圖3,只發現1個比較明顯的蛋白吸收峰,并在其中檢測出高MnP活性,其活性值與蛋白相對值走勢基本相一致。分子篩的作用是大分子蛋白首先被洗脫下來,接下來是分子質量較小的。收集該蛋白吸收峰的20~45號試管中液體濃縮后,測定蛋白的含量及酶活性結果見表3,其中總蛋白含量為1.38 mg,總酶活力為58.46 U,MnPs比活力高達42.36 U·mg-1,表明MnPs的純度已經很高。
2.5純化總表和電泳結果
從粗酶液經85%硫酸銨沉淀并透析、離子交換柱層析、凝膠過濾柱層析、冷凍干燥等一系列純化過程的總表見表3,其中凍干樣品的總蛋白含量、總MnP活力和比活力分別為1.29、43.38和33.63,比凝膠過濾柱層析后濃縮的樣品都有所下降,表明在凍干過程中失去了一部分MnP活性。SDS-PAGE檢測的結果見圖4,只在約40 kDa處有1條清晰的蛋白譜帶,表明純化后的MnP為單一組分,可見對L.gibbosaMnP的純化已達到電泳純。
表3純化總表
Tab.3AsummaryofMnPpurification
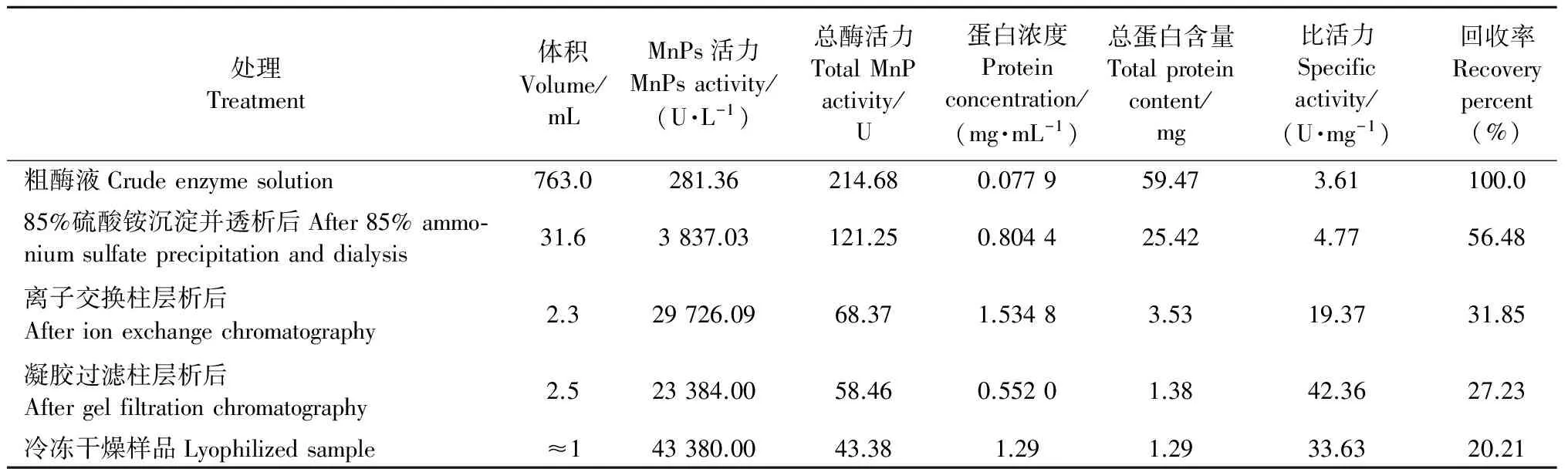
處理Treatment體積Volume/mLMnPs活力MnPsactivity/(U·L-1)總酶活力TotalMnPactivity/U蛋白濃度Proteinconcentration/(mg·mL-1)總蛋白含量Totalproteincontent/mg比活力Specificactivity/(U·mg-1)回收率Recoverypercent(%)純化倍數Purificationfold粗酶液Crudeenzymesolution763.0281.36214.680.077959.473.61100.01.085%硫酸銨沉淀并透析后After85%ammo?niumsulfateprecipitationanddialysis31.63837.03121.250.804425.424.7756.481.3離子交換柱層析后Afterionexchangechromatography2.329726.0968.371.53483.5319.3731.855.4凝膠過濾柱層析后Aftergelfiltrationchromatography2.523384.0058.460.55201.3842.3627.2311.7冷凍干燥樣品Lyophilizedsample≈143380.0043.381.291.2933.6320.219.3
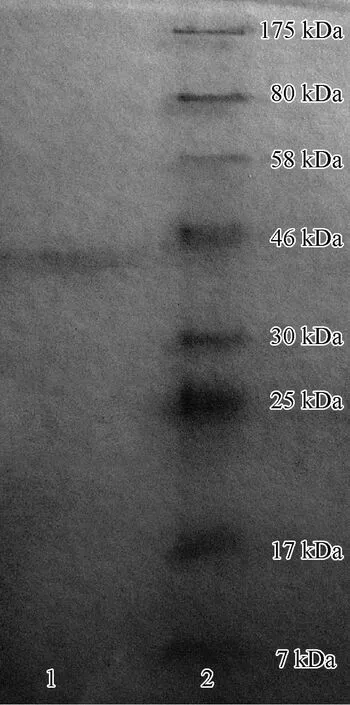
圖4 純化后MnP的SDS-PAGE圖譜Fig.4 SDS-PAGE pattern of purified MnP1.純化后的MnP Purified MnP; 2.Marker.
3 討論
酶的純化是一項技術含量高且繁瑣的工作,要從生物體或其分泌物中純化一種酶,往往需要多種方法協同使用。沉淀過程既要考慮蛋白沉淀完全、損失少,條件又要溫和、酶活性損失小。各種純化方法的選取,要遵循步驟少效率高并始終保持酶蛋白本身生化活性的原則,需要逐步通過預試驗選取最佳的分離純化方法。蛋白質沉淀主要分為有機溶劑沉淀法和鹽析法,本試驗由于未知L.gibbosaMnPs的沉淀特性,初期進行了PEG和硫酸銨2種沉淀方法的對比。PEG為親水性極強的水溶性非離子型高聚物,在一定鹽濃度條件下向溶液中加入PEG可引起大分子溶質的凝聚沉淀,常用于蛋白質、核酸、噬菌體等的分離。本試驗選用PEG的分子質量為6 000,操作過程中溶液較黏稠,離心后沉淀體積較大,需要反復抽提,酶活和蛋白質損失較嚴重。同類研究表明,高分子質量的PEG效果較好。鹽析法就是根據不同蛋白質在一定濃度鹽溶液中溶解度降低程度的不同而達到彼此分離的方法,不同蛋白質在不同的中性鹽濃度下析出,這與溶液的pH和蛋白質的等電點有關,利用此原理可以進行除去雜蛋白的初步純化。硫酸銨因其溶解度大、溫度系數小而被廣泛用于鹽析。本試驗進行了不同硫酸銨飽和度對蛋白沉淀的效果,由于未知L.gibbosaMnPs的鹽析特性,要分級試驗確定鹽析沉淀中硫酸銨的最佳飽和度,以盡量多地沉淀和獲得目的蛋白MnP。結果表明,當硫酸銨濃度達到85%時,在蛋白沉淀后的上清液中MnP活性很低,表明MnP絕大部分已經沉淀。硫酸銨分級沉淀不僅條件溫和、操作簡便,且比PEG沉淀回收率高,所以選擇硫酸銨沉淀法作為初級純化方法。采用PEG涂布吸水法濃縮層析過程中的各洗脫峰,可以將20~30 mL的樣品濃縮至5 mL以下,操作簡便,效果很好。凝膠過濾層析后的樣品經進一步冷凍干燥濃縮后,然后用極少量的去離子水溶解,離心后便得到純化的MnP。
4 結論
85%飽和度的(NH4)2SO4鹽析法是初期沉淀與純化L.gibbosa所產MnPs的最適方法; PEG濃縮法簡便、易行、有效; 試管小試法確定了離子交換柱層析中上樣的最適緩沖體系為pH等于7、離子強度為0.02 mol·L-1的Na2HPO4-NaH2PO4起始緩沖液; 初期濃縮后再經過離子交換柱層析和凝膠過濾柱層析可以得到電泳純的L.gibbosaMnP純化樣品。經過純化獲得了比活力相對很高的MnP。
程曉濱. 2007. 裂褶菌F17錳過氧化物酶的分離純化及其對偶氮染料脫色的研究.合肥: 安徽大學碩士學位論文.
(Cheng X B. 2007. Purification of a new manganese peroxidase of the white-rot fungusSchizophyllumsp. F17, and decolorization of azo dyes by the enzyme. Hefei:MS thesis of Anhui University. [in Chinese])
陸 健,周楠迪,史 峰,等. 2005. 蛋白質純化技術及應用. 北京: 化學工業出版社.
(Lu J, Zhou N D, Shi F,etal. 2005. The technique and application of protein purification. Beijing: Chemical Industry Press. [in Chinese])
蘇東海,蘇東民,楊國偉,等. 2008. 白腐菌TP21漆酶分離純化及其部分酶學特性的研究. 河南工業大學學報,29(5): 54-57.
(Su D H, Su D M, Yang G W,etal. 2008. Research on purification and characterization of laccase from white rot fungi TP21.Journal of Henan University of Technology, 29(5): 54-57. [in Chinese])
謝慧芳,近藤隆一郎,李忠正. 2003. 白腐菌PhanerochaetesordidaYK-624.產錳過氧化物酶的生產及初步純化. 林產化學與工業, 23(4): 22-26.
(Xie H F, Kondo R, Li Z Z. 2003. Production and purification of manganese peroxidase by white rot fungiPhanerochaetesordidaYK-624. Chemistry and Industry of Forest Products, 23(4): 22-26. [in Chinese])
張連慧,楊秀清,葛克山,等. 2005. 變色栓菌錳過氧化物酶同工酶的純化及其性質研究. 微生物學報, 45(5): 711-715.
(Zhang L H, Yang X Q, Ge K S,etal., 2005. Purification and properties of manganese peroxidase fromTrametesversicolor. Acta Microbiologica Sinica, 45(5): 711-715. [in Chinese])
張玉龍, 池玉杰, 閆洪波. 2011. 偏腫栓菌產錳過氧化物酶條件優化. 林業科學, 48(8): 88-94.
(Zhang Y L, Chi Y J, Yan H B. 2011. Optimization of ferment conditions of manganese peroxidase produced byTrametesgibbosa. Scientia Silvae Sinicae, 48(8): 88-94. [in Chinese])
Baborová P, M?der M, Baldrian P,etal. 2006. Purification of a new manganese peroxidase of the white-rot fungusIrpexlacteus, and degradation of polycyclic aromatic hydrocarbons by the enzyme. Res Microbiol, 157(3): 248-253.
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein using the principle of protein-dye binding. Anal Biochem, 72(1/2):248-254.
Gill P K, Arora D S. 2003. Effect of culture conditions on manganese peroxidase production and activity by some white rot fungi. J Ind Microbiol Biotechnol, 30(1): 28-33.
Lankinen P, Hildén K, Aro N,etal. 2005. Manganese peroxidase ofAgaricusbisporus: grain bran-promoted production and gene characterization. Appl Microbiol Biotechnol, 66(4): 401-407.
Mino Y, Wariishi H, Blackburn N J,etal. 1988. Spectral characterization of manganese peroxidase, an extracellular heme enzyme from the lignin degrading BasidiomycetePhanerochaetechrysosporium. J Biol Chem, 263(15): 7029 -7036.
Novotny C, Erbanova P, Sasek V,etal. 1999. Extracellular oxidative enzyme production and PAH removal in soil by exploratory mycelium of white rot fungi. Biodegradation, 10(3): 159-168.
Sundaramoorthy M, Kishi K, Gold M H,etal. 1994. The crystal structure of manganese peroxidase fromPhanerochaetechrysosporiumat 2.06 ? resolution. J Biol Chem, 269(52): 32759-32767.
Tsutsumi Y, Haneda T, Nishida T.2001. Removal of estrogenic activities of bisphenol A and nonylphenol by oxidative enzymes from lignin-degrading basidiomycetes. Chemosphere, 42(3): 271-276.
(責任編輯 王艷娜)
GradingPurificationofManganesePeroxidasesfromLenzitesgibbosa
Zhang Yulong1Chi Yujie1Feng Lianrong1, 2
(1.SchoolofForestry,NortheastForestryUniversityHarbin150040; 2.ThePoplarInstituteofLiaoningProvinceGaizhou115213)
S718.81
A
1001-7488(2017)08-0064-07
10.11707/j.1001-7488.20170808
2016-05-17;
2016-11-09。
東北林業大學博士研究生自主創新基金項目(2572016AA04); 黑龍江省自然科學基金項目(C2016006)。
*池玉杰為通訊作者。

