針葉小爪螨不同種群內共生菌Wolbachia和Cardinium的檢測及系統發育分析*
孫 菲 楊春紅 李 波 鄭金柱 周成剛 謝麗霞 尹淑艷
(1. 山東農業大學植物保護學院 泰安 271018; 2. 泰安市林業局 泰安 271000; 3.泰安市徂徠山林場 泰安 271000)
針葉小爪螨不同種群內共生菌Wolbachia和Cardinium的檢測及系統發育分析*
孫 菲1楊春紅1李 波2鄭金柱3周成剛1謝麗霞1尹淑艷1
(1. 山東農業大學植物保護學院 泰安 271018; 2. 泰安市林業局 泰安 271000; 3.泰安市徂徠山林場 泰安 271000)
【目的】 針葉小爪螨的山東板栗種群(TSBL)和浙江杉木種群(ZJSM)間存在生殖不親和,而內共生菌Wolbachia和Cardinium能引起宿主的胞質不親和等生殖異常現象,明確Wolbachia和Cardinium在針葉小爪螨中的分布情況,為下一步研究其在該螨種群分化中的可能作用及其對該螨的生殖調控作用奠定基礎。【方法】 提取單頭雌成螨的總DNA,使用特異性引物通過PCR擴增Wolbachia的wsp基因和Cardinium的16S rRNA基因的部分片段,將電泳檢測為陽性的PCR產物純化、測序,以確定所得產物是否為目的基因產物,并進行系統發育分析。【結果】 針葉小爪螨的山東板栗種群(TSBL)和浙江杉木種群(ZJSM)均無Wolbachia和Cardinium感染。所檢測的12個針葉小爪螨種群中,Wolbachia和Cardinium的感染率分別是0和8.3%。Cardinium僅在河北麻櫟種群中檢測到,但種群內感染率較高,為66.7%。感染針葉小爪螨的Cardinium與感染二斑葉螨的Cardinium的親緣關系較近。【結論】 我國針葉小爪螨中Wolbachia的感染率可能極低,該螨山東板栗種群(TSBL)和浙江杉木種群(ZJSM)間的生殖不親合與Wolbachia和Cardinium無關。
針葉小爪螨; 種群分化;Wolbachia;Cardinium; 系統發育
Abstract: 【Objective】 There exists reproductive incompatibility between theCastaneamollissimapopulation from Shandong Province (TSBL) and theCunninghamialanceolatapopulation from Zhejiang Province (ZJSM) ofOligonychusununguis. However,WolbachiaorCardinium, as the insect’s endosymbiont, has the ability to alter the reproductive capabilities of its host. This study aims to analyze the distribution ofWolbachiaandCardiniumin differentO.ununguispopulations, and to reveal the effects of endosymbionts onO.ununguisreproductive incompatibility.【Method】 Primers were designed according to the sequences of the gene encoding a surface protein ofWolbachia(wsp) and theCardinium’s 16S rRNA gene, and PCR was performed using the genomic DNA extracted from a single adult femaleO.ununguis. Purified PCR fragments were sequenced and blasted against the databases. Phylogenetic tree was constructed based on these sequences.【Result】 Neither theC.mollissimapopulation from Shandong Province (TSBL) nor theC.lanceolatapopulation from Zhejiang Province (ZJSM) was infected withWolbachia. In all the detected 12 populations ofO.ununguis, the infection rates ofWolbachiaandCardiniumwere 0 and 8.3%, respectively.Cardiniumwas detected only in theQuercusacutissimapopulation from Hebei Province, but the intrapopulation infection rate was high with 66.7%.TheCardiniuminfectingO.ununguiswas closer to that fromTeranychusurticaein phylogenetic relationship.【Conclusion】 The infection rate ofWolbachiamight be very low inO.ununguisin China. The reproductive incompatibility between theC.mollissimapopulation from Shandong Province (TSBL) and theC.lanceolatapopulation from Zhejiang Province (ZJSM) ofO.ununguiswas independent ofWolbachiaandCardinium.
Keywords:Oligonychusununguis; population differentiation;Wolbachia;Cardinium; phylogeny
針葉小爪螨(Oligonychusununguis)是一種分布廣、食性廣的害螨,廣泛分布于亞洲、歐洲、澳洲、美洲的眾多國家,寄主植物包括松科(Pinaceae)、柏科(Cupressaceae)、杉科(Taxodiaceae)等針葉樹和殼斗科(Fagaceae)、黃楊科(Buxaceae)、胡桃科(Juglandaceae)、桃金娘科(Myrtaceae)、薔薇科(Rosaceae)等闊葉樹(Bollandetal., 1998; Migeonetal., 2011)。我國用材樹種杉木(Cunninghamialanceolata)和經濟林樹種板栗(Castaneamollissima)上的重要害螨一直被認為是針葉小爪螨(王慧芙, 1981; 張時敏, 1982; 孫緒艮等, 1990),但研究發現,該螨的山東板栗種群和浙江杉木種群間存在生殖不親和,并且這種不親和基本上可以排除地理隔離的影響,因為浙江板栗種群與山東板栗種群間的雜交是完全親和的(尹淑艷等, 2010)。
昆蟲體內有多種共生菌。在過去20多年中,人們對內共生菌及其引起的宿主生殖異常現象有了較深刻的了解。到目前為止,最受關注且研究最多的參與宿主生殖調控的內共生菌是Wolbachia。Wolbachia屬于變形菌門(Proteobacteria)變形菌綱α亞門(Alphaproteobacteria)立克次體目(Rickettsiales)立克次體科(Rickettsiaceae)沃爾巴克氏體屬(Wolbachia)(潘曉玲等, 2014)。Wolbachia通過多種方式調控其宿主的生殖活動,包括胞質不親和(cytoplasmic incompatibility,CI)、孤雌生殖(parthenogenesis induction,PI)、雄性致死(male killing,MK)和雌性化(Feminization)等(Werrenetal., 2008),其中胞質不親和最普遍也最常見。胞質不親和有單向不親和和雙向不親和2種形式。當感染Wolbachia的精子與未感染Wolbachia的卵細胞進行受精時會發生單向不親和,但未感染的雄性與感染的雌性的雜交是親和的。單向不親和是Wolbachia引起寄主胞質不親和的典型形式,但在尖音庫蚊(Culexpipiens)、盾紋伊蚊(Aedesscutellaris)、擬果蠅(Drosophilasimulans)、Nasonia屬的某些蜂類和Cryllus屬的某些蟋蟀中也有雙向不親和現象的報道,雙向不親和發生在不同的Wolbachia品系之間(Jamesetal., 1999)。Cardinium是繼Wolbachia之后第2個被發現能調控宿主生殖行為的共生菌,屬于擬桿菌門(Bacteroidetes)鞘脂桿菌綱(Sphingobacteria)鞘脂桿菌目(Sphingobacteriales)屈撓桿菌科(Flexibacteraceae)(董鵬, 2007)。目前已經發現Cardinium能夠引起雌性化(Chigiraetal., 2005; Grootetal., 2006)、誘導產雌孤雌生殖(Zchori-Feinetal., 2001)、誘導胞質不親和(Gotohetal., 2007; Rosetal., 2009; 劉穎等, 2010; Xieetal., 2010; 朱路雨等, 2012; Zhuetal., 2012)等生殖異常現象。
微生物介導的不親和,尤其是雙向不親和可能在物種分化中起著重要作用(Perrot-Minnotetal., 1996; Bruckeretal., 2012)。針葉小爪螨山東板栗種群與浙江杉木種群間的生殖不親和是否與其體內的共生菌有關?雖然國外已有多種螨類感染Wolbachia和(或)Cardinium的報道,國內南京農業大學洪曉月教授研究組對二斑葉螨(Tetranychusurticae)、朱砂葉螨(T.cinnabarinus)等多種葉螨的內共生菌感染情況以及內共生菌與宿主的相互作用進行過研究(苗慧等, 2006; Xieetal., 2006, 2010;劉穎等, 2010; 陸明紅等, 2011; Yuetal., 2011; 朱路雨等, 2012; Luetal., 2012; Zhuetal., 2012; 丁秀蕾等, 2013; 謝蓉蓉等, 2013; Zhangetal., 2013b; 2013c; 2015; Zhaoetal., 2013a; 2013b; 2013c; 張艷凱等, 2014),但針葉小爪螨內共生菌感染情況未見相關報道,因此對此問題還不得而知。為此,本文利用PCR技術檢測了針葉小爪螨山東板栗種群(TSBL)、浙江杉木種群(ZJSM)及其他種群Wolbachia和Cardinium的感染情況,為進一步探討該螨板栗和杉木種群間的分化機制以及共生菌對該螨的生殖調控作用奠定基礎。
1 材料與方法
1.1 樣品采集 采集帶有螨體的單葉片放入蓋上有微孔的小塑料盒中,帶回實驗室,在解剖鏡下挑取雌成螨(每個葉片取1頭)于盛有無水乙醇的1.5 mL離心管中,每管1頭,置于-20 ℃保存。部分個體保存于75%酒精中,用于形態鑒定。采樣時,采樣植株間隔距離至少為10 m,同一采樣植株上采集的樣本間的距離至少為1 m,避免所采集到的樣本間有近的親緣關系。共采集了12個種群(表1)。
1.2 DNA提取及質量檢測 DNA提取 方法參照O’Neill等(1992): 將用酒精保存的單頭雌成螨浸入蒸餾水中除去酒精,移入TE緩沖液(10 mmol·L-1Tris-HCl,1 mmol·L-1EDTA,pH 8.0)中浸泡1 h,然后將蟲體轉移至25 μL STE buffer(100 mmol·L-1NaCl,10 mmol·L-1Tris- HCl,1 mmol·L-1EDTA,pH 8.0)中充分研磨,研磨后將離心管置于冰上并向離心管內加 2 μL蛋白酶 K(10 mg·mL-1)。簡單離心后, 37 ℃下孵育30 min。95 ℃初始變性5 min。簡單離心后,-20 ℃保存或立即取上清(2 μL)作為模板進行PCR。
DNA質量檢測 使用線粒體細胞色素C氧化酶亞基Ⅰ基因(COⅠ)片段進行檢測,所用引物為5’-TGGGTTTGGAATAGTTTCTCA-3’和5’-CTGTAAATCCTCCAATGGAAA-3’, PCR反應體系和反應條件參照尹淑艷等(2010)。只有得到陽性PCR產物的模板繼續用于下一步內共生菌的檢測。
1.3Wolbachia檢測及感染率計算ftsZ、16S rDNA 和wsp是3個常用的用于檢測Wolbachia的基因,其中wsp最靈敏(Hongetal., 2002),本研究使用特異性引物5’-TGGTCCAAATAAGTGATGAAGAAAC-3’與5’-AAAAATTAAACGCTACTCCA -3’,擴增Wolbachia的wsp基因的部分片段(500 bp左右)來檢測Wolbachia(Braigetal., 1998)。PCR反應總體系為25 μL,其中含有2 μL DNA 溶液,2×Es Taq MasterMix(康為世紀)12.5 μL,上下游引物(10 μmol·L-1) 各 1 μL,超純水8.5 μL。反應條件為: 94 ℃預變性2 min; 94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸1 min,35 個循環后72 ℃保溫10 min。陽性對照為確定感染Wolbachia的麗蠅蛹集金小蜂(Nasoniavitripennis)的DNA。
擴增產物用含有溴化乙錠的1%瓊脂糖凝膠電泳檢測。
種群感染率=(感染種群數/檢測種群數)×100%,種群內感染率=(某種群感染的個體數/該種群共檢測的個體數)×100%。
1.4Cardinium檢測及感染率計算 目前用于檢測Cardinium的基因主要是16S rRNA基因。本研究使用特異性引物5’-GCGGTGTAAACGCTACTCCA-3’與 5’-ACCTMTTCTTAACTCAAGCCT-3’,擴增Cardinium的16S rRNA基因的部分片段(450 bp左右)來檢測Cardinium(Weeksetal., 2003)。PCR反應總體系為25 μL,其中含有2 μL DNA 溶液,2×Es Taq MasterMix(康為世紀)12.5 μL,上下游引物(10 μmol·L-1) 各 1 μL,超純水8.5 μL。反應條件為: 94 ℃預變性2 min; 94 ℃變性30 s,57 ℃退火30 s,72 ℃延伸1 min,35 個循環后72 ℃保溫10 min。陽性對照為確定感染Cardinium的針葉小爪螨的DNA。
擴增產物用含有溴化乙錠的1%瓊脂糖凝膠電泳檢測。
感染率的計算同Wolbachia。
1.5 測序及序列分析 電泳檢測為陽性的PCR產物送上海桑尼生物科技有限公司純化、雙向測序。將所測得的序列在NCBI網站上進行BLAST,以確定所得到的是否為目的序列。
從NCBI網站上下載感染其他節肢動物的Wolbachia的wsp序列和Cardinium的16S rRNA基因序列,用MEGA5.2軟件中的ClustalW進行序列比對,并根據 Kimura 2-paramter 模型,采用鄰接法(Neighbor-Joining,NJ)構建系統發育樹,系統樹各分支的置信度(bootstrap)均進行1 000次的重復檢驗。
2 結果與分析
2.1 針葉小爪螨不同種群中Wolbachia和Cardinium的感染情況 本研究共檢測了針葉小爪螨12個種群的Wolbachia和Cardinium的感染情況,每個種群檢測的個體數從16到30個不等。由于針葉小爪螨個體很小,而DNA的提取是單頭提取,為了排除DNA提取不成功對共生菌檢測結果的影響,DNA提取后先對其提取質量進行檢測,提取合格的DNA再用于下一步的共生菌檢測。由于PCR會受到多種因素的影響,為了保證共生菌檢測的準確性,每次檢測以確定感染Wolbachia和Cardinium的DNA為陽性對照。檢測結果(表1)表明,Wolbachia和Cardinium在針葉小爪螨中的感染率均很低,12個種群共312個個體中均未檢測到Wolbachia,而Cardinium僅在河北麻櫟種群(HBML)中檢測到,種群感染率較低(8.3%,1/12),但種群內感染率較高,達66.7%(12/18)。
2.2 基于16S rRNA基因序列的Cardinium系統發育分析 所檢測的河北麻櫟種群(HBML)18個個體中,有12個感染了Cardinium,隨機選取其中3個樣本進行測序,所得序列經BLAST比對確定為目的序列,且3個樣本的Cardinium16S rRNA基因序列完全一致。將感染針葉小爪螨的Cardinium16S rRNA基因序列(GenBank 登 錄 號: KU886555)在NCBI網站上經 BLAST 比對后,選擇相似性較高的相關序列(表2),運用 MEGA5.2軟件,根據 Kimura 2-paramter 模型,采用鄰接法(NJ)構建系統發育樹。結果表明,感染針葉小爪螨的Cardinium與感染二斑葉螨的Cardinium的親緣關系最近,而與感染朱砂葉螨的Cardinium的親緣關系較遠,二者分別處于2個不同的分支上(圖1)。
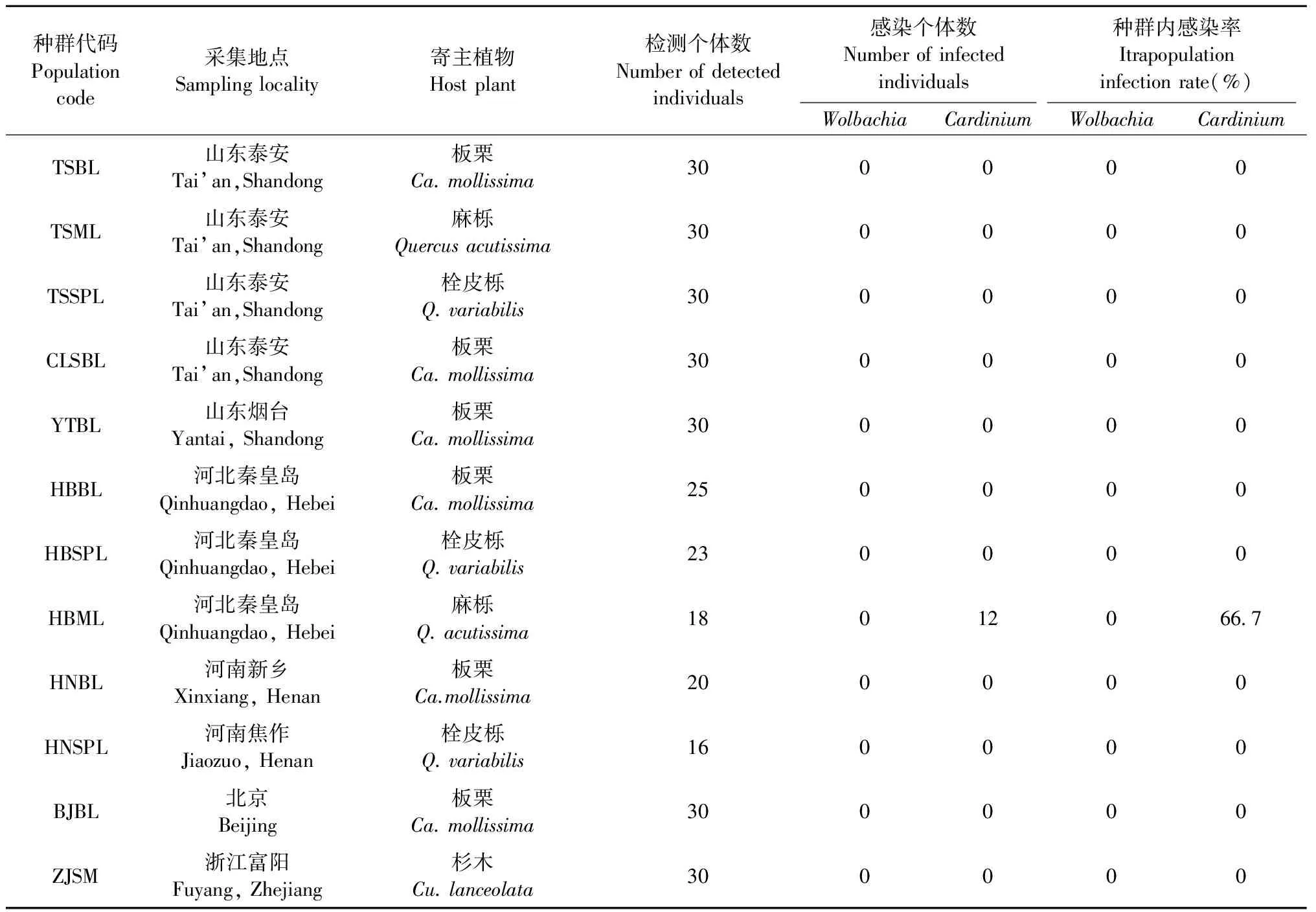
表1 針葉小爪螨種群采集信息及Wolbachia和Cardinium感染情況Tab.1 Collection information of O. ununguis populations and the infection status of Wolbachia and Cardinium
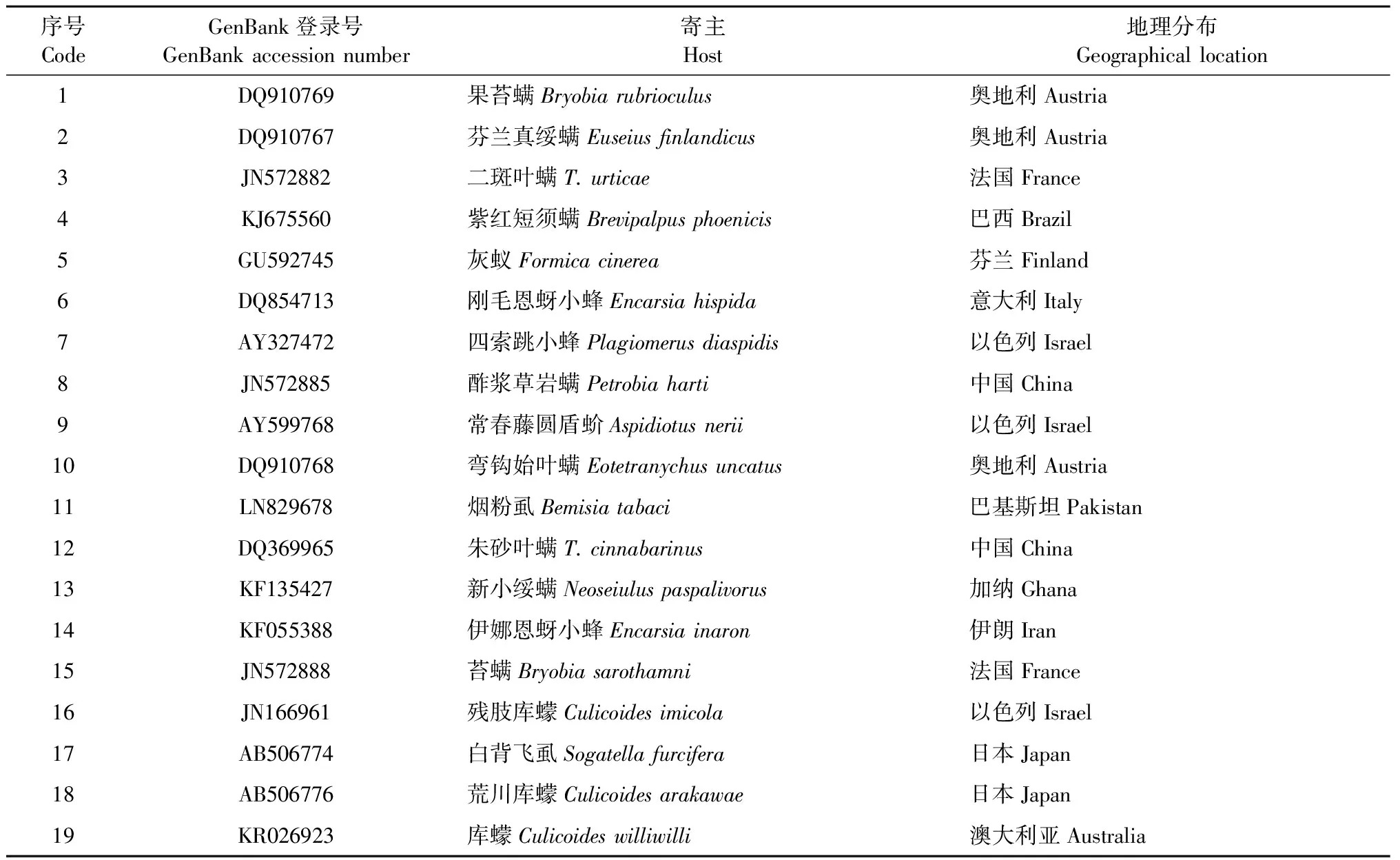
表2 構建系統發育樹時所引用的GenBank中登錄的Cardinium 16S rRNA基因序列Tab.2 16S rRNA gene sequences of Cardinium in GenBank quoted for constructing phylogenetic tree
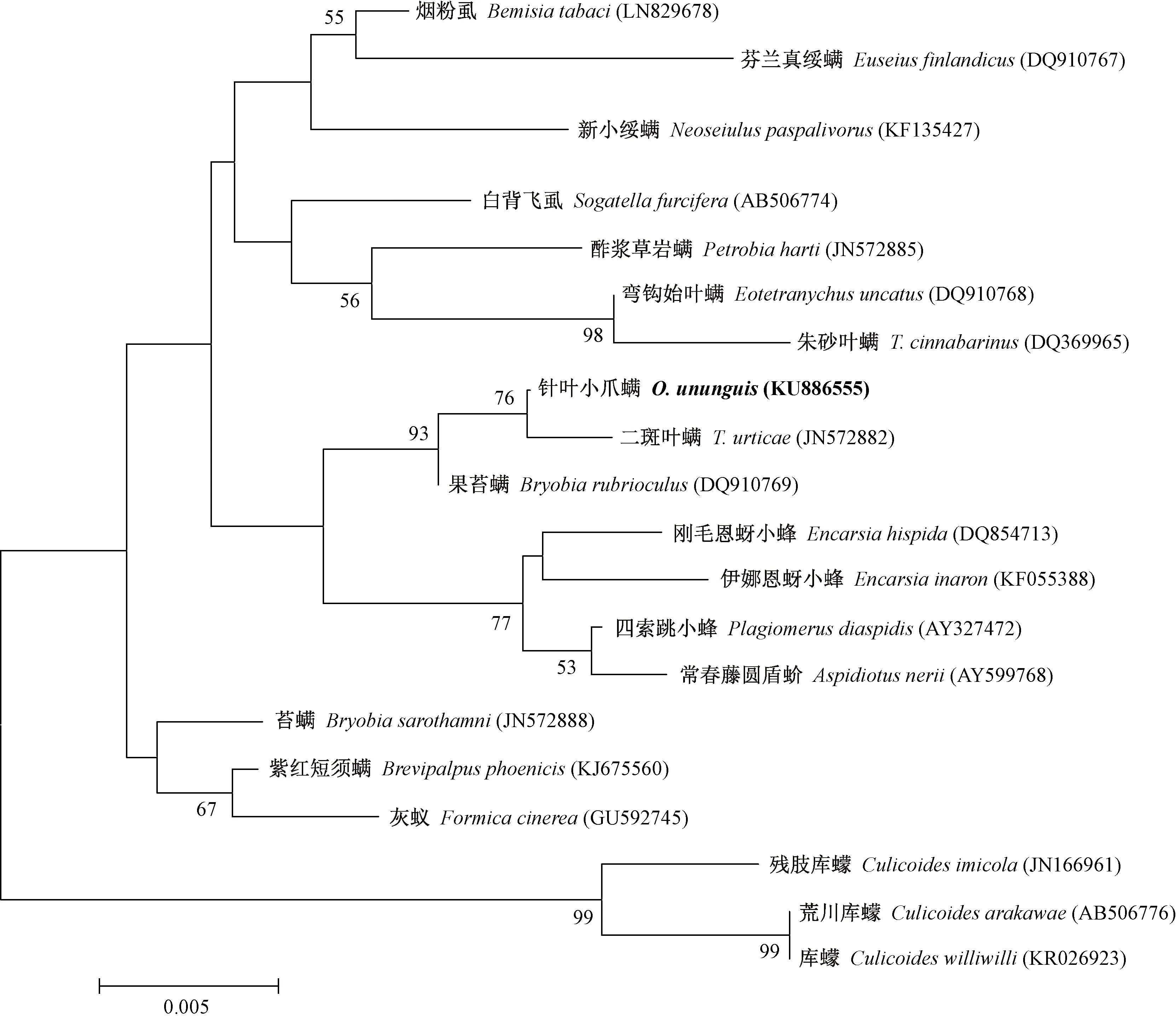
圖1 基于 Cardinium 16S rRNA 基因構建的系統發育樹(NJ法)Fig.1 Phylogenetic tree based on Cardinium 16S rRNA gene sequences with NJ method
3 討論
根據生物學物種的概念,生殖上完全隔離的2個群體應該是2個不同的種,但內共生菌Wolbachia、Cardinium等的研究使得生物學物種的概念受到挑戰。內共生菌Wolbachia和Cardinium對其宿主的生殖具有調控作用,能引起胞質不親和等生殖異常現象。為進一步了解引起針葉小爪螨山東板栗種群(TSBL)和浙江杉木種群(ZJSM)間生殖不親和的因素,本文檢測了這2個種群內共生菌的感染情況。結果顯示,所檢測的2個種群各30個個體均未感染Wolbachia和Cardinium。雖然內共生菌的感染情況會隨采樣時間、空間等因素而呈現多樣性(Sunetal., 2007; Arthoferetal., 2009; Hughesetal., 2011; 謝蓉蓉等, 2013; Zhangetal., 2013c; 張艷凱等, 2014),但由于本文檢測個體與雜交試驗所用個體為同一采樣批次,因此可以排除Wolbachia和Cardinium引起2種群生殖不親和的可能性。綜合本文研究結果及以前有關針葉小爪螨種群分化方面的研究,筆者認為針葉小爪螨的山東板栗種群與浙江杉木種群很可能由于長期適應不同的寄主植物分化成了2個種,但也不能排除鑒定錯誤,將原本就是不同的2個種誤認為是同一個種。由于大多數螨類體型微小,可用于鑒定的特征有限,因此,出現錯誤鑒定也是正常現象,世界范圍分布的二斑葉螨就有40多個異名。為了明確板栗和杉木上葉螨出現分化的原因或明確二者的分類地位,下一步筆者將基于形態特征和分子數據構建針葉小爪螨與小爪螨屬中其他物種的系統發育關系。
筆者檢測到采自河北秦皇島麻櫟上的針葉小爪螨感染Cardinium,且種群內感染率較高,達66.7%。如前所述,Cardinium能夠誘導雌性化、孤雌生殖和胞質不親和等生殖異常現象,此外,還能影響宿主適合度和改變寄主的產卵行為等(張開軍等, 2010)。感染針葉小爪螨河北麻櫟種群的Cardinium對寄主有怎樣的影響有待進一步研究。
Nakamura等(2009)檢測了22種葉螨體內Wolbachia和Cardinium的感染情況,發現Cardinium的感染率為40.9%,Wolbachia的感染率為31.8%,其中小爪螨屬葉螨Cardinium的感染率為66.7%(檢測6種,4種有感染),Wolbachia的感染率為16.7%(檢測6種,1種有感染),而葉螨屬葉螨Cardinium的感染率為12.5%(檢測8種,1種有感染),Wolbachia的感染率為62.5%(檢測8種,5種有感染),這可能說明Cardinium更易感染小爪螨屬的葉螨,而Wolbachia更易感染葉螨屬的葉螨。綜合分析193篇有關螨類細菌多樣性的報道,Chaisiri等(2015)發現,相對于其他節肢動物,螨類中更為重要的共生菌可能是Cardinium,而非Wolbachia。因為現在已知有31種螨類感染Wolbachia,但這些感染物種僅分布于所檢測14個總科的5個總科中,感染Cardinium的螨類也有31種,但卻分布于8個總科中。本文檢測了12個針葉小爪螨種群的Wolbachia和Cardinium感染情況,其中1個種群感染Cardinium,所有種群均未檢測到有Wolbachia感染,結果與上述文獻檢測、分析結果較一致。
雖然Wolbachia被認為是節肢動物體內最豐富的胞內共生菌,是研究最為廣泛最為深入的內共生菌,但為何有的物種或類群無Wolobachia分布,而有的物種或類群卻是Wolbachia寄生的熱門宿主,這仍然是一個懸而未決、最具挑戰性的問題。采自泰國29個省的89種蚊子中有28.1%(25種)的種類感染Wolbachia,其中按蚊屬(Anopheles)的22個種中均未檢測到感染。作者認為可能是按蚊在生理上不支持Wolbachia的感染或很少遇到Wolbachia的水平傳播事件(Kittayapongetal., 2000)。赤擬谷盜(Triboliumcastaneum)和雜擬谷盜(T.confusum)是親緣關系很近的2個近緣種,目前尚未有赤擬谷盜體內存在Wolbachia的報道。程超等(2015)將感染Wolbachia的雜擬谷盜與未感染Wolbachia的赤擬谷盜混合飼養,對混合飼養后的赤擬谷盜及赤擬谷盜和雜擬谷盜的正反雜交后代進行檢測,均未發現Wolbachia感染,說明Wolbachia在雜擬谷盜和赤擬谷盜種間不存在水平傳播。系統發育分析表明Wolbachia存在水平傳播(Haineetal., 2005; Hoyetal., 2005; Sintupacheeetal., 2006; Raychoudhuryetal., 2009; Zhangetal., 2013a),且已通過試驗證實(Heathetal., 1999; Huigensetal., 2000; 2004; Duronetal., 2010)。為何Wolbachia不能通過水平傳播從雜擬谷盜傳播到赤擬谷盜,作者推測可能是赤擬谷盜體內含有抑制Wolbachia正常生長繁殖和存活的某種因子(程超等, 2015)。明確Wolbachia不感染的原因,必將有助于進一步深入了解Wolbachia與宿主間的相互作用,為Wolbachia在有害生物防控中的應用奠定更為堅實的基礎。
4 結論
Wolbachia和Cardinium在被檢測的12個針葉小爪螨種群中的感染率分別為0和8.3%。Cardinium只在河北麻櫟種群HBML中檢測到,種群內感染率為66.7%。感染河北麻櫟種群的Cardinium與感染二斑葉螨的Cardinium親緣關系最近。
針葉小爪螨泰山板栗種群(TSBL)和浙江杉木種群(ZJSM)間的生殖不親合與Wolbachia和Cardinium無關。
程 超, 沈加飛, 明慶磊, 2015. 赤擬谷盜和雜擬谷盜體內Wolbachia的感染狀況和種間傳播. 江蘇農業學報, 31(2): 272- 278.
(Cheng C, Shen J F, Ming Q L. 2015. Infection and interspecific transmission ofWolbachiainTriboliumcastaneumandT.confusum. Jiangsu Journal of Agricultural Sciences, 31(2): 272- 278. [in Chinese])
丁秀蕾, 張艷凱, 榮 霞, 等. 2013. 基于wsp基因的葉螨體內Wolbachia株系的多樣性與重組分析. 應用昆蟲學報, 50(2): 354-361.
(Ding X L, Zhang Y K, Rong X,etal. 2013. Diversity and recombination ofWolbachiastrains in spider mites based on analysis of thewspgene. Chinese Journal of Applied Entomology, 50(2): 354-361. [in Chinese])
董 鵬. 2007. 書虱體內共生菌Wolbachia與Cardinium的分子檢測及對書虱生殖調作用的研究. 重慶: 西南大學博士學位論文.
(Dong P. 2007. Molecular detection of endosymbiontsWolbachiaandCardiniumand its reproductive manipulation on psocids. Chongqing:PhD thesis of Southwest University. [in Chinese])
劉 穎, 謝蓉蓉, 洪曉月. 2010. 共生菌Cardinium對朱砂葉螨的生殖調控作用. 昆蟲學報, 53(11): 1233-1240.
(Liu Y, Xie R R, Hong X Y. 2010.Manipulation of symbiontCardiniumon the reproduction of the carmine spider mite,Tetranychuscinnabarinus(Boisduval) (Acari:Tetranychidae). Acta Entomologica Sinica, 53(11): 1233-1240. [in Chinese])
陸明紅, 謝蓉蓉, 趙臻君, 等. 2011. 二斑葉螨兩種群中Wolbachia誘導的胞質不親和作用的影響因子比較研究. 昆蟲學報, 54(9): 1018-1026.
(Lu M H, Xie R R, Zhao Z J,etal. 2011. A comparative study of factors influencing the expression ofWolbachia-inducedcytoplasmic incompatibility in two populations of the two-spotted spider mite,TetranychusurticaeKoch (Acari: Tetranychidae). Acta Entomologica Sinica, 54(9): 1018-1026. [in Chinese])
苗 慧, 洪曉月, 謝 霖, 等. 2006. 二斑葉螨體內感染的Wolbachia的wsp基因序列測定與分析. 昆蟲學報, 49(1): 146-153.
(Miao H, Hong X Y, Xie L,etal. 2006. Sequencing and sequence analysis of thewspgene ofWolbachiainTetranychusurticaeKoch (Acari: Tetranychidae). Acta Entomologica Sinica, 49(1): 146-153. [in Chinese])
潘曉玲, 劉起勇, 奚志勇. 2014. 基于昆蟲共生菌沃爾巴克氏體的蚊媒和蚊媒病控制研究進展. 中國媒介生物學及控制雜志, 25(1): 1-7.
(Pan X L, Liu Q Y, Xi Z Y. 2014. Advance in developingWolbachiaas a mean to control mosquito and mosquito-borne diseases. Chinese Journal of Vector Biology and Control, 25(1): 1-7. [in Chinese])
孫緒艮, 苗 良. 1990.針葉小爪螨研究初報. 山東農業大學學報, 21(3): 41-46.
(Sun X G, Miao L. 1990. Studies onOligonychusununguis(Jacobi). Journal of Shandong Agricultural University, 21(3): 41-46. [in Chinese])
王慧芙. 1981. 中國經濟昆蟲志.第二十三冊.螨目.葉螨總科. 北京:科學出版社.
(Wang H F. 1981. Economic Insect Fauna of China. Fasc. 23. Acariformes. Tetranychoidea. Beijing:Science Press. [in Chinese])
謝蓉蓉, 陳小琳, 孫荊濤, 等. 2013. 共生菌Wolbachia在中國二斑葉螨種群中的擴散規律. 應用昆蟲學報, 50(2): 345 -353.
(Xie R R, Chen X L, Sun J T,etal. 2013. A comparative study of the dynamics ofWolbachiainfection in different populations ofTetranychusurticae(Acari: Tetranychidae). Chinese Journal of Applied Entomology, 50(2): 345 -353. [in Chinese])
尹淑艷, 于新社, 郭慧玲, 等. 2010. 針葉小爪螨板栗和杉木種群間的遺傳分化和雜交試驗. 昆蟲學報, 53(5): 555-563.
(Yin S Y, Yu X S, Guo H L,etal. 2010. Genetic differentiation and cross-breeding experiments betweenOligonychusununguis(Acari: Tetranychidae) populations from host plantsCastaneamollissimaandCunninghamialanceolata. Acta Entomologica Sinica,53(5): 555-563. [in Chinese])
張開軍, 謝蓉蓉, 洪曉月. 2010. 胞內共生菌Cardinium的研究進展. 南京農業大學學報, 33(5): 1-11.
(Zhang K J, Xie R R, Hong X Y. 2010. Research progress of endosymbiontCardinium. Journal of Nanjing Agricultural University, 33(5): 1-11. [in Chinese])
張時敏. 1982. 針葉小爪螨初步觀察. 林業科技通訊, (3): 30-32.
(Zhang S M. 1982.Preliminary observation onOligonychusununguis. Forest Science and Technology, (3): 30-32. [in Chinese])
張艷凱, 孫 兵, 洪曉月. 2014.Wolbachia在山楂雙葉螨中的感染及對寄主生殖的影響. 昆蟲學報, 57(8): 914-920.
(Zhang Y K, Sun B, Hong X Y. 2014.Infection and reproductive effects ofWolbachiain the hawthorn spider mite,Amphitetranychusviennensis(Acarina: Tetranychidae). Acta Entomologica Sinica, 57(8): 914-920. [in Chinese])
朱路雨, 蔣欣雨, 楊思霞, 等. 2012.Wolbachia和Cardinium對皮氏葉螨生殖的影響及在寄主體內的定位. 昆蟲學報, 55(6): 684-693.
(Zhu L Y, Jiang X Y, Yang S X,etal. 2012. Reproductive effects and localization ofWolbachiaandCardiniumin the spider miteTetranychuspiercei(Acari: Tetranychidae). Acta Entomologica Sinica, 55(6): 684-693. [in Chinese])
Arthofer W, Riegler M, Schneider D,etal. 2009. HiddenWolbachiadiversity in field populations of the European cherry fruit fly, Rhagoletis cerasi (Diptera, Tephritidae). Mol Ecol, 18(18): 3816-3830.
Bolland, H R, Gutierrez J, Flechtmann C H W. 1998. World catalogue of the spider mites family Acari: Tetranychidae with references to taxonomy, synonymy, host pests and distribution. Academic Publ Brill.
Brucker R M, Bordenstein S R. 2012. Speciation by symbiosis. Trends in Ecology and Evolution, 27(8): 443-451.
Chaisiri K, McGarry J W, Morand S,etal. 2015. Symbiosis in an overlooked microcosm: a systematic review of the bacterial flora of mites. Parasitology, 142(9): 1152-1162.
Chigira A, Miura K. 2005. Detection of the ‘CandidatusCardinium’ bacteria from the haploid hostBrevipalpuscalifornicus(Acari: Tenuipalpidae) and effect on the host. Exp Appl Acarol, 37(1/2): 107-116.
Duron O, Wilkes T E, Hurst G D. 2010. Interspecifc transmission of a male-killing bacterium on an ecological timescale. Ecol Lett, 13(9): 1139-1148.
Gotoh T, Noda H, Ito S. 2007.Cardiniumsymbionts cause cytoplasmic incompatibility in spider mites. Heredity, 98(1): 13-20.
Groot T V M, Breeuwer J A J. 2006.Cardiniumsymbionts induce haploid thelytoky in most clones of three closely relatedBrevipalpusspecies. Exp Appl Acarol, 39(3/4): 257-271.
Haine E R, Pickup N J, Cook J M. 2005. Horizontal transmission ofWolbachiain aDrosophilacommunity. Ecol Entomol, 30(4): 464-472.
Heath B D, Butcher R D J, Whitfeld W G F,etal.1999. Horizontal transfer ofWolbachiabetween phylogenetically distant insect species by a naturally occurring mechanism. Curr Biol, 9(6): 313-316.
Hong X Y,Gotoh T, Noda H. 2002. Sensitivity comparison of PCR primers for detectingWolbachiain spider mites. Appl Entomol Zool, 37(3): 379-383.
Hoy M A, Jeyaprakash A. 2005. Microbial diversity in the predatory miteMetaseiulusoccidentalis(Acari: Phytoseiidae) and its prey,Tetranychusurticae(Acari: Tetranychidae). Biological Control, 32(3): 427-441.
Hughes G L, Allsopp P G, Brumbley S M,etal. 2011. Variable infection frequency and high diversity of multiple strains ofWolbachiapipientis inPerkinsiellaplanthoppers. Appl Environ Microbiol, 77(6): 2165-2168.
Huigens M E, Luck R F, Klaassen R H,etal. 2000. Infectious parthenogenesis. Nature, 405(6783): 178-179.
Huigens M E, de Almeida R P, Boons P A H,etal. 2004. Natural interspecifc and intraspecifc horizontal transfer of parthenogenesis-inducingWolbachiainTrichogrammawasps. Proc Natl Acad Sci USA, 271(1538): 509-515.
James M C, Robert D J B. 1999. The transmission and effect ofWolbachiabacteria in parasitoids. Res Popul Ecol, 41(1): 15-28.
Kittayapong P, Baisley K J, Baimai V,etal. 2000. Distribution and diversity ofWolbachiainfections in Southeast Asian mosquitoes. J Med Entomol, 37(3): 340-345.
Lu M H, Zhang K J, Hong X Y. 2012. Tripartite associations among bacteriophage WO,Wolbachia, and host affected by temperature and age inTetranychusurticae. Exp Appl Acarol, 58(3): 207-220.
Migeon A, Dorkeld F. 2006-2017. Spider Mites Web: a comprehensive database for the Tetranychidae. [2015-01-10]http:∥www.montpellier.inra.fr/CBGP/spmweb.
Nakamura Y, Kawai S, Yukuhiro F,etal. 2009. Prevalence ofCardiniumbacteria in planthoppers and spider mites and taxonomi revision ofCandidatusCardinium hertigii based on detection of a newCardiniumgroup from biting midges. Appl Environ Microbiol, 75(21): 6757-6763.
O’Neill S L, Giordano R, Colbert A M,etal. 1992. 16S rRNA phylogenetic analysis of the bacterial endosymbionts associated with cytoplasmic incompatibility in insects. Proc Natl Acad Sci, USA, 89(7): 2699-2702.
Perrot-Minnot M J, Guo L, Werren J H. 1996. Single and double infections ofWolbachiain the parasitic waspNasoniavitripennis: effects on compatibility. Genetics, 143(2): 961-972.
Raychoudhury R, Baldo L, Oliveira D C S G,etal. 2009. Modes of acquisition ofWolbachia: horizontal transfer, hybrid introgression, and codivergence in theNasoniaspecies complex. Evolution, 63(1):165-183.
Ros V I D, Breeuwer J A J. 2009. The effects of, and interactions between,CardiniumandWolbachiain the doubly infected spider miteBryobiasarothamni(Acari: Tetranychidae). Heredity, 102(4): 413-422.
Sintupachee S, Milne J R, Poonchaisri S,etal. 2006. Closely relatedWolbachiastrains within the pumpkin arthropod community and the potential for horizontal transmission via the plant. Microb Ecol, 51(3): 294-301.
Sun X, Cui L, Li Z. 2007. Diversity and phylogeny ofWolbachiainfectingBactroceradorsalis(Diptera: Tephritidae) populations from China. Environ Entomol, 36(5): 1283-1289.
Werren J H, Baldo L, Clark M E. 2008.Wolbachia: master manipulators of invertebrate biology. Nat Rev Microbiol, 6(10): 741-751.
Xie R R, Liu Y, Hong X Y,etal. 2006. Effect of infection rate ofWolbachiaon the reproduction inTetranychuskanzawaiKishida (Acari: Tetranychidae) in China. Int J Acarol, 32(4): 407-415.
Xie R R, Zhou L L, Zhao Z J,etal. 2010. Male age influences the strength ofCardinium-inducedcytoplasmic incompatibility expression in the carmine spider miteTetranychuscinnabarinus. Appl Entomol Zool, 45(3): 417-423.
Yu M Z, Zhang K J, Xue X F,etal. 2011. Effects ofWolbachiaon mtDNA variation and evolution in natural populations ofTetranychusurticaeKoch. Insect Mol Biol, 20(3): 311-321.
Zchori-Fein E, Gottlieb Y, Kelly S E,etal. 2001. A newly discovered bacterium associated with parthenogenesis and a change in host selection behavior in parasitoid wasps. Proc Natl Acad Sci USA, 98(22): 12555-12560.
Zhang Y K, Ding X L, Rong X,etal. 2015. How do hosts react to endosymbionts? A new insight into the molecular mechanisms underlying theWolbachia-hostassociation. Insect Mol Biol, 24(1): 1-12.
Zhang K J, Han X, Hong X Y. 2013a. Various infection status and molecular evidence for horizontal transmission and recombination ofWolbachiaandCardiniumamong rice planthoppers and related species. Insect Sci, 20(3): 329-344.
Zhang Y K, Ding X L, Zhang K J,etal. 2013b.Wolbachiaplay an important role in affecting mtDNA variation ofTetranychustruncatus(Trombidiformes: Tetranychidae). Environ Entomol, 42(6): 1240-1245.
Zhang Y K, Zhang K J, Sun J T,etal. 2013c. Diversity ofWolbachiain natural populations of spider mites (genusTetranychus): evidence for complex infection history and disequilibrium distribution. Microb Ecol, 65(3): 731-739.
Zhao D X, Chen D S, Ge C,etal. 2013a. Multiple infections withCardiniumand two strains ofWolbachiain the spider miteTetranychusphaselusEhara: revealing new forces driving the spread ofWolbachia. PLoS One, 8(1): e54964.
Zhao D X, Zhang X F, Chen D S,etal. 2013b.Wolbachia-hostinteractions: host mating patterns affectWolbachiadensity dynamics. PLoS One, 8(6): e66373.
Zhao D X, Zhang X F, Hong X Y. 2013c. Host-symbiont interactions in spider miteTetranychustruncatesdoubly infected withWolbachiaandCardinium. Environ Entomol, 42(3): 445-452.
Zhu L Y, Zhang K J, Zhang Y K,etal. 2012.Wolbachiastrengthenscardinium-inducedcytoplasmic incompatibility in the spider miteTetranychuspierceiMcGregor. Curr Microbiol, 65(5): 516-523.
Zug R, Hammerstein P. 2012. Still a host of hosts forWolbachia: analysis of recent data suggests that 40% of terrestrial arthropod species are infected. PLoS One, 7(6): e38544.
(責任編輯 朱乾坤)
DetectionofWolbachiaandCardiniumEndosymbiontsinDifferentOligonychusununguisPopulationsandPhylogeneticAnalysisofCardinium
Sun Fei1Yang Chunhong1Li Bo2Zheng Jinzhu3Zhou Chenggang1Xie Lixia1Yin Shuyan1
(1.CollegeofPlantProtection,ShandongAgriculturalUniversityTai’an271018; 2.ForestryBureauofTaianCityTai’an271000; 3.ForestFarmofMountCulaiTai’an271000)
S718.83
A
1001-7488(2017)08-0141-08
10.11707/j.1001-7488.20170816
2016-06-28;
2016-11-07。
山東省高等學校科技計劃項目(J14LE14); 國家自然科學基金項目(31401957)。
* 尹淑艷為通訊作者。

