含G-CSF預激小劑量方案早期再誘導治療急性髓系白血病的臨床觀察
倪 勛,鄒興立,謝坤瑩,周文君,羅文豐,魏 錦
(川北醫學院附屬醫院血液科,四川南充 637000)
論著·臨床研究doi:10.3969/j.issn.1671-8348.2017.25.015
含G-CSF預激小劑量方案早期再誘導治療急性髓系白血病的臨床觀察
倪 勛,鄒興立,謝坤瑩,周文君,羅文豐,魏 錦
(川北醫學院附屬醫院血液科,四川南充 637000)
目的評估含粒細胞集落刺激因子(G-CSF)預激小劑量方案早期再誘導治療急性髓系白血病的緩解情況。方法回顧分析2015年3月至2017年1月該院收治的97例急性髓系白血病患者的資料,均采用標準DA方案誘導化療,其中38例患者誘導化療第14天存在明顯殘留病,21例患者采用小劑量預激方案早期再誘導化療,17例患者采用標準DA方案再誘導化療,比較兩組患者再誘導化療完全緩解(CR)率及不良反應。結果97例患者總CR率為60.8%;38例需要再誘導化療的患者中,預激方案再誘導組CR率為76.2%,明顯高于DA方案再誘導組的41.2%,差異有統計學意義(P=0.028),兩組患者再誘導化療過程中感染、血細胞減少等不良反應發生率差異無統計學意義(P>0.05)。結論誘導化療第14天存在明顯殘留病的急性髓系白血病患者采用小劑量預激方案早期再誘導化療有較高的CR率,優于標準DA方案。
白血病;完全緩解;再誘導;預激
誘導化療獲得完全緩解(complete response,CR)是急性髓系白血病(acute myeloid leukemia,AML)患者取得較好療效的前提,沒有獲得CR的患者即使行造血干細胞移植治療,療效也很差,長期無病生存率僅10%左右[1]。初始誘導化療第14天,約有30%~40%的AML患者存在明顯殘留病,這些患者大多數不能從初始誘導化療中獲得CR[2]。對于初始誘導化療第14天存在明顯殘留病的患者,最新NCCN指南建議使用中大劑量阿糖胞苷或DA方案再誘導化療,使用中大劑量阿糖胞苷早期再誘導其治療相關毒性可能會明顯增加,而DA方案再誘導CR率僅為50%左右,最佳的再誘導方案目前尚不清楚。本研究比較了含粒細胞集落刺激因子(G-CSF)預激的小劑量方案與DA方案早期再誘導化療的療效,現報道如下。
1 資料與方法
1.1一般資料 回顧分析2015年7月至2017年1月本院收治的初診AML患者97例,均采用標準DA方案初始誘導化療。納入誘導化療第14天存在明顯殘留病的患者38例;排除標準:誘導化療第14天無明顯殘留病的患者、誘導化療后因合并感染或一般情況較差不能立即行再誘導化療的患者。38例患者中,男20例,女18例,年齡15~63歲,中位年齡37歲,高危組15例,中低危組13例,不能確定危險分層的10例,17例患者采用DA方案再誘導化療,21例患者采用含G-CSF 的小劑量預激方案(CAG方案15例,HAG方案6例)再誘導化療,兩組患者臨床特征基線情況見表1。
1.2初始誘導化療 初始誘導化療方案均為標準DA方案(第1~3天柔紅霉素45~60 mg/m2;第1~7天阿糖胞苷200 mg/m2)。初診時高白細胞白血病的患者,給予阿糖胞苷50~100 mg/d或聯合羥基脲治療,白細胞降至30×109/L以下再給予標準DA方案誘導化療。誘導化療第14天(化療后第7天)復查骨髓,原始細胞比例大于或等于10%被認為存在明顯殘留病。
1.3再誘導化療 38例存在明顯殘留病的患者均在初始誘導化療第15~21天行再誘導化療,21例患者采用含G-CSF 預激的小劑量方案早期再誘導化療,17例患者采用初始DA方案再誘導化療。預激方案組中15例患者采用CAG方案:G-CSF 200 μg/ m2,每天1次,化療前1 d開始,WBC≥20×109/L時停用,WBC<10×109/L時再次使用,阿糖胞苷15 mg/m2皮下或肌內注射,每12小時1次,共10~14 d,克拉霉素10~15 mg/m2,每天1次,共4 d。6例患者采用HAG方案:G-CSF 200 μg/m2,每天1次,化療前1 d開始,WBC≥20×109/L時停用,WBC<10×109/L時再次使用,阿糖胞苷15 mg/m2皮下或肌內注射,每12小時1次,共10~14 d,高三尖杉酯堿每天1 mg,共7~10 d。

表1 兩種方案早期再誘導化療患者臨床特征(n)
1.4支持治療 化療期間常規水化、堿化尿液、預防嘔吐、注意營養支持及維持水電解質平衡。骨髓抑制期、血紅蛋白(Hb)<60 g/L或貧血癥狀重時給予紅細胞懸液輸注,血小板小于10×109/L或有出血傾向時給予血小板輸注,發生感染時給予廣譜抗生素治療。
1.5療效標準 療效標準根據NCCN急性髓系白血病指南(2017年第1版),CR定義為:骨髓原始細胞少于5%、無Auer小體、無髓外病灶、無輸血依賴、中性粒細胞絕對值大于1×109/L、血小板大于或等于100×109/L,只有血小板或中性粒細胞未達到上述要求定義為CR-u。誘導化療第14天存在明顯殘留病定義為:誘導化療第14天(化療后第7天)骨髓增生活躍并且原始細胞大于或等于10%。
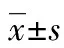
2 結 果
2.197例AML患者總CR率為60.8%,38例患者誘導化療第14天存在明顯殘留病需要再誘導化療,21例患者采用預激方案再誘導化療,CR率為76.2%,明顯高于標準DA方案再誘導組的41.2%,差異有統計學意義(P=0.028)。預激方案再誘導化療高危組患者CR率為57.1%,高于標準DA方案再誘導化療高危組患者的33.6%,但差異沒有統計學意義(P=0.39)。預激方案再誘導化療中低危組患者CR率為66.7%,高于標準DA方案再誘導化療中低危組的50%,但差異也無統計學意義(P=0.52),見表2。

表2 早期再誘導化療完全緩解率比較[n(%)]
2.2兩組患者在再誘導化療過程中均無治療相關死亡,兩組患者感染、Ⅲ~Ⅳ級白細胞減少、Ⅲ~Ⅳ級血小板減少、Ⅲ~Ⅳ級血紅蛋白減少等不良反應發生率方面差異無統計學意義(P>0.05),見表3。

表3 早期再誘導化療患者不良反應[n(%)]
血紅蛋白減少:≤30 g/L;白細胞減少:≤1×109/L;血小板減少:≤10×109/L
3 討 論
目前AML的初始標準誘導化療方案仍然是蒽環類藥物聯合阿糖胞苷的“3+7”方案。誘導化療第14天存在明顯殘留病的AML患者有50%左右為遺傳學高危組患者[3]。在一項1 740例AML患者大樣本研究中,53%的患者在誘導化療第14天存在明顯殘留病,第二療程“3+7”方案再誘導CR率僅為44%[4]。在本研究中,標準DA方案再誘導化療CR率為41.2%。提高誘導化療方案中柔紅霉素或阿糖胞苷劑量是目前提高CR率的主要策略。在一項ECOG協作組的隨機對照研究中,高劑量柔紅霉素組(90 mg/m2)CR率明顯高于標準劑量柔紅霉素組(45 mg/m2),CR率由57%提高到71%,分別有33%和22%的患者誘導化療第14天存在明顯殘留病,DA方案再誘導化療CR率在兩組患者中分別為49%和54%[5]。在一項SWOG協作組的研究中,大劑量阿糖胞苷組(24 g/m2)CR率與標準劑量組相比沒有差別(55%vs.58%),但大劑量阿糖胞苷組治療相關病死率明顯高于標準劑量組(14%vs.5%)[6]。對于AML患者初始誘導化療第14天存在明顯殘留病的患者,NCCN指南指出最佳的再誘導方案目前尚不清楚[3],初始誘導化療后患者一般情況下降,血細胞減少,使用大劑量阿糖胞苷再誘導化療其治療相關死亡率可能會明顯增加,而標準方案再誘導化療CR率較低。
目前研究認為處于G0期的白血病干細胞能抵抗常規化療藥物,形成多重耐藥,是白血病難治和復發的根源[7]。含G-CSF預激的化療方案是克服白血病細胞耐藥的重要方法,G-CSF通過動員G0期耐藥白血病細胞進入細胞周期等機制增加白血病細胞對化療的敏感度[8]。Yamada等[9]在1995年使用CAG預激方案治療37例難治/復發AML患者,CR率為62.2%,患者難受性較好。在一項317例難治/復發AML研究中,提高阿克拉霉素劑量使CAG方案的CR率達到60.7%[10]。CAG聯合其他藥物治療難治/復發AML或高危組MDS可以進一步增加療效,CAG聯合VP-16的CEAG方案治療難治/復發的AML及高危組MDS患者其CR率高達71.1[11]。Mai等[12]發現高三尖杉酯堿(HHT)能夠促進白血病細胞滯留在S期,增強阿糖胞苷對白血病的殺傷作用,使用HAG方案治療老年白血病,CR率為57.6%,在一項Meta分析中,536例老年AML患者使用HAG方案治療,CR率為54%,治療相關死亡率低[13]。Gao等[14]報道采用含G-CSF預激的預處理方案能明顯提高半相合異基因造血干細胞移植治療高危AML患者的療效,2年無病生存率明顯高于對照組(55.1%vs.32.6%)。
誘導化療第14天存在明顯殘留病提示這些患者存在原發耐藥的可能,采用含G-CSF預激的方案可能部分克服這些患者的耐藥,筆者采用預激方案早期再誘導取得了較好的療效,CR率為76.2%,明顯高于標準DA方案再誘導組的41.2%。誘導化療第14天大多數患者血細胞明顯減少,在第15~21天對有明顯殘留病的患者采用含G-CSF預激的小劑量化療并沒有明顯增加治療相關并發癥,21例患者中沒有發生治療相關的死亡。 在本研究中,高危患者采用預激方案再誘導CR率為57.1%,高于標準DA方案組的33.3%,但差異沒有統計學意義,可能是分層后病例數太少的原因,另外本研究為單中心的研究,以后需要大樣本的多中心研究來進一步證實含G-CSF預激的小劑量方案早期再誘導化療的有效性并對CAG和HAG再誘導化療的療效進行對比。
[1]Duval M,Klein JP,He W,et al.Hematopoietic stem-cell transplantation for acute leukemia in relapse or primary induction failure[J].J Clin Oncol,2010,28(23):3730-3738.
[2]Walter RB,Buckley SA,Pagel JM,et al.Significance of minimal residual disease before myeloablative allogeneic hematopoietic cell transplantation for AML in first and second complete remission[J].Blood,2013,122(10):1813-1821.
[3]Estey E.Management of persistent AML at day 14[J].Best Pract Res Clin Haematol,2014,27(3/4):235-240.
[4]Cheson BD,Bennett JM,Kopecky KJ,et al.Revised recommendations of the International Working Group for diagnosis,standardization of response criteria,treatment outcomes,and reporting standards for therapeutic trials in acute myeloid leukemia[J].J Clin Oncol,2003,21(24):4642-4649.
[5]Fernandez HF,Sun ZX,Yao XP,et al.Anthracycline dose intensification in acute myeloid leukemia[J].N Engl J Med,2009,361(13):1249-1259.
[6]Weick JK,Kopecky KJ,Appelbaum FR,et al.A randomized investigation of high-dose versus standard-dose cytosine arabinoside with daunorubicin in patients with previously untreated acute myeloid leukemia:a Southwest Oncology Group study[J].Blood,1996,88(8):2841-2851.
[7]She M,Niu X,Chen X,et al.Resistance of leukemic stem-like cells in AML cell line KG1a to natural killer cell-mediated cytotoxicity[J].Cancer Lett,2012,318(2):173-179.
[8]沈照華,曾東風,孔佩艷.含G-CSF預激的化療在難治/復發性急性白血病治療中的研究進展[J].腫瘤防治研究,2015,42(5):526-530.
[9]Yamada K,Furusawa S,Saito K,et al.Concurrent use of granulocyte colony-stimulating factor with low-dose cytosine arabinoside and aclarubicin for previously treated acute myelogenous leukemia:a pilot study[J].Leukemia,1995,9(1):10-14.
[10]Qu Q,Liu L,Zhang Y,et al.Increasing aclarubicin dosage of the conventional CAG (low-dose cytarabine and aclarubicin in combination with granulocyte colony-stimulating factor) regimen is more efficacious as a salvage therapy than CAG for relapsed/refractory acute myeloid leukemia[J].Leuk Res,2015,39(12):1353-1359.
[11]李云龍,張曦,陳幸華,等.CEAG方案治療低增生性MDS-RAEB和AML的臨床觀察[J].西部醫學,2010,22(7):1219-1220.
[12]Mai WY,Lin MF.Induction of apoptosis by homoharringtonine in G1phase human chronic myeloid leukemic cells[J].Chin Med J (Engl),2005,118(6):487-492.
[13]Xie M,Jiang Q,Li L,et al.HAG (homoharringtonine,cytarabine,G-CSF) regimen for the treatment of acute myeloid leukemia and myelodysplastic syndrome:a Meta-Analysis with 2 314 participants[J].PLoS One,2016,11(10):e0164238.
[14]Gao L,Wen Q,Chen X,et al.Effects of priming with recombinant human granulocyte colony-stimulating factor on conditioning regimen for high-risk acute myeloid leukemia patients undergoing human leukocyte antigen-haploidentical hematopoietic stem cell transplantation:a multicenter randomized controlled study in southwest China[J].Biol Blood Marr Trans,2014,20(12):1932-1939.
Clinicalobservationofearlyre-inductionwithpriminglowdoseregimencontainingG-CSFintreatingacutemyeloidleukemia*
NiXun,ZouXinli,XieKunying,ZhouWenjun,LuoWenfeng,WeiJin
(DepartmentofHematology,AffiliatedHospital,NorthSichuanMedicalCollege,Nanchong,Sichuan637000,China)
ObjectiveTo evaluate the remission situation of early re-induction with priming low dose regimen containing G-CSF in treating acute myeloid leukemia (AML).MethodsNinety-seven AML patients in our hospital from March 2015 to January 2017 were retrospectively analyzed.All cases adopted the standard DA regimen for conducting the induction chemotherapy,among them,38 cases had significant residual disease on 14 d of induction chemotherapy,21 cases adopted the low dose priming regimen for conducting the early re-induction chemotherapy,17 cases adopted the tandard DA gregimen for conducting the re-induction chemotherapy.The complete remission(CR) rate and and adverse reactions were compared between two groups.ResultsThe total CR rate in all 97 cases was 60.8%;among 38 cases needing re-induction chemotherapy,the CR rate in the priming regimen re-induction group was 76.2%,which was significantly higher than 41.2% in the DA regimen re-induction group,the difference was statistically significant (P=0.028);the occurrence rates of side effects such as infection and cytopenia during re-induction chemotherapy process had no difference between two groups(P>0.05).ConclusionFor AML patients with obvious residual disease on 14 d of induction chemotherapy,adopting low dose priming regimen in re-duction chemotherapy has higher CR,which is superior to the standard DA regimen.
leukemia;complete remission;re-induction;priming
R552
A
1671-8348(2017)25-3500-03
2017-02-29
2017-06-17)
重慶市社會事業與民生保障科技創新專項(2016shms-ztzx10003)。
倪勛(1978-),在讀博士,主治醫師,主要從事急性白血病臨床研究。

