刺參酸性黏多糖對荷瘤小鼠肝癌組織中細胞凋亡相關蛋白表達的影響
李曉娟,宋揚,陳丹丹,代海華
(青島大學附屬醫院黃島院區,山東青島266777)
·基礎研究·
刺參酸性黏多糖對荷瘤小鼠肝癌組織中細胞凋亡相關蛋白表達的影響
李曉娟,宋揚,陳丹丹,代海華
(青島大學附屬醫院黃島院區,山東青島266777)
目的觀察刺參酸性黏多糖(SJAMP)對荷瘤小鼠肝癌組織中細胞凋亡相關蛋白表達的影響。方法采用肝癌細胞懸液接種法制備荷瘤小鼠50只,隨機分為陰性對照組、陽性對照組和SJAMP低、中、高劑量組各10只,分別腹腔注射生理鹽水、5-氟尿嘧啶和6.25、12.5、25 mg/kg的SJAMP各0.2 mL,連續12 d。處死小鼠,剝離腫瘤稱取質量,計算抑瘤率;HE染色后觀察腫瘤組織病理改變;免疫組化法檢測腫瘤組織中的促凋亡基因Caspase-3、Caspase-9、細胞色素C、Smac蛋白和抑制凋亡基因Survivin、NF-κB。結果SJAMP高劑量組抑瘤率高于中、低劑量組(P均<0.05),與陽性對照組比較差異無統計學意義(P>0.05)。病理檢查顯示,SJAMP中、高劑量組和陽性對照組肝癌細胞排列稀疏,核分裂減少,壞死區明顯增多。與陰性對照組比較,SJAMP中、高劑量組和陽性對照組肝癌組織中Caspase-3、Caspase-9、細胞色素C、Smac蛋白表達升高,Survivin、NF-κB表達降低(P均<0.05)。結論中、高劑量刺參酸性黏多糖能夠上調促凋亡基因、下調抑制凋亡基因的表達,從而抑制荷瘤小鼠瘤體的生長。
肝癌;刺參酸性黏多糖;細胞凋亡;含半胱氨酸的天冬氨酸蛋白水解酶;細胞色素C;Smac蛋白;存活素;核轉錄因子κB;小鼠
刺參屬于棘皮動物門、海參綱、楯手目、刺參科,其生物活性成分主要包括多糖、多肽、皂苷、膠原蛋白等[1]。刺參酸性黏多糖(SJAMP)由刺參體壁提取,具有免疫調節、抗凝血、抗衰老、抗腫瘤等多種生物學活性[2,3]。近年研究顯示,SJAMP可抑制人胰腺癌SW1990細胞、人宮頸癌Hela細胞的增殖[4,5],并促進其凋亡[6,7]。我們的前期研究[8]證明,SJAMP可抑制荷瘤小鼠肝癌細胞增殖,但其對肝癌細胞凋亡的作用尚未完全清楚。2015年12月,我們觀察了SJAMP對荷瘤小鼠肝癌組織中促凋亡基因Caspase-3、Caspase-9、細胞色素C、Smac蛋白和抑制凋亡基因Survivin、NF-κB表達的影響,旨在為臨床治療提供實驗依據。
1 材料與方法
1.1 材料 肝癌腹水小鼠10只,購自山東省醫學科學院,抽取腹水加入生理鹽水制成1×107/mL的瘤細胞懸液;SPF級小鼠50只購自山東魯抗醫藥公司,雌雄各半,體質量18~22 g。SJAMP粉劑購自中國海洋大學食品科學與工程學院,用生理鹽水配成終濃度為25 mg/mL的溶液,4 ℃保存,用前稀釋為0.625、1.25、2.5 mg/mL的溶液。5-氟尿嘧啶購自天津金耀氨基酸有限公司;兔抗小鼠Caspase-3、Caspase-9、Survivin、Smac、NF-κB、細胞色素C多克隆抗體購自北京博奧森生物技術有限公司,羊抗兔/鼠二抗試劑盒購自福建邁新生物技術開發公司;光學顯微鏡(日本Olympus)。
1.2 模型制作與分組處理 將0.2 mL瘤細胞懸液接種于小鼠腋窩處皮下,接種后均形成移植瘤體。將小鼠機分為陰性對照組、陽性對照組及SJAMP低、中、高劑量組各10只,腹腔內分別注射生理鹽水、20 mg/kg 5-氟尿嘧啶及6.25、12.5、25 mg/kg的SJAMP 各0.2 mL,1次/d,連續12 d。
1.3 抑瘤率測算 于末次注射次日,將小鼠放血處死,剝離腫瘤并稱取質量,計算抑瘤率。抑瘤率=(陰性對照組平均瘤質量-實驗組平均瘤質量)/陰性對照組平均瘤質量×100%[8]。
1.4 腫瘤組織病理學觀察 將腫瘤組織用中性甲醛固定,梯度乙醇脫水,二甲苯透明,石蠟包埋,制成4 μm切片;HE染色后,在顯微鏡下觀察腫瘤組織的病理。
1.5 腫瘤組織中Caspase-3、Caspase-9、Survivin、Smac、NF-κB、細胞色素C蛋白檢測 采用免疫組化法。將腫瘤組織切片,二甲苯脫蠟、梯度乙醇脫水,應用檸檬酸鹽高壓抗原修復;3% H2O2封閉10 min,山羊血清封閉20 min。分別加入相應的多克隆抗體,一抗37 ℃孵育1 h,PBS清洗;滴加二抗孵育30 min,PBS清洗5 min,DAB顯色。蘇木精復染,無水乙醇脫水,二甲苯透明,中性樹膠封片。以腫瘤細胞內出現棕黃色顆粒為陽性細胞,顯微鏡下隨機選取6個高倍視野拍照,應用Image-Pro Plus圖像分析軟件測量平均光密度值。
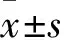
2 結果
2.1 各組抑瘤率比較 治療12 d后,SJAMP高、中、低劑量組及陽性對照組抑瘤率分別為56.09%、32.45%、12.58%、58.54%。SJAMP高劑量組抑瘤率高于中、低劑量組(P均<0.05),與陽性對照組比較差異無統計學意義(P>0.05)。
2.2 各組腫瘤組織病理結果比較 陰性對照組腫瘤細胞呈緊密排列狀態,細胞大小不等,細胞核大染色深,細胞增殖旺盛,核分裂象多見,變性壞死區較少;陽性對照組和SJAMP高劑量組腫瘤細胞排列稀疏,分裂象少見,可見大片腫瘤細胞變性壞死區域;SJAMP低、中劑量組腫瘤細胞可見輕度變性壞死。
2.3 各組腫瘤組織中Caspase-3、Caspase-9、Smac、細胞色素C、Survivin、NF-κB蛋白表達比較 見表1。
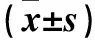
表1 各組腫瘤組織中Caspase-3、Caspase-9、Smac、細胞色素C、Survivin、NF-κB蛋白表達比較
注:與陰性對照組比較,aP<0.05;與SJAMP低劑量組比較,bP<0.05;與SJAMP中劑量組比較,cP<0.05。
3 討論
肝癌是常見的惡性腫瘤之一,其病死率在惡性腫瘤中居第2位。全世界每年約有25萬人死于肝癌,中國約占其中的45%[9]。肝癌對化療和放療均不敏感,常用的治療方法有手術切除、肝移植、血管介入、射頻消融術等,但治療效果受腫瘤大小、患者身體狀況等因素的影響。目前,有效誘導腫瘤細胞凋亡和分化,成為腫瘤藥物治療研究的重要策略。
SJAMP是從刺參體壁中提煉出來的具有抗腫瘤作用的成分。孫希寶等[10]的體外細胞實驗證實,極低濃度的SJAMP就可以抑制人肝癌細胞增殖,其抑制率隨藥物濃度增加及作用時間延長而升高。本研究結果顯示,SJAMP高劑量組對肝癌荷瘤小鼠的抑瘤率高于SJAMP中、低劑量及陰性對照組。與陰性對照組比較,SJAMP各劑量組腫瘤組織壞死區明顯增多,腫瘤細胞凋亡數量增加。表明SJAMP可明顯抑制荷瘤小鼠肝癌細胞的增殖,可能與其促進細胞凋亡有關。
與細胞凋亡調控密切相關的蛋白分為兩類,即促凋亡蛋白和抑制凋亡蛋白。Caspase-3是一種與細胞凋亡密切相關的終末剪切酶,屬于促凋亡蛋白的一種。作為細胞凋亡蛋白酶級聯反應中的核心蛋白,當Caspase-3蛋白被激活時,會使一些具有重要活性功能的蛋白或激酶失活,例如細胞周期蛋白、DNA修復蛋白等,而這些蛋白失活后可以直接引起細胞凋亡[11]。王穎等[6]研究表明,SJAMP能通過激活Caspase-3和Caspase-9使人宮頸癌細胞系Hela發生凋亡。腫瘤細胞發生凋亡的敏感性賴于細胞色素C蛋白的含量,細胞色素C基因表達增加可促進腫瘤細胞凋亡。方希敏等[12]研究表明,細胞色素C能使HL-60細胞凋亡。本研究顯示,SJAMP中、高劑量組中的細胞色素C表達較陰性對照組增高,表明SJAMP可能通過升高細胞色素C誘導腫瘤細胞凋亡。Smac是另一種重要的促凋亡調節蛋白,能夠與凋亡抑制蛋白IAP相互作用并使其喪失功能,在細胞凋亡途徑中發揮極其重要的作用[13]。本研究顯示,SJAMP中、高劑量組Caspase-3、Caspase-9、細胞色素C及Smac蛋白表達均較陰性對照組升高,表明中、高劑量SJAMP能夠活化細胞凋亡基因表達,促進腫瘤細胞凋亡。
抑制凋亡蛋白NF-κB能夠抑制細胞凋亡,對腫瘤細胞生長有重要調控作用[14]。研究[15,16]表明,NF-κB與多種實體腫瘤及白血病等血液系統腫瘤的發生、發展及腫瘤細胞的增殖、凋亡密切相關;此外,NF-κB與腫瘤耐藥性也密切相關,抑制NF-κB活性可增加腫瘤細胞對化療藥物的敏感性[17]。Survivin對細胞周期和凋亡具有重要的調控作用:其能夠直接作用于Caspase,抑制促凋亡基因Caspase-3、Caspase-7及Caspase-9的活性,阻斷各種刺激誘導的下游細胞凋亡的共同通路。國內唐郢[18]報道,Survivin可以直接抑制Caspase-3活性以降低腫瘤細胞對許多化療藥物的敏感性。本研究發現,SJAMP中、高劑量組Survivin和NF-κB蛋白較陰性對照組顯著降低,表明中、高劑量SJAMP能夠抑制Survivin和NF-κB蛋白表達,進而促進肝癌細胞凋亡。因此,我們認為,SJAMP可能通過多種途徑上調促凋亡基因表達、下調抑制凋亡基因表達,促進肝癌細胞凋亡,從而抑制腫瘤的生長。這將為進一步探索SJAMP在肝癌治療中的應用提供實驗依據。
[1] 張月杰,盧明峰,吉愛國.刺參多糖藥理作用研究進展[J].中國生化藥物雜志,2012,33(1):74.
[2] Song Y, Jin SJ, Cui LH, et al. Immunomodulatory effect of Stichopus japonicus acid mucopolysaccharide on experimental hepatocellular carcinoma in rats[J]. Molecules, 2013,18(6):7179-7193.
[3] Lu Y, Zhang BY, Dong Q, et al. The effects of Stichopus japonicus acid mucopolysaccharide on the apoptosis of the human hepatocellular carcinoma cell line HepG2[J]. Am J Med Sci, 2010,339(2):141-144.
[4] 薛魁金,田字彬,孔心涓,等.刺參黏多糖對人胰腺癌細胞株SW1990增殖的抑制作用[J].中華胰腺病雜志,2012,12(2):135-136.
[5] 張笑雪,于壯,宋揚.刺參黏多糖對Hela細胞PCNA表達及細胞周期的影響[J].山東醫藥,2009,49(46):19-21.
[6] 王穎,于壯,宋揚.刺參黏多糖對人宮頸癌Hela細胞Caspase表達影響[J].齊魯醫學雜志,2008,23(3):191-194.
[7] 陳玲,于壯,宋揚,等.刺參黏多糖對人宮頸癌細胞凋亡的影響[J].齊魯醫學雜志,2009,24(2):95-98.
[8] 陳丹丹,宋揚,代海華.刺參酸性黏多糖對H22荷肝癌小鼠腫瘤細胞增殖相關基因表達的影響[J].營養學報,2014,36(3):263-267.
[9] 葛均波,徐永健.內科學[M].北京:人民衛生出版社,2014:429.
[10] 孫希寶,王寶磊,劉家宏,等.刺參黏多糖誘導人肝癌細胞凋亡的實驗研究[J].國際外科學雜志,2010,37(5):304-306.
[11] Porter AG, Janicke RU. Emerging roles of caspase-3 in apoptosis[J]. Cell Death Differ, 1999,6(2):99-104.
[12] 方希敏,陳銘珍,陳日玲,等.細胞色素C對HL-60細胞凋亡作用及其與相關bcl-2、bax基因的關系[J].中國實驗血液學雜志,2005,13(4):570-574.
[13] Wu G, Chai J, Suber TL, et al. Structural basis of IAP recognition by Smac/ DIABLO[J]. Nature, 2000,408(6815):1008-1213.
[14] Bonizzi G, Karin M. The two NF-kappa B activation pathways and their role in innate and adaptive immunity[J]. Trends Immunol, 2004,25(6):280-188.
[15] Garg A, Aggarwal BB. Nuclear transcription factor-kappa B as atarget for cancer drug development[J]. Leukemia, 2002,16(6):1053-1068.
[16] Escurcega RO, Fuentes AS, Garcia CM, et al. The transcription factor nuclear factor-kappa B and cancer[J]. Clin Oncol(R Coll Radiol), 2007,19(2):154-161.
[17] Talmlani T, Takamaru N, Hara K, et al. Bortezomib-enhanced Radiosensitization through the suppression of radiation-induced nuclearfactor-κB activity in human oral calleer oells[J]. Int J Oncol, 2013,42(3):935-944.
[18] 唐郢.抗凋亡基因Survivin與宮頸癌[J].癌癥進展雜志,2004,2(5):348-350.
Effects of Stichopus japonicus acid mucopolysaccharide on apoptosis-related protein expression in liver cancer tissues of tumor-bearing mice
LIXiaojuan,SONgYang,CHENDandan,DAIHaihua
(TheAffiliatedHospitalofQingdaoUniversityHuangdaoCampus,Qingdao266777,China)
ObjectiveTo observe the effects of Stichopus japonicus acidic mucopolysaccharide (SJAMP) on apoptosis-related protein expression in liver cancer tissues of tumor-bearing mice.MethodsFifty hepatocarcinoma-bearing mice were established by subcutaneous injection of tumor cells in the right axillary, and then they were randomly divided into the negative control group (injected with normal saline), positive control group (injected with 5-FU 20 mg/kg), low-dose SJAMP group (6.25 mg/kg SJAMP 0.2 mL), medium-dose SJAMP group (12.5 mg/kg SJAMP 0.2 mL), and high-dose SJAMP group (25 mg/kg SJAMP 0.2 mL). The mice were all intervened for 12 days. The mice were sacrificed, and we weighed the tumor and calculated the tumor inhibition rate. HE staining was used to observe the pathological changes of tumor tissues. The expression of Caspase-3, Caspase-9, cytochrome C, Smac protein, survivin and NF-κB was detected by immunohistochemistry.ResultsThe tumor inhibition rate of the high-dose SJAMP group was higher than that of the low-dose and medium-dose SJAMP groups (P<0.05). The decreased cell density and nuclear division as well as increased necrotic area were found in the positive control group, medium-dose and high-dose SJAMP groups. Compared with the negative control group, the expression of Caspase-3, Caspase-9, cytochrome C,and Smac protein increased in the medium-dose, high-dose SJAMP groups and positive control group (P<0.05), while the expression of survivin and NF-κB significantly decreased (allP<0.05).ConclusionThe medium-dose and high-dose SJAMP can effectively up-regulate the expression of pro-apoptotic gene, down-regulate the expression of apoptosis inhibiting gene, thus inhibit the growth of tumor-bearing mice.
liver carcinoma; Stichopus japonicus acidic mucopolysaccharide; Caspase; cytochrome C; Smac protein; survivin; nuclear transcription factor κB; mice
10.3969/j.issn.1002-266X.2017.34.008
R735.7
A
1002-266X(2017)34-0027-03
2017-01-12)
國家自然科學基金資助項目(81072295)。
宋揚(E-mail: qdsongyang@126.com )。

