先思后評、尋規變練

摘 要:“先思后評、尋規變練”高三化學習題課變式教學,使教學過程呈現多向性、多層次的交互,不僅使教學結構發生質的變化,而且會讓學生從本質上更加深入地理解概念、原理等基礎知識,能夠快速準確地抓住問題的本質,提高問題解決的能力,提出在教學實踐過程中的兩個可行性策略并總結了三點體會。
關鍵詞:高三化學習題課;垂直變式;平行變式;教學策略
高三化學的課型之一是習題講評課,講評課中最能體現高效的教學效果的是習題的變式訓練,因此,研究習題的變式教學就顯得尤為重要。教師不僅要理解變式教學的本質,而且要靈活地選擇和轉換習題。在高三化學教學中,合理靈活運用變式教學策略不僅會讓學生從本質上更加深入地理解概念、原理等基礎知識,而且會讓學生在遇到形式各異習題的時候能夠快速準確抓住問題的本質,提高解決問題的能力。下面本人就“先思后評、尋規變練”高三化學習題課變式教學策略談談在實踐過程中的幾點體會:
一、習題課變式教學模式
“先思后評、尋規變練”高三化學習題課變式教學模式:交流研討—歸類評析—尋規總結—變式訓練,其中“尋規總結”是重點,“變式訓練”是關鍵。在教學過程中,教師針對學生討論后還無法解決的錯誤進行重點講解,尋找解決此類問題的規律和方法并進行總結,拓展學生思維的深廣度,然后把“質同形異”和“質異形似”的習題歸類到一起進行變式訓練,讓學生通過聯想類比加深對知識的理解、對解題方法與技巧的熟練運用,實現快速正確解題的思維與能力。
二、習題課變式教學策略
(一)垂直變式策略
垂直變式教學策略指教師在原題的基礎上根據問題的基本模式,從情境、條件、結論等方面局部變換問題,得到形式雖然不同,但是概念、原理、規律不變的一系列問題,進行一題多變的變式訓練,不斷強化學生對某一或多個知識點相結合應用的理解和掌握,熟練解法,并能夠用來解決其他類似問題的教學策略。垂直變式教學策略主要包含用相同的知識、原理、規律解決不同結構的題目,有助于學生實現知識和方法的遷移,形成一定的解題模式。
【案例1】向某密閉容器中加入一定量的A和B2,發生反應A(s)+2B2(g)?葑C(g)+2D(g),ΔH=akJ·mol-1。在T 1℃時,反應進行到不同時間測得各物質的濃度如下:
若20min后降低溫度至T 2℃,達到平衡時容器中B2、C、D的濃度之比為3∶1∶1,則a 0(填“>”或“<”)。
【交流研討】
1.如何利用Q與K的關系來判斷化學平衡移動的方向?
2.溫度的改變如何影響化學平衡移動的方向?
3.如何利用化學平衡移動的方向來判斷v正與v逆的相對大小關系?
【總結】
1.應用Q與K的大小關系來判斷化學平衡的移動方向
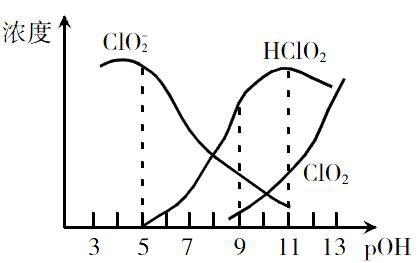
Q>K平衡正移;Q=K達到平衡;Q 2.應用溫度的改變對化學平衡移動的影響規律來判斷正反應是吸熱反應還是放熱反應。 溫度升高,平衡向吸熱方向移動;溫度降低,平衡向放熱方向移動。 3.根據化學平衡移動的方向可判斷v正與v逆的大小關系平衡朝正方向移動,則v正大于v逆;若平衡朝逆方向移動,則v正小于v逆。 變式1:若20 min后降低溫度至T 2 ℃,達到平衡時容器中B2、C、D的濃度之比為4∶1∶1,則a 0(填“>”或“<”),v正 v逆(填“>”或“<”)。 變式2:若20 min后降低溫度至T 2 ℃,達到平衡時容器中B2、C、D的濃度之比為1∶1∶2,則a 0(填“>”或“<”),v正 v逆(填“>”或“<”)。 變式3:若20 min后升高溫度至T 2 ℃,達到平衡時容器中B2、C、D的濃度之比為3∶1∶2,則a 0(填“>”或“<”),v正 v逆(填“>”或“<”)。 變式4:若20 min后升高溫度至T 2 ℃,達到平衡時容器中B2、C、D的濃度之比為1∶2∶2,則a 0(填“>”或“<”),v正 v逆(填“>”或“<”)。 以上變式涉及到的知識點、解題思維與方法都和原式相同,像這樣一題多變的變式設計把同一個或多個知識點及解題方法進行條件的轉換,揭示了問題的本質屬性,有助于學生熟練掌握該類問題的解決方法和技巧。 (二)平行變式教學策略 平行變式教學策略指的是教師根據原題的基本模式,主要圍繞學生答題時出現的思維障礙和缺陷的部分及欠缺的能力,如讀不懂圖像和圖表、無法挖掘和應用信息、邏輯推理能力和數據計算能力差等,以訓練相同能力或解法為切入點,盡可能選擇形式上和本質上都相似的同類題型,進行多題歸一的變式訓練。通過不同的知識背景不斷強化學生對某一或多種能力的掌握、加深對解法本質的理解,并能夠用來解決其他類似問題的教學策略。平行變式教學策略包含用同一種或多種能力、方法解決相同或相似結構的題目,幫助學生實現能力和方法的遷移,形成一定的解題模式。 【案例2】亞氯酸鈉(NaClO2)在溶液中可生成ClO2、HClO2、ClO-2、Cl-等,其中HClO2和ClO2都具有漂白作用。已知pOH=-lgc(OH-),經測定25 ℃時各組分含量隨pOH變化情況如圖所示(Cl-沒有畫出),此溫度下,下列分析錯誤的是( ) A.HClO2的電離平衡常數的數值Ka=10-6 B.亞氯酸鈉在堿性條件下較穩定 C.pH=7時,溶液中含氯微粒的濃度大小為:c(HClO2)>cClO-2)>c(ClO2)>c(Cl-) D.同濃度的HClO2溶液和NaClO2溶液等體積混合,則混合溶液中有c(HClO2)+2c(H+)=c(ClO-2)+2c(OH-) 【交流研討】結合本題討論如何解答圖像題,需要應用哪些化學反應原理來解答?
【總結】
1.讀圖:一看面,即明確橫縱坐標的意義和單位;二看線,即線的走向和變化趨勢;三看點,即起點、折點、交點、終點。
2.析圖:進行信息提取、挖掘隱藏信息進行邏輯推理或數據計算。
3.用圖:聯想化學反應原理解答。
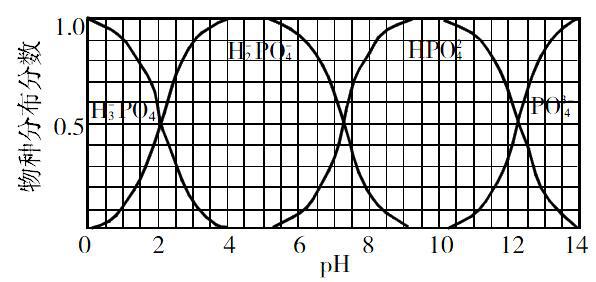
【變式1】H3PO4與NaOH溶液反應得到NaH2PO4、Na2HPO4和Na3PO4的混合溶液,平衡時含磷各物種的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與pH的關系如圖所示。
(1)H2PO-4的電離平衡常數的數值約為 ,為獲得盡可能純的NaHPO4,pH應控制在 。
(2)pH=6時,溶液中主要含磷物種濃度大小關系為 。
(3)Na2HPO4溶液顯 。
(4)同濃度的H3PO4溶液和Na2HPO4溶液等體積混合,則混合溶液中離子濃度大小的關系 。
【變式2】W是由A、B兩種元素組成的AB2型化合物。若A、B是同主族元素,W溶于水生成一種二元弱酸。如果常溫下W為氣體,W所形成的二元弱酸溶液中,含A元素的某微粒占所有含A元素微粒的物質的量分數與溶液pH的關系如下圖所示,該微粒的化學式為 ;該二元弱酸的一級電離常數為Ka1,則pKa1=-lgKa1≈ 。
學生在原式和變式答題中存在的最大的困難是無法解讀圖像和挖掘圖像中的隱藏信息,信息應用、邏輯推理及數據計算能力不足等,像這樣把同類型或同種解題方法的題目進行歸類訓練,有利于培養學生解決該類問題的能力和掌握解法。
三、習題課變式教學的體會
(一)同化或順應新知是目的
習題變式教學要針對學生在答題中存在的錯誤和困難,通過教師有意識地引導學生調動認知結構中和原式相聯系的知識和方法進行歸納總結,使學生明確答題所需的知識、方法和技巧,明確原式的本質,然后積極參與變式訓練,在同化或順應新知時,原有的相關知識和解題思路清晰,不僅能夠迅速發現變式與原式的差異,而且能夠快速地在變式和原式之間建立聯系,進而消除這些差異達到認知上的平衡,加深對知識的理解,熟練解題方法在變式訓練中得到同化或順應。
(二)精選變式訓練題是關鍵
在習題課變式教學中精選變式訓練題是關鍵,如果題目選擇不好學生就缺少了內化知識、方法、訓練能力的過程,教學效果將會大打折扣。精選變式訓練題主要考慮兩點:第一,考慮變式和原式在知識點或解題方法方面的聯系與區別;第二,考慮變式和原式在培養能力方面的聯系和區別。如果學生在原式中存在知識的理解和解題方法的問題,那么教師應精選形式不同而本質一致的習題進行變式訓練,加深對知識的建構和方法的本質的深刻理解;如果學生在原式中存在讀圖、讀表、挖掘隱藏信息障礙、邏輯推理、數據計算能力欠缺等,那么教師應精選形式相似而本質相同或不同的習題進行變式訓練,用以訓練這方面的能力。
(三)適度的變式訓練是保證
適度的變式訓練是變式教學達到最佳效果的保證,適度主要表現在兩個方面:一方面變式的數量要適度。教師將學生的易錯點、解題的思維障礙和缺陷、某方面能力欠缺等部分進行歸類設計成問題串,同時預測學生討論后仍然無法解決的部分問題,針對此部分問題進行變式設計,因此變式的數量要適度;第二,原式和變式難度之間要有梯度。變式的難度設計要建立在學生經過“思考—講解—尋規”后的認知發展水平上,這樣,前面原式的尋規為后面變式的問題解決提供了必要的鋪墊,給學生提供了反思、內化知識和解法、訓練能力的過程,實現了認知上從已有水平向潛在水平的跨越。
總之,高三化學習題講評課變式教學使教學過程呈現多向性、多層次的交互,不僅使教學結構發生質的變化,而且提高了學生善思、善變、善遷的能力,在設計化學變式習題時,要努力做到穩中有變、變中有異、變中求活,通過變式教學使學生具有靈活的思維,實現可持續發展。
參考文獻:
[1]王保強.化學教學中變式問題的設計原則[J].化學教學, 2012(11):65-67.
[2]宋廣文.心理學[M].山東大學出版社,1999.
[3]喬瑞英.變式在高中化學教學設計中的應用[D].內蒙古師范大學,2011.
作者簡介:鄭志芳(1973—),女,教育碩士,就職于福建省福安市第一中學,研究方向:化學學科。
編輯 李燁艷
