右美托咪定對腦缺血缺氧新生大鼠神經功能的影響
薄立軍,于沛霞,黃立寧,薛 輝,康榮田*
(1.河北醫科大學第二醫院麻醉科,河北 石家莊 050000;2. 河北醫科大學第三醫院麻醉科,河北 石家莊 050051; 3.河北省邯鄲市第四醫院麻醉科,河北 邯鄲 056200)
·論著·
右美托咪定對腦缺血缺氧新生大鼠神經功能的影響
薄立軍1,于沛霞2,黃立寧1,薛 輝3,康榮田1*
(1.河北醫科大學第二醫院麻醉科,河北 石家莊 050000;2. 河北醫科大學第三醫院麻醉科,河北 石家莊 050051; 3.河北省邯鄲市第四醫院麻醉科,河北 邯鄲 056200)
目的觀察右美托咪定對腦缺血缺氧新生大鼠神經凋亡以及對神經功能和長期學習記憶能力的影響。方法7天齡SD大鼠90只。建立大鼠(7 d)腦缺血缺氧損傷(hypoxic-ischemic encephalopathy,HIE)模型。假手術組(S)僅進行手術而不造成缺氧狀態;HIE模型組(R)持續缺氧2 h;右美托咪定25 μg /kg組(D1)、右美托咪定50 μg/kg組(D2),于HIE 2 h后,即刻分別靜脈注射右美托咪定25 μg/kg 、50 μg/kg;育亨賓組(Y),于HIE 2 h后,即刻靜脈注射給予右美托咪定50 μg/kg和育亨賓5 μg。Western blot法檢測各組干預后24 h,caspase-3表達和新生大鼠神經功能評分;干預后4周后,Morris水迷宮檢測學習記憶能力的變化。結果干預后24 h,R組caspase-3表達和神經功能評分明顯高于S組,D1組、D2 組和Y組低于R組,Y組高于D1組和D2組,差異均有統計學意義(P<0.05)。干預后4周后,Morris水迷宮逃避潛伏期第1~5天逐漸縮短,差異均有統計學意義(P<0.05)。第1天各組逃避潛伏期差異無統計學意義(P>0.05);第2、3、4、5天,R組逃避潛伏期較S組延長,D1組、D2組、Y組較R組縮短,Y組長于D1組、D2組,差異均有統計學意義(P<0.05)。R組目標像限停留時間明顯少于S組,D1組、D2組、Y組明顯多于R組,Y組少于D1和D2組,差異均有統計學意義(P<0.05)。D1與D2組神經功能評分、caspase-3表達、水迷宮檢測差異均無統計學意義。結論腦缺血缺氧導致新生大鼠腦海馬組織神經元凋亡增多,遠期新生大鼠學習記憶能力降低;右美托咪定25 μg/kg、50 μg/kg均抑制caspase-3表達,減少神經元的凋亡,并改善新生大鼠遠期學習記憶能力。
缺氧缺血,腦;模型,動物;右美托咪定
新生兒缺氧缺血性腦病(hypoxic-ischemicencephalopatly,HIE)是由圍產期窒息導致的腦缺氧缺血性損害,臨床以意識障礙、肌張力及原始反射改變、驚厥、腦水腫、顱內高壓為主的神經系統表現,是新生兒死亡及影響神經預后的嚴重疾病[1-2]。右美托咪定是α2受體興奮劑,已廣泛應用于臨床麻醉和重癥監護室。研究表明,右美托咪定對HIE有神經保護作用[3-5]。右美托咪定的神經保護作用與其藥物機制和α2受體相關,它能夠減少capase-3、bcl-2等的表達和神經元的凋亡[6],但目前還沒有其對HIE長期影響的研究。本研究通過動物實驗建立新生大鼠HIE模型,探討右美托咪定對新生大鼠HIE的影響,尤其是對長期神經功能、學習能力的影響,報告如下。
1 材料與方法
1.1 實驗動物及分組 健康7天齡SD大鼠90只,體質量11~16g(河北省實驗動物中心提供)。采用隨機數字表法分成5組,每組18只: 假手術組(S組)、HIE模型組(R組)、右美托咪定25μg/kg(D1組)、50μg/kg組(D2組)、育亨賓5μg組(Y組)。
1.2 模型制備Rice方法[7]建立大鼠HIE模型。SD大鼠于術前禁食6h,自由飲水,環境溫度19~22 ℃。假手術組:僅進行手術而不造成缺血缺氧。HIE模型組:行HIE模型手術。新生大鼠行左側頸總動脈永久性結扎,2h后置于玻璃缺氧箱中,37℃恒溫,輸入氧濃度為(8±0.1)%的氮氧混合氣體持續缺氧2h,右美托咪定25μg/kg、50μg/kg組于持續缺氧2h后即刻分別尾靜脈一次性注射給予右美托咪定(批號:13112332,江蘇恒瑞醫藥有限公司)25μg/kg、50μg/kg。假手術組和HIE模型組,給予同量的生理鹽水。育亨賓組給予右美托咪定50μg/kg和育亨賓5μg(批號:552206,J&KScientificLtd)。每組均母鼠喂養24h。
1.3 神經功能缺損評分 各組大鼠干預24h后,采用五點量表法評估神經行為,由不知道動物分組的研究者操作。每組隨機選取6只。正常(無神經功能缺損)0分:大鼠表現正常,完全可以伸開前肢和抬起尾巴;神經功能缺損1分:大鼠不能完全伸展其左前肢,抬起尾巴困難;神經功能缺損2分:大鼠已經減少抗側推,并有輕度神經行為;神經功能缺損3分:轉身成一個圓圈,并有輕度和中度神經行為;神經功能缺損4分:走路不協調,并有輕度意識障礙。
1.4Westernblot法檢測caspase-3表達 新生大鼠于干預24h后,每組隨機選取6只,在冰板上立即處死大鼠,取海馬,儲存-80 ℃冰箱備用。Westernbolt按文獻描述方法進行[8]。樣品的蛋白質濃度采用BCA法測定。采用抗裂解的caspase-3(1∶1 000 ,Affinity公司)一抗和二抗,抗β-actin(1∶500,Affinity公司),用凝膠電泳成像分析系統掃描PVDF膜,用ChemiScopeCapture軟件曝光并捕捉圖像,利用GelImageAnalysisV2.02軟件分析各條帶的灰度值。
1.5Morris水迷宮實驗 每組剩余新生大鼠6只,繼續喂養4周,行Morris水迷宮檢測。水迷宮直徑150cm,深度50cm, 水深40cm,水溫22°C。分別行定位導航和空間探索實驗。預先設定4個象限,進行5d的學習和記憶,每天4次,將以12cm圓形平臺置于一定位置并淹沒1cm。如果動物60s未找到平臺,潛伏期為60s。撤出平臺,將大鼠隨機置入水中,采用攝像機記錄其活動,記錄其60s探索軌跡和不同象限停留時間。
1.6 統計學方法 應用SPSS23.0統計軟件處理數據,計量資料比較分別采用單因素方差分析和SNK-q檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 各組caspase-3表達、神經功能評分比較 干預后24h,R組caspase-3表達和神經功能評分明顯高于S組,D1組、D2 組和Y組低于R組,Y組高于D1組和D2組,差異均有統計學意義(P<0.05)。見表 1,圖1。
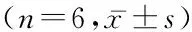
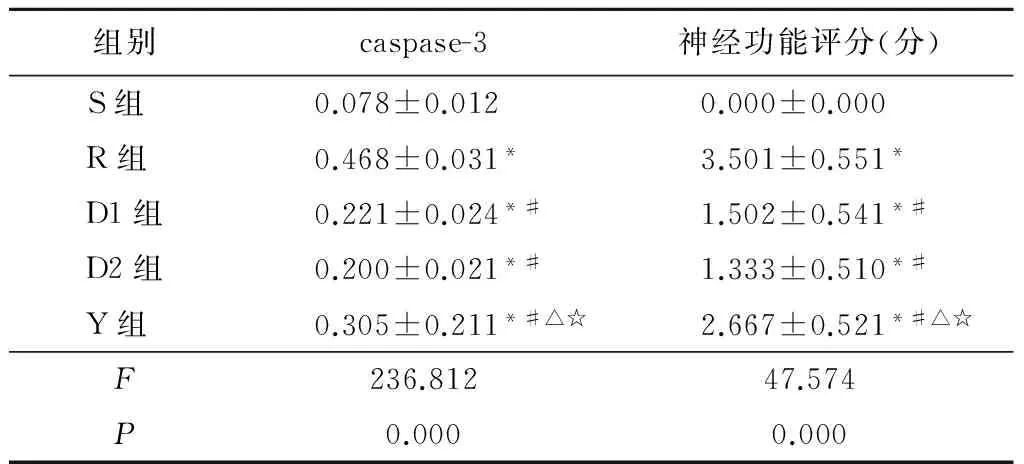
組別caspase-3神經功能評分(分)S組 0.078±0.012 0.000±0.000 R組 0.468±0.031*3.501±0.551*D1組0.221±0.024*#1.502±0.541*#D2組0.200±0.021*#1.333±0.510*#Y組 0.305±0.211*#△☆2.667±0.521*#△☆F236.81247.574P0.0000.000
*P<0.05與S組比較 #P<0.05與R組比較 △P<0.05與D1組比較 ☆P<0.05與D2組比較
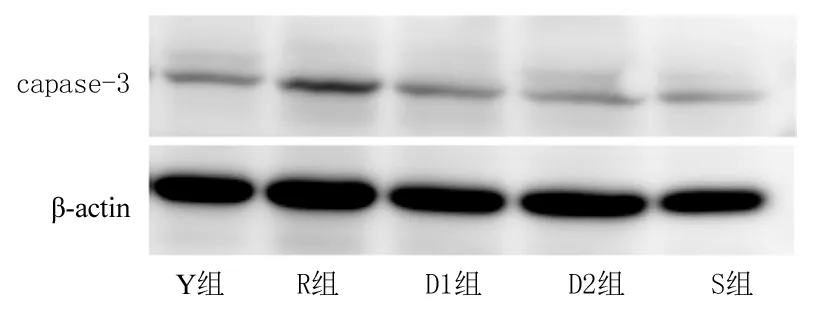
圖1各組Western blot檢測結果
Figure1TheresultofWesternblot
2.2 Morris水迷宮實驗 干預后4周后,各組大鼠Morris水迷宮逃避潛伏期從第1~5天逐漸縮短,差異均有統計學意義(P<0.05)。第1天各組逃避潛伏期差異無統計學意義(P>0.05);第2、3、4、5天,R組逃避潛伏期較S組延長,D1組、D2組、Y組較R組縮短,Y組長于D1組、D2組,差異均有統計學意義(P<0.05)。R組目標象限停留時間明顯少于S組,D1組、D2組、Y組明顯多于R組,Y組少于D1和D2組,差異均有統計學意義(P<0.05)。見表2。
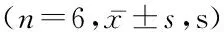
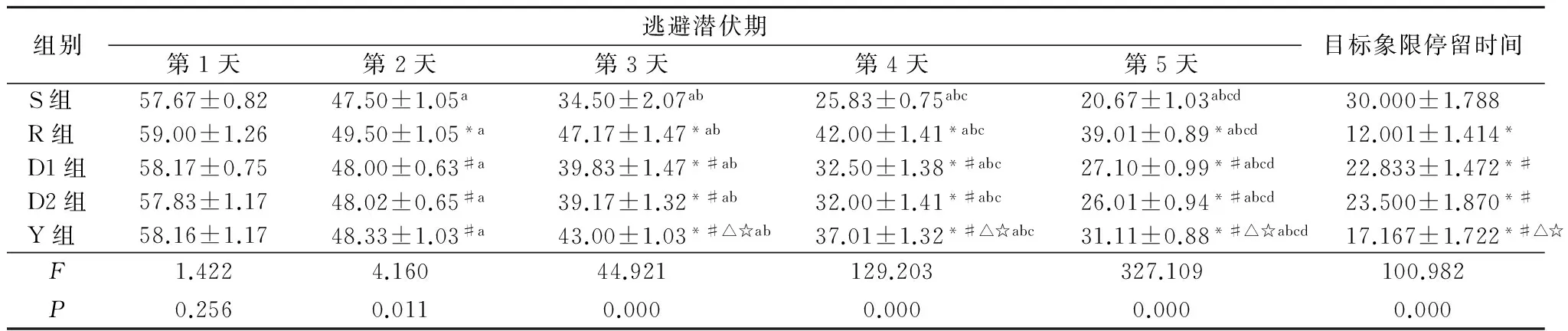
組別逃避潛伏期第1天第2天第3天第4天第5天目標象限停留時間S組 57.67±0.8247.50±1.05a34.50±2.07ab25.83±0.75abc20.67±1.03abcd30.000±1.788R組 59.00±1.2649.50±1.05*a47.17±1.47*ab42.00±1.41*abc39.01±0.89*abcd12.001±1.414*D1組58.17±0.7548.00±0.63#a39.83±1.47*#ab32.50±1.38*#abc27.10±0.99*#abcd22.833±1.472*#D2組57.83±1.1748.02±0.65#a39.17±1.32*#ab32.00±1.41*#abc26.01±0.94*#abcd23.500±1.870*#Y組 58.16±1.1748.33±1.03#a43.00±1.03*#△☆ab37.01±1.32*#△☆abc31.11±0.88*#△☆abcd17.167±1.722*#△☆F1.4224.16044.921129.203327.109100.982P0.2560.0110.0000.0000.0000.000
*P<0.05與S組比較 #P<0.05與R組比較 △P<0.05與D1組比較 ☆P<0.05與D2組比較 aP<0.05與第1天比較 bP<0.05與第2天比較 cP<0.05與第3天比較 dP<0.05與第4天比較(SNK-q檢驗)
3 討 論
臨床統計結果表明新生兒HIE的發病率約為足月嬰兒的2/1 000,早產兒6/1 000[9]。HIE給新生兒帶來嚴重的損害甚至危及生命,主要臨床表現包括肢體麻痹、癲癇、行為異常和神經發育缺陷等。HIE是由于腦組織氧供氧耗嚴重失衡,導致神經細胞死亡和炎性細胞因子釋放導致級聯反應,進一步促進神經細胞凋亡,影響神經功能。目前臨床多采用低溫和支持療法,但其效果十分有限,迫切需要探索有效的神經保護措施和治療藥物,以進一步減少HIE引起的新生兒死亡和嚴重的長期損害[10]。研究表明右美托咪定能夠減輕HIE造成的神經功能損傷,故本研究采用新生大鼠HIE模型缺血缺氧2 h后即刻尾靜脈注射右美托咪定的治療方案,觀察其能否減輕HIE導致的新生大鼠腦損傷以及對長期神經功能的影響。
到目前為止,新生鼠是最常見的圍產期HIE損傷動物模型,其主要優勢是能夠更好地觀察HIE的長期影響。因此,本研究采用新生大鼠HIE模型。本研究中HIE模型組新生大鼠caspase-3表達和神經行為評分明顯高于假手術組,證明本研究HIE模型成功可行。凋亡主要的發生途徑:依賴caspase-3和非依賴caspase-3途徑[11]。有學者研究表明右美托咪定在腦缺血期間和之前應用,具有一定的神經保護作用[12]。同時右美托咪定可以通過血腦屏障激活α2受體,更容易減輕腦損傷,起到神經保護作用。在異氟醚誘導的神經毒性作用的研究中,有學者應用25 μg、50 μg、75 μg右美托咪定,發現右美托咪定能夠改善異氟醚誘導的神經損傷,同時發現3種劑量沒有明顯不同[8]。因此,本研究采用25 μg、50 μg 2種劑量右美托咪定單次給藥,觀察其對HIE模型缺氧2 h后腦神經功能的影響,結果顯示HIE模型缺氧2 h即刻caspase-3和神經功能缺損評分明顯升高,給予25 μg、50 μg右美托咪定均能夠減少caspase-3活化,改善干預后24 h新生大鼠的神經功能,且2種劑量右美托咪定(25 μg 、50 μg)減少caspase-3活化的程度差異無統計學意義。表明應用25 μg、50 μg右美托咪定,能夠改善HIE模型誘導的神經損傷,同時發現2種劑量沒有明顯不同。
本研究發現同時應用育亨賓5 μg和右美托咪定50 μg, caspase-3活化量較單純應用右美托咪定50 μg明顯增加;應用育亨賓5 μg和右美托咪定50 μg干預后24 h,神經功能改善明顯好于HIE模型組,而明顯差于右美托咪定組。育亨賓作為α2受體特異性的阻斷劑,能夠阻斷右美托咪定的α2受體激動作用。本研究結果顯示育亨賓組仍然存在改善神經功能的作用。因此,進一步證明了右美托咪定在新生大鼠HIE模型中發揮的神經保護作用與α2受體有關,但還存在其他作用機制。這與Xiong等[13]的研究相一致。本研究應用Morris水迷宮分別對干預后4周的大鼠進行定位導航和空間探索實驗,進一步分析干預對長期神經行為學和學習記憶的影響,結果顯示各組在訓練的第1~5天逃避潛伏期逐漸縮短,第1天各組逃避潛伏期無明顯差異,第2、3、4、5天,右美托咪定25 μg、50 μg組明顯短于HIE模型組和育亨賓組,而長于假手術組,育亨賓組明顯短于HIE模型組;HIE模型組目標象限停留時間明顯短于右美托咪定25 μg和50 μg組、育亨賓組、假手術組,右美托咪定25 μg、50 μg組停留時間少于假手術組而多于育亨賓組。表明新生大鼠HIE模型導致大鼠4周的行為和學習記憶能力降低,右美托咪定能夠改善HIE長期的神經損傷的影響,改善新生大鼠HIE后的神經功能。本研究的不足之處為僅觀察了右美托咪定2個劑量,應用更多不同劑量觀察右美托咪定的作用有待進一步探討。
總之,右美托咪定25 μg、50 μg能夠減輕新生大鼠HIE的神經凋亡,改善新生大鼠短期、長期的神經功能和學習記憶能力。右美托咪定的神經保護作用與α2受體有關,但還存在其他作用機制。
[1] Liu L,Oza S,Hogan D,et al. Global,regional,and national causes of child mortality in 2000-13,with projections to inform post-2015 priorities:an updated systematic analysis[J]. Lancet,2015,385(9966):430-440.
[2] Shankaran S,Laptook AR,McDonald SA,et al. Acute Perinatal Sentinel Events,Neonatal Brain Injury Pattern,and Outcome of Infants Undergoing a Trial of Hypothermia for Neonatal Hypoxic-Ischemic Encephalopathy[J]. J Pediatr,2017,180:275-278.
[3] Ezzati M,Broad K,Kawano G,et al. Pharmacokinetics of dexmedetomidine combined with therapeutic hypothermia in a piglet asphyxia model[J]. Acta Anaesthesiol Scand,2014,58(6):733-742.
[4] Alam A,Suen KC,Hana Z,et al. Neuroprotection and neurotoxicity in the developing brain:an update on the effects of dexmedetomidine and xenon[J]. Neurotoxicol Teratol,2017,60:102-116.
[5] Ren X,Ma H,Zuo Z. Dexmedetomidine postconditioning reduces brain injury after Brain hypoxia-ischemia in neonatal rats[J]. J Neuroimmune Pharmacol,2016,11(2):238-247.
[6] Wei Y,Hu J,Liang Y,et al. Dexmedetomidine pretreatment attenuates propofol-induced neurotoxicity in neuronal cultures from the rat hippocampus[J]. Mol Med Rep,2016,14(4):3413-3420.
[7] 王琍琍,王楊,宣桂華,等.新生大鼠腦缺氧缺血損傷模型的建立[J].安徽醫科大學學報,2004,39(4):259-261.
[8] Li Y,Zeng M,Chen W,et al. Dexmedetomidine reduces isoflurane-induced neuroapoptosis partly by preserving PI3K/Akt pathway in the hippocampus of neonatal rats[J]. PLoS One,2014,9(4):e93639.
[9] Laptook AR. Birth asphyxia and hypoxic-ischemic brain injury in the preterm infant[J]. Clin Perinatol,2016,43(3):529-545.
[10] Ranchhod SM,Gunn KC,Fowke TM,et al. Potential neuroprotective strategies for perinatal infection and inflammation[J]. Int J Dev Neurosci,2015,45:44-54.
[11] Suh H,Choi KW,Lee J,et al. Effects of a novel carbocyclic analog of pyrrolo[2,3-d] pyrimidine nucleoside on pleiotropic induction of cell death in prostate cancer cells with different androgen responsiveness[J]. Bioorg Med Chem Lett,2016,26(4):1130-1135.
[12] Zhu YM,Wang CC,Chen L,et al. Both PI3K/Akt and ERK1/2 pathways participate in the protection by dexmedetomidine against transient focal cerebral ischemia/reperfusion injury in rats[J]. Brain Res,2013,1494:1-8.
[13] Xiong B,Shi QQ,Miao CH. Dexmedetomidine renders a brain protection on hippocampal formation through inhibition of nNOS-NO signalling in endotoxin-induced shock rats[J]. Brain injury,2014,28(7):1003-1008.
(本文編輯:許卓文)
Effects of dexmedetomidine on neurological function in neonatal rats with hypoxic-ischemic encephalopathy
BO Li-jun1, YU Pei-xia2, HUANG Li-ning1, Xue Hui3, Kang Rong-Tian1*
(1.DepartmentofAnesthesiology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050051,China;2.DepartmentofAnesthesiology,theThirdHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China; 3.DepartmentofAnesthesiology,theForthHospitalofHandan,HebeiProvince,Handan056200,China)
ObjectiveToobservetheeffectofdexmedetomidineonneuronalapoptosisinneonatalratswithcerebralischemiaandhypoxia,andtoexploretheeffectofdexmedemidineonneurologicalfunctionandlong-termlearningandmemoryability.MethodsHypoxic-ischemicencephalopathy(HIE)wasbuiltforthemodelofcerebralischemiaandhypoxia.Ninetyseven-day-old(P7)Sprague-Dawleyratswererandomizedintofivegroups:shamoperationgroup(S),theHIEgroup(R),thedexmedetomidine(25μg/kg)group(D1),thedexmedetomidine(50μg/kg)group(D2),theyohimbinegroup(5μg)(Y).P7ratswereoperatedwithouthypoxiainSgroup,andcontinuedhypoxiafor2hinRgroup.AfterHIE2h,P7ratswerepretreatedwithdifferentconcentrationsofdexmedetomidine(25μg/kg,)inD1group,andpretreatedwithdexmedetomidine(50μg/kg)inD2groupandyohimbine(5μg)inYgroup.After24h,theexpressionofcaspase-3wasdetected.Neurologicaldeficitscoreswereusedtoevaluateneurologicalfunction.For4weeksaftertheintervention,Morriswatermazetestwasusedtoevaluatethechangesinlearningandmemoryability.ResultsHIEinRgroupinducedtheup-regulationofcaspase-3andneurologicaldeficitscores,comparedwithSgroup(P<0.05).Dexmedetomidine(25μg/kg, 50μg/kg)andyohimbinepretreatmentmarkedlydown-regulatedtheexpressionofcaspase-3andneurologicaldeficitscores,comparedwithRgroup(P<0.05).TheescapelatencyofRgroupwasincreasedcomparedwithSgroup,andreducedwithD1,D2,Ygroupat2th,3th,4thand5thdayaftertraining(P<0.05).TheescapelatencyofbothD1andD2groupwerereducedat2th,3th,4thand5thday,andincreasedtimeoftargetquadrantcomparedwithRgroup,andreducedcomparedwithSgroup(P<0.05).Neurologicaldeficitscoresandtheexpressionofcaspase-3weresignificantlyreducedinYgroupcomparedwithD1andD2group(P<0.05).TherewerenotsignificantdifferencesbetweenD1andD2groupinneurologicaldeficitscores,theexpressionofcaspase-3andMorriswatermazetest.ConclusionHIEcausesneuronalapoptosisinthehippocampusofneonatalrats,anddecreasetheabilityoflearningangmemoryinlong-termneonatalrats.Theexpressionofcaspase-3wasinhibitedbydexmedetomidinepretreatment(25μg/kg, 50μg/kg),whichreducedtheapoptosisofneurons.DexmedetomidinetreatmentforneonatalratsduringHIEcouldimprovethelong-termlearningandmemoryabilityofneonatalrats.
hypoxic-ischemic,brain;modes,animal;dexmedetomidine
2017-06-14;
2017-08-18
河北省醫學科學研究重點課題(20150222)
薄立軍(1979-),男,河北唐山人,河北醫科大學第二醫院主治醫師,醫學碩士,從事臨床麻醉學研究。
*通訊作者。E-mail:535498241@qq.com
R735.7
A
1007-3205(2017)09-1068-05
10.3969/j.issn.1007-3205.2017.09.018

