miR-375通過抑制KLF4促進(jìn)前列腺癌細(xì)胞的遷移和侵襲
潘恩山,李煜罡,朱曉光
(南方醫(yī)科大學(xué)中西醫(yī)結(jié)合醫(yī)院泌尿外科,廣州 510315)
miR-375通過抑制KLF4促進(jìn)前列腺癌細(xì)胞的遷移和侵襲
潘恩山,李煜罡,朱曉光
(南方醫(yī)科大學(xué)中西醫(yī)結(jié)合醫(yī)院泌尿外科,廣州 510315)
目的 探討miR-375在前列腺癌(PCa)細(xì)胞中的表達(dá)、作用及機(jī)制。方法 培養(yǎng)細(xì)胞,轉(zhuǎn)染質(zhì)粒,Transwell分析PCa細(xì)胞的遷移和侵襲;qPCR分析miR-375、KLF4 mRNA在PCa細(xì)胞中的表達(dá);Western blot分析KLF4蛋白在PCa細(xì)胞中的表達(dá);生物信息學(xué)分析miR-375的靶基因,雙熒光素酶實驗驗證。結(jié)果 miR-375在PCa中高表達(dá),抑制miR-375的表達(dá)顯著抑制PCa細(xì)胞的遷移和侵襲;通過生物信息學(xué)分析miR-375的潛在靶基因含有KLF4,雙熒光素酶實驗驗證KLF4為miR-375的靶基因;KLF4在PCa細(xì)胞中表達(dá)顯著降低,抑制miR-375的表達(dá)能夠顯著促進(jìn)KLF4蛋白的表達(dá);進(jìn)一步研究表明抑制KLF4表達(dá)可逆轉(zhuǎn)miR-375 抑制物對PCa細(xì)胞的遷移侵襲的抑制作用。結(jié)論 miR-375抑制KLF4的表達(dá)促進(jìn)PCa的遷移和侵襲,發(fā)揮癌基因的作用;其可以作為PCa的治療靶點,為PCa的治療提供新的方向。
miR-375;KLF4;前列腺腫瘤;細(xì)胞運動;腫瘤侵潤
前列腺癌(prostate cancer,PCa)是一種嚴(yán)重威脅男性生命的惡性腫瘤,在美國、歐洲乃至全世界PCa的發(fā)病率在男性惡性腫瘤中排第2位,僅次于肺癌,其導(dǎo)致的死亡排第5位[1]。PCa在中國的發(fā)病率遠(yuǎn)低于西方國家,但是近年來也呈逐年上升的趨勢。據(jù)全國2004-2005年第3次死因回顧抽樣調(diào)查發(fā)現(xiàn),PCa導(dǎo)致的死亡排第13位,其病死率遠(yuǎn)低于世界平均水平,然而與1990-1992年死因調(diào)查結(jié)果相比病死率上升了209.84%;2003-2007 年中國PCa發(fā)病率為8.60/10萬,病死率為3.29/10萬,分別位列第7位和第12位,比2004-2005進(jìn)一步增加[2]。而至2011年調(diào)查發(fā)現(xiàn)PCa在全部癌癥發(fā)病和死亡構(gòu)成進(jìn)一步增加[3]。PCa的發(fā)病可能與生活方式、壽命延長、人口老齡化及前列腺特異性抗原(PSA)早期診斷技術(shù)的提高有關(guān);而PCa的死亡則和初診患者已局部進(jìn)展或遠(yuǎn)處轉(zhuǎn)移,喪失了根治性治療的機(jī)會相關(guān)[4]。由于PCa易發(fā)生遠(yuǎn)處轉(zhuǎn)移,尤其是骨轉(zhuǎn)移,所以尋找抑制PCa轉(zhuǎn)移的治療靶點具有重要的意義。
微RNA(microRNA,miRNA)與PCa的發(fā)生、發(fā)展有著密切的關(guān)系。有研究表明miR-146b、miR-320a等在PCa中表達(dá)下調(diào),過表達(dá)能夠誘導(dǎo)PCa細(xì)胞的凋亡,抑制PCa的增殖、遷移和侵襲,在PCa中發(fā)揮抑癌基因的作用[5-6]。而miR-301a、miR-449a和miR-221等在PCa中表達(dá)上調(diào),抑制其表達(dá)能夠抑制PCa的增殖、遷移和侵襲,在PCa中發(fā)揮癌基因的作用[7-9]。以上研究表明miRNA在PCa中發(fā)揮著癌基因或者抑癌基因的作用,具有很好的穩(wěn)定性和特異性,可以作為潛在的新型腫瘤標(biāo)志物和治療靶點。miR-375是miRNA的一種,有研究表明miR-375在PCa組織中的表達(dá)顯著增加[10],和PCa的發(fā)生、轉(zhuǎn)移密切相關(guān),能夠作為早期診斷的標(biāo)志物[11-12]。miR-375還能通過miR-93/miR-106b/miR-375-CIC-CRABP1信號通路調(diào)節(jié)PCa的增殖[13],但是對miR-375能否調(diào)節(jié)PCa的遷移和侵襲及其機(jī)制仍不清楚。
本研究通過檢測miR-375在PCa細(xì)胞中的表達(dá),明確miR-375在PCa細(xì)胞遷移和侵襲中的作用,同時分析miR-375作用的靶基因及信號通路,探討miR-375調(diào)節(jié)PCa的遷移和侵襲的機(jī)制,為轉(zhuǎn)移的PCa的治療提供理論依據(jù)。
1 材料與方法
1.1 細(xì)胞與主要試劑 人正常前列腺上皮細(xì)胞RWPE-1和PCa細(xì)胞LNCaP、DU145、PC3均購自美國典型培養(yǎng)物保藏中心(ATCC);10%胎牛血清購自美國Gibco公司;RPMI-1640基礎(chǔ)培養(yǎng)基、TRIzol試劑、Lipofectamine RNAi MAX和Lipofectamine 2000、has-miR-375抑制物、has-miR-375 mimic購自美國Invitrogen公司;siRNA-KLF4合成于上海吉瑪制藥技術(shù)有限公司;所有引物購自上海生物工程有限公司;KLF4野生型3′-UTR和突變型3′-UTR由蘇州金唯智合成并連接到psi-CHECK-2載體;TaqMan MicroRNA Reverse Transcription Kit購自美國ABI公司;抗KLF4抗體購自美國Abcam公司;其他生化試劑購自上海生物工程有限公司及Sigma公司。
1.2 方法
1.2.1 細(xì)胞培養(yǎng) RWPE-1、LNCaP、DU145和PC3均在含有10%胎牛血清、100 U/mL 青霉素G和100 μg/mL鏈霉素的RPMI-1640 培養(yǎng)基中37 ℃、5% CO2進(jìn)行培養(yǎng)。當(dāng)細(xì)胞融合度大約為80%時用胰酶消化進(jìn)行傳代。
1.2.2 載體構(gòu)建及轉(zhuǎn)染 將處于對數(shù)生長期的PCa細(xì)胞種植于6孔培養(yǎng)板中(每孔大約1×105個細(xì)胞),第2天觀察細(xì)胞融合度大約為50%時開始進(jìn)行轉(zhuǎn)染。采用Lipofectamine RNAi MAX分別轉(zhuǎn)染300 nmol/L miR-NC、miR-375抑制物至PCa細(xì)胞,或者共轉(zhuǎn)染300 nmol/L miR-375抑制物和10 μmol/L siRNA-KLF4或者si-NC至PCa細(xì)胞,轉(zhuǎn)染步驟參照Lipofectamine RNAi MAX說明書。
1.2.3 實時熒光定量PCR(qPCR)檢測miRNA及相應(yīng)基因miRNA表達(dá) 收集細(xì)胞樣品,加入1 mL Trizol提取液提取細(xì)胞總RNA。逆轉(zhuǎn)錄采用TaqMan MicroRNA Reverse Transcription Kit;cDNA逆轉(zhuǎn)錄采用TaqMan Reverse Transcription Reagents、200 ng總RNA及Oligo dT;操作嚴(yán)格按照試劑操作說明書。采用SYBR Green法用于qPCR檢測。反應(yīng)體系為:cDNA 5.0 μL,上游引物 0.5 μL,下游引物 0.5 μL,2×SYBR Green PCR Master Mix 10 μL,ddH2O 4.0 μL,總反應(yīng)體積為 20 μL。PCR 擴(kuò)增條件為:94 ℃預(yù)變性5 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min 30 s,進(jìn)行40個循環(huán)。相對表達(dá)水平采用2-ΔΔCt進(jìn)行計算。每份樣品重復(fù)測量3次。檢測引物見表1。

表1 qRT-PCR檢測引物序列
1.2.4 Western blot檢測 12 000 r/min離心10 min收集細(xì)胞,吸凈上清后留沉淀。沉淀中直接加入細(xì)胞裂解液,冰上充分裂解。BCA法測定總蛋白濃度,10% 十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳分離蛋白,電泳結(jié)束后取出分離膠進(jìn)行轉(zhuǎn)膜,加入轉(zhuǎn)膜緩沖液,恒定電流0.5 A轉(zhuǎn)膜2 h。室溫下,將聚偏氟乙烯(PVDF)膜放入5%脫脂奶粉中封閉1 h。然后將PVDF膜放入10 mL稀釋過的抗KLF4抗體(1∶2 000)中4 ℃過夜。去除抗KLF4抗體,30 mL 1×TBST洗膜3次,每次5 min。加入10 mL稀釋的辣根過氧化物酶標(biāo)記的二抗(1∶5 000),室溫孵育2 h。30 mL 1×TBST洗膜3次,每次5 min,暗室進(jìn)行曝光。灰度采用Image J分析。
1.2.5 細(xì)胞遷移和侵襲檢測 PCa的遷移檢測:將Transwell侵襲小室置入24孔板中,在Transwell小室的下室加入含10% 胎牛血清的RPMI-1640培養(yǎng)基,收集轉(zhuǎn)染后的PCa細(xì)胞重懸,加入200 μL重懸液(共5×104個細(xì)胞)到Transwell小室的上室;細(xì)胞培養(yǎng)24 h,取出小室,用棉簽將上室內(nèi)部擦干凈,小室的下表面用PBS浸泡清洗。首先以4%多聚甲醛溶液固定細(xì)胞,然后0.1%結(jié)晶紫染色液染色,自來水沖洗3次,顯微鏡下拍照,并隨機(jī)選取6個不同區(qū)域,計算每個視野內(nèi)穿過濾膜的細(xì)胞數(shù),取平均數(shù)為遷移細(xì)胞數(shù)。PCa的侵襲檢測:首先在孔徑為8 μm的Transwell侵襲小室微孔膜表面均勾涂抹20 μL 0.5 g/L Matrigel人工基質(zhì)膠,37 ℃放置30 min使其聚成凝膠狀。其余操作步驟同遷移檢測。
1.2.6 雙熒光素酶實驗檢測靶基因 miR-375使用預(yù)測軟件miRDB(http://www.mirdb.org/miRDB/)和Targetscan(http://www.targetscan.org)進(jìn)行靶基因預(yù)測,發(fā)現(xiàn)KLF4 mRNA可能為miR-375的靶基因。為了確定KLF4 mRNA的3′-UTR是否為miR-375的直接靶蛋白,KLF4 mRNA的野生型全長3′-UTR 及突變型3′-UTR合成并連接到psi-CHECK-2載體,分別命名為KLF4-WT和KLF4-MUT。PCa細(xì)胞共轉(zhuǎn)染200 nmol/L miR-NC或miR-375抑制物和100 ng質(zhì)粒(KLF4-WT或者KLF4-MUT),24孔板培養(yǎng)48 h。收集細(xì)胞裂解,海腎(Renilla)和螢火蟲(firefly)熒光素酶熒光強(qiáng)度使用Dual-Luciferase雙熒光報告分析系統(tǒng)進(jìn)行分析。
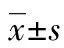
2 結(jié) 果
2.1 miR-375在PCa細(xì)胞中的表達(dá) 采用qPCR檢測miR-375在PCa細(xì)胞中的表達(dá)。miR-375在正常前列腺細(xì)胞RWPE-1及PCa細(xì)胞LNCaP、PC3和DU145中的相對表達(dá)量分別為1.000±0.000、2.580±0.376、3.760±0.428和6.210±0.573,單因素方差分析結(jié)果顯示差異有統(tǒng)計學(xué)意義(P<0.05)。和RWPE-1相比,LNCaP、PC3和DU145中miR-375表達(dá)顯著升高,差異有統(tǒng)計學(xué)意義(P<0.05)。其中以DU145中miR-375表達(dá)量最高,采用DU145作為實驗細(xì)胞進(jìn)行后續(xù)實驗。見圖1。

a:P<0.05,與RWPE-1比較。
圖1 miR-375在RWPE-1、LNCaP、PC3和DU145中的表達(dá)
2.2 miR-375抑制物降低miR-375的表達(dá) 采用qPCR檢測miR-375抑制物對miR-375在DU145中表達(dá)的影響,結(jié)果圖2所示。miR-375在Si-NC組和miR-375抑制物組中的相對表達(dá)量分別為1.000±0.000和0.240±0.088,與Si-NC組比較,miR-375抑制物組中miR-375表達(dá)明顯降低,差異有統(tǒng)計學(xué)意義(P<0.05)。miR-375抑制物能夠顯著降低miR-375在DU145中的表達(dá)。
2.3 miR-375抑制物抑制DU145細(xì)胞的遷移侵襲 Si-NC和miR-375抑制物轉(zhuǎn)染48 h后采用Transwell檢測DU145細(xì)胞的遷移和侵襲能力,圖3所示。Si-NC組和miR-375抑制物組的遷移細(xì)胞數(shù)分別(355±78)個和(168±43)個,與Si-NC組比較,miR-375抑制物組遷移細(xì)胞數(shù)明顯減少,差異有統(tǒng)計學(xué)意義(P<0.05);表明抑制miR-375的表達(dá)能夠抑制DU145的遷移。進(jìn)一步研究發(fā)現(xiàn)Si-NC組和miR-375抑制物組的侵襲細(xì)胞數(shù)分別(223±45)個和(110±26)個,與Si-NC組比較,miR-375抑制物組侵襲細(xì)胞數(shù)明顯減少,差異有統(tǒng)計學(xué)意義(P<0.05)。表明抑制miR-375的表達(dá)能夠抑制DU145的侵襲。

a:P<0.05
圖2 miR-375抑制物抑制miR-375的表達(dá)

a:P<0.05
圖3 miR-375抑制物抑制DU145細(xì)胞的遷移侵襲

A:生物信息學(xué)分析KLF4 mRNA 3′UTR存在的miR-375結(jié)合位點;B:Western blot檢測KLF4在PCa細(xì)胞中的表達(dá),a表示P<0.05(與RWPE-I比較);C:KLF4-WT組和KLF4-MUT組的熒光素酶相對活性檢測,a表示P<0.05;D:Western blot檢測KLF4-WT+miR-NC和KLF4-WT+miR-375組KLF4蛋白表達(dá);E:qPCR檢測KLF4-WT+miR-NC和KLF4-WT+miR-375組KLF4 mRNA表達(dá)
圖4 在DU145細(xì)胞中驗證KLF4為miR-375的靶基因
2.4 miR-375的靶基因為KLF4 通過軟件預(yù)測發(fā)現(xiàn)KLF4可能是miR-375的潛在靶基因,結(jié)果如圖4A所示。采用Western blot檢測KLF4在PCa細(xì)胞中的表達(dá),結(jié)果如圖4B所示。KLF4在正常前列腺細(xì)胞RWPE-1及PCa細(xì)胞LNCaP、PC3和DU145中的相對表達(dá)量分別為1.000±0.000、0.530±0.076、0.389±0.042和0.210±0.043,單因素方差分析結(jié)果顯示差異有統(tǒng)計學(xué)意義(P<0.05)。與RWPE-1比較,LNCaP、PC3和DU145中KLF4的表達(dá)顯著降低,差異有統(tǒng)計學(xué)意義(P<0.05)。miR-375和KLF4的表達(dá)趨勢相反,說明KLF4可能被miR-375負(fù)調(diào)控。為了進(jìn)一步證明KLF4是miR-375的靶基因,采用雙熒光素酶實驗檢測,結(jié)果如圖4C所示。KLF4-WT+miR-NC組和KLF4-WT+miR-375組的熒光活性變化倍數(shù)分別為1.000±0.000和0.240±0.085,兩者比較差異有統(tǒng)計學(xué)意義(P<0.05)。KLF4-MUT+miR-NC及KLF4-MUT+miR-375組的熒光活性變化倍數(shù)分別為0.930±0.052 和0.890±0.095,兩者比較差異無統(tǒng)計學(xué)意義(P>0.05)。同時采用qPCR檢測KLF4-WT+miR-NC組和KLF4-WT+miR-375組的KLF4 mRNA分別為1.000±0.000和0.940±0.054,兩者相比差異無統(tǒng)計學(xué)意義(P>0.05),結(jié)果如圖4E所示。同時采用Western blot 檢測KLF4-WT+miR-NC組和KLF4-WT+miR-375組的表達(dá)發(fā)現(xiàn)KLF4蛋白表達(dá)顯著降低,結(jié)果如圖4D所示。以上數(shù)據(jù)說明miR-375可與KLF4的3′-UTR區(qū)上的位點結(jié)合,miR-375與KLF4存在直接調(diào)控關(guān)系。
2.5 抑制KLF4表達(dá)能夠逆轉(zhuǎn)miR-375抑制物對DU145細(xì)胞的遷移侵襲的抑制作用 本研究發(fā)現(xiàn)miR-375抑制物能夠促進(jìn)KLF4的表達(dá),結(jié)果如圖5所示。為了進(jìn)一步研究miR-375和KLF4的關(guān)系,本研究在轉(zhuǎn)染miR-375抑制物的同時轉(zhuǎn)染si-KLF4,抑制KLF4的表達(dá),分析共轉(zhuǎn)染miR-375抑制物和si-KLF4對DU145細(xì)胞的遷移侵襲的影響。共轉(zhuǎn)染miR-375抑制物和si-KLF4能夠顯著降低KLF4的表達(dá),結(jié)果如圖5B所示。共轉(zhuǎn)染48 h后采用Transwell檢測DU145細(xì)胞的遷移和侵襲能力。miR-375抑制物+si-NC組和miR-375抑制物+si-KLF4組的遷移細(xì)胞數(shù)分別(141±47)個和(325±78)個,結(jié)果如圖6A~C所示。miR-375抑制物+si-NC組和miR-375抑制物+si-KLF4組的侵襲細(xì)胞數(shù)分別(123±31)個和(256±48)個,結(jié)果如圖6D~F所示。和miR-375抑制物+si-NC組相比,miR-375抑制物+si-KLF4組遷移侵襲細(xì)胞數(shù)明顯增加,差異有統(tǒng)計學(xué)意義(P<0.05)。抑制KLF4的表達(dá)能夠逆轉(zhuǎn)miR-375抑制物對DU145細(xì)胞的遷移侵襲的抑制作用。

A:Western blot檢測miR-NC和miR-375抑制物組KLF4的表達(dá);B:Western blot檢測共轉(zhuǎn)染miR-375抑制物和si-KLF4(或Si-NC)組KLF4的表達(dá),a:P<0.05
圖5 不同組的KLF4表達(dá)

A~C:細(xì)胞遷移實驗;D~F:細(xì)胞侵襲實驗
圖6 抑制KLF4表達(dá)能夠逆轉(zhuǎn)miR-375抑制物對DU145細(xì)胞的遷移侵襲的抑制作用
3 討 論
本研究結(jié)果表明miR-375在PCa細(xì)胞中的表達(dá)顯著升高,和以往的研究相同[11]。同時本研究結(jié)果表明miR-375在DU145細(xì)胞中表達(dá)比其他PCa細(xì)胞PC3和LNCaP中的表達(dá)高,根據(jù)文獻(xiàn)報道,這3種細(xì)胞的轉(zhuǎn)移能力從小到大依次為LNCaP、PC3和DU145細(xì)胞,該結(jié)果說明miR-375的表達(dá)和PCa的遷移和侵襲存在關(guān)系,和Nguyen等[14]研究的結(jié)果類似,其結(jié)果表明miR-375在高轉(zhuǎn)移PCa組織中表達(dá)最高,其次為低轉(zhuǎn)移PCa和未轉(zhuǎn)移PCa。
miR-375在癌癥的發(fā)生、發(fā)展過程中可能扮演癌基因或者抑癌基因的作用。Shi等[15]研究表明在骨肉瘤中miR-375能夠通過抑制PIK3CA從而抑制PI3K/AKT信號通路,抑制骨肉瘤細(xì)胞的增殖,扮演抑癌基因的角色。在結(jié)腸癌中,有研究表明miR-375能夠抑制KLF4的表達(dá)從而抑制結(jié)腸癌細(xì)胞的增殖[16],而另有研究表明miR-375能夠抑制PHLPP1的表達(dá)從而促進(jìn)結(jié)腸癌細(xì)胞的西妥昔單抗耐藥性[17]。miR-375在PCa中能夠抑制PCa細(xì)胞的增殖[13,18],但是對遷移和侵襲的作用還不清楚。本研究結(jié)果表明miR-375抑制物能夠顯著抑制miR-375的表達(dá),抑制miR-375的表達(dá)能夠顯著抑制PCa細(xì)胞的遷移和侵襲。從該結(jié)果來看,miR-375在PCa中發(fā)揮癌基因的作用。
為了進(jìn)一步了解miR-375在PCa中發(fā)揮癌基因的作用機(jī)制,本研究通過生物信息學(xué)分析表明KLF4為miR-375的潛在的作用靶點。為了驗證該分析,本研究采用雙熒光素酶分析驗證,結(jié)果表明miR-375+KLF4-WT組的相對熒光素酶活性顯著抑制而miR-375+KLF4-MUT組的相對熒光素酶活性無顯著變化,這表明miR-375和KLF4 3′ UTR之間存在相互聯(lián)系;進(jìn)一步分析發(fā)現(xiàn)miR-375+KLF4-WT組的KLF4 mRNA無顯著變化,而KLF4的蛋白表達(dá)顯著降低,說明miR-375不影響KLF4的mRNA水平,而是直接影響KLF4的翻譯。該結(jié)果表明在PCa細(xì)胞中KLF4是miR-375作用的靶基因。有研究表明在結(jié)腸癌中KLF4是miR-375作用的靶基因,影響結(jié)腸癌的增殖[16]。
KLF4在生物體中有著廣泛的功能,在腫瘤中發(fā)揮著癌基因或者抑癌基因的作用。在結(jié)腸癌、胃癌及肝癌等癌癥中發(fā)現(xiàn)KLF4表達(dá)降低,而在原發(fā)性乳腺導(dǎo)管癌、口腔鱗癌中KLF4的表達(dá)升高。Li等通過研究證實KLF4對皮膚癌細(xì)胞的增殖、遷移和黏附能力具有抑制作用,KLF4在皮膚癌中可能是一個抑癌基因[19]。在肝癌中,KLF4通過結(jié)合其他轉(zhuǎn)錄抑制因子共同抑制Slug的轉(zhuǎn)錄,調(diào)節(jié)細(xì)胞上表皮間質(zhì)化(EMT)進(jìn)程,抑制肝癌細(xì)胞的遷移和侵襲能力并發(fā)揮其抑癌作用[20]。在乳腺癌中,KLF4高表達(dá)進(jìn)而調(diào)節(jié)靶基因的表達(dá),最終影響細(xì)胞增殖及凋亡,并促發(fā)腫瘤的形成,發(fā)揮癌基因的作用[21]。本研究表明在PCa中miR-375能夠抑制KLF4的表達(dá),尤其在高轉(zhuǎn)移的PCa細(xì)胞DU145中,KLF4表達(dá)顯著降低。抑制miR-375表達(dá)能夠促進(jìn)KLF4的表達(dá)。抑制miR-375表達(dá)的同時抑制KLF4的表達(dá)能夠促進(jìn)PCa的遷移和侵襲,表明抑制KLF4的表達(dá)能夠促進(jìn)PCa的遷移和侵襲。Wang等[22]研究表明KLF4能夠抑制PCa的增殖、遷移和侵襲。另有研究表明,抑制KLF4的表達(dá)能夠促進(jìn)PCa細(xì)胞的遷移和侵襲[23],與本研究結(jié)果類似。
總之,本研究表明miR-375能夠抑制KLF4的表達(dá)促進(jìn)PCa的遷移和侵襲,發(fā)揮癌基因的作用。本研究進(jìn)一步表明miR-375可以作為PCa的治療靶點,為PCa轉(zhuǎn)移的治療提供新的方向。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]韓仁強(qiáng),武鳴,陳萬青,等.2003~2007年中國前列腺癌發(fā)病與死亡分析[J].中國腫瘤,2012,21(11):805-811.
[3]Chen W,Zheng R,Zeng H,et al.Annual report on status of cancer in china,2011[J].Chin J Cancer Res,2015,27(1):2-12.
[4]楊培謙.前列腺癌流行病學(xué)概述[J].中國醫(yī)刊,2010,18(10):11-13.
[5]Ding HY,Qian WQ,Xu J.Microrna-146b acts as a potential tumor suppressor in human prostate cancer[J].J Buon,2016,21(2):434-443.
[6]Okato A,Goto Y,Kurozumi A,et al.Direct regulation of lamp1 by tumor-suppressive microrna-320a in prostate cancer[J].Int J Oncol,2016,16(10):111-122.
[7]Damodaran C,Das TP,Papu John AM,et al.Mir-301a expression:A prognostic marker for prostate cancer[J].Urol Oncol,2016,234(6):e13-336,e20.
[8]常征,張愛民,郝俊文.miR-221通過作用DVL2影響前列腺癌細(xì)胞系的侵襲功能[J].中國現(xiàn)代醫(yī)學(xué)雜志,2012,22(27):8-14.
[9]Mao A,Zhao Q,Zhou X,et al.Microrna-449a enhances radiosensitivity by downregulation of c-myc in prostate cancer cells[J].Sci Rep,2016,6:27346.
[10]Selth LA,Townley S,Gillis JL,et al.Discovery of circulating microRNAs associated with human prostate cancer using a mouse model of disease[J].Int J Cancer,2012,131(3):652-661.
[11]Gao Y,Guo Y,Wang Z,et al.Analysis of circulating miRNA 21 and 375 as potential biomarkers for early diagnosis of prostate cancer[J].Neoplasma,2016;63(4):623-628.
[12]Bryant RJ,Pawlowski T,Catto JW,et al.Changes in circulating microrna levels associated with prostate cancer[J].Br J Cancer,2012,106(4):768-774.
[13]Choi N,Park J,Lee JS,et al.Mir-93/mir-106b/mir-375-cic-crabp1:A novel regulatory axis in prostate cancer progression[J].Oncotarget,2015,6(27):23533-23547.
[14]Nguyen HC,Xie W,Yang M,et al.Expression differences of circulating micrornas in metastatic castration resistant prostate cancer and low-risk,localized prostate cancer[J].Prostate,2013,73(4):346-354.
[15]Shi ZC,Chu XR,Wu YG,et al.Microrna-375 functions as a tumor suppressor in osteosarcoma by targeting pik3ca[J].Tumour Biol,2015,36(11):8579-8584.
[16]Mao Q,Quan T,Luo B,et al.Mir-375 targets klf4 and impacts the proliferation of colorectal carcinoma[J].Tumour Biol,2016,37(1):463-471.
[17]Mussnich P,Rosa R,Bianco R,et al.Mir-199a-5p and mir-375 affect colon cancer cell sensitivity to cetuximab by targeting phlpp1[J].Expert Opin Ther Targets,2015,19(8):1017-1026.
[18]Selth LA,Das R,Townley SL,et al.A zeb1-mir-375-yap1 pathway regulates epithelial plasticity in prostate cancer[J].Oncogene,2016,6(10):185.
[19]Li J,Zheng H,Yu F,et al.Deficiency of the kruppel-like factor klf4 correlates with increased cell proliferation and enhanced skin tumorigenesis[J].Carcinogenesis,2012,33(6):1239-1246.
[20]Lin ZS,Chu HC,Yen YC,et al.Kruppel-like factor 4,a tumor suppressor in hepatocellular carcinoma cells reverts epithelial mesenchymal transition by suppressing slug expression[J].PLoS One,2012,7(8):24.
[21]Hu D,Zhou Z,Davidson NE,et al.Novel insight into klf4 proteolytic regulation in estrogen receptor signaling and breast carcinogenesis[J].J Biol Chem,2012,287(17):13584-13597.
[22]Wang J,Place RF,Huang V,et al.Prognostic value and function of klf4 in prostate cancer:Rnaa and vector-mediated overexpression identify klf4 as an inhibitor of tumor cell growth and migration[J].Cancer Res,2010,70(24):10182-10191.
[23]Na XY,Liu ZY,Ren PP,et al.Long non-coding rna uca1 contributes to the progression of prostate cancer and regulates proliferation through klf4-krt6/13 signaling pathway[J].Int J Clin Exp Med,2015,8(8):12609-12616.
miR-375 promotes prostate cancer cell migration and invasion by targeting KLF4
PanEnshan,LiYugang,ZhuXiaoguang
(DepartmentofUrology,TCM-IntegratedCancerofSouthernMedicalUniversity,Guangzhou,Guandong510315,China)
Objective To explore the expression,role and mechanism of miR-375 in prostate cancer (PCa) cells.Methods PCa cells were cultured and transfected with plasmid,the migration and invasion of PCa were detected by Transwell;the expression of miR-375 and KLF4 mRNA were detected by qPCR;the expression of KLF4 were detect by Western blot;the potential target genes of miR-375 were analyzed by bioinformatics and verified by dual luciferase report.Results The expression of miR-375 were significantly up-regulated in the PCa;Inhibited the expression of miR-375 could significantly inhibit the migration and invasion of PCa cells.KLF4 was the potential target genes of miR-375,which verified through bioinformatics analysis and dual luciferase report.The expression of KLF4 were significantly down-regulated in the PCa.Inhibited the expression of miR-375 could significantly up-regulated the expression of KLF4.Inhibited the KLF4 expression was able to reverse the suppressive effect miR-375 has on the migration and invasion of PCa cells.Conclusion miR-375 promotes the migration and invasion of PCa via inhibiting the expression of KLF4 and play the oncogene role.MiR-375 can be used as therapeutic targets for PCa,and provide a new direction for the treatment of PCa.
microRNA 375;KLF4;prostatic neoplasms;cell movement;neoplasm invasiveness
潘恩山(1979-),主治醫(yī)師,博士,主要從事中西醫(yī)結(jié)合治療泌尿男性疾病研究。
10.3969/j.issn.1671-8348.2017.23.005
R737.25
A
1671-8348(2017)23-3184-05
2017-03-28
2017-05-19)
論著·基礎(chǔ)研究

