siRNA干擾膜聯蛋白AI表達對甲狀腺乳頭狀癌TPC-1細胞凋亡的影響
鐘雪梅,林一民,周 源,鄧世山,丁 浩
(1.重慶醫藥高等專科學校臨床醫學院 401331;2.重慶市腫瘤研究所檢驗科 400030;3.川北醫學院基礎醫學院,四川南充 637000)
siRNA干擾膜聯蛋白AI表達對甲狀腺乳頭狀癌TPC-1細胞凋亡的影響
鐘雪梅1,林一民2△,周 源1,鄧世山3,丁 浩1
(1.重慶醫藥高等專科學校臨床醫學院 401331;2.重慶市腫瘤研究所檢驗科 400030;3.川北醫學院基礎醫學院,四川南充 637000)
目的 通過小干擾RNAs(siRNA)干擾膜聯蛋白A1(ANX A1)在甲狀腺乳頭狀癌(PTC)細胞中的表達,探討ANX A1對PTC細胞的生物學特性的影響。方法 設計并篩選使用高效的siRNA在PTC TPC-1細胞株特異性干擾ANX A1的表達,然后用流式細胞術觀察ANX A1干擾后對PTC細胞TPC-1凋亡的影響。結果 篩選的siRNA可高效沉默ANX A1在PTC細胞中的表達,促進PTC細胞的凋亡。結論 siRNA干擾ANX A1表達,可促進PTC細胞的凋亡,提示ANX A1可能是PTC治療的一個重要的生物學靶標。
甲狀腺腫瘤;乳頭狀瘤;膜聯蛋白A1;TPC-1細胞;RNA,小分子干擾;凋亡
甲狀腺癌(thyroid cancer,TC) 是內分泌系統常見腫瘤,發病率在頭頸部惡性腫瘤中居首位。而甲狀腺乳頭狀癌(papillary thyroid carcinoma,PTC)的發病率約占所有甲狀腺癌發病類型的80%以上[1]。臨床上PTC常表現為甲狀腺結節,但由于甲狀腺結節構成復雜,良惡性很難鑒別,易過度治療。研究表明,對不確定惡性患者的術后病理發現,僅20%~25%為甲狀腺癌,另75%~80%的患者則接受了不必要的甲狀腺手術[2]。2016年,《美國醫學會雜志》已經將包裹性濾泡型PTC改稱為“腫瘤”,雖然目前還沒有標準化診治規范,但診斷性甲狀腺切除的概率會減少[3]。為此,需探索新的生物學靶標和診治方法。膜聯蛋白(annexins,ANX)是一類鈣依賴性、能夠結合帶負電荷膜磷脂的蛋白超家族,是一種高豐度蛋白,而ANX A1是第一個被發現的家族成員,它主要介導細胞內糖皮質激素抗炎作用的效應分子,與細胞增殖、細胞凋亡的信號傳導及腫瘤發生的機制都密切相關[4]。筆者的前期實驗也發現,ANX A1在PTC原發灶、轉移灶的表達明顯高于癌旁正常組織,且與淋巴結轉移和腫瘤大小相關[5]。因此,深入研究ANX A1在PTC中的作用是非常必要的。
雙鏈小干擾RNA(small interfecting RNA,siRNA)由21~25個核苷酸組成,能引起RNA的干擾和抑制靶蛋白的表達[6-7]。為進一步明確ANX A1在PTC中的作用,本研究擬使用siRNA干擾ANX A1的表達,觀察其對PTC細胞株TPC-1細胞的增殖、凋亡的生物學影響,從而進一步探討ANX A1在PTC發生、發展中的作用。
1 材料與方法
1.1 主要材料及儀器 RPMI-1640培養基(HyClone公司);脂質體Lipofectamine2000(Invitrogen公司);RNA提取試劑盒(TaKaRa公司);PCR儀、凝膠圖像系統、酶標儀(Bio-Rad公司);流式細胞儀(BD公司)。
1.2 方法
1.2.1 細胞培養 TPC-1細胞購自深圳百恩維生物公司,細胞在生長至90%匯合度時進行傳代,在含10%~15%的胎牛血清的RPMI-1640培養基中,5% CO2、37 ℃恒溫孵箱內培養。
1.2.2 ANX A1 siRNA設計 使用Version2.0軟件設計出針對ANX A1基因的特異性片段3對及無關序列siRNA片段1對。以上siRNA由廣州銳博生物科技有限公司復核并合成。
1.2.3 細胞轉染 將TPC-1細胞以4.5×105~5.0×105個/孔的密度接種于6孔板生長24 h,使其生長至80%匯合度或剛好鋪滿培養板且處于對數生長期進行轉染。根據Lipfectamine2000(Invitrogen美國)說明書操作,將帶有熒光標記的siRNA轉染至TPC-1細胞內。實驗分為:實驗組(分別轉染3對siRNA)、陰性對照組(轉染無關序列siRNA)和空白組(不轉染)及脂質體組,其中實驗組又包括ANX A1-siRNA1組、ANX A1-siRNA2組、ANX A1-siRNA3組。
1.2.4 半定量逆轉錄PCR(RT-PCR) 在GeneBank中檢索出人ANX A1和β-actin全長序列,用 Oligo6.0軟件分別設計引物,將逆轉錄所得的cDNA模板進行PCR擴增反應,以β-actin為內參對照。反應條件:預變性94 ℃ 5 min;變性94 ℃ 30 s,退火 56 ℃ 30 s, 72 ℃ 45 s,30個循環;72 ℃延伸10 min。PCR反應結束后4 ℃保存。將PCR擴增產物及DNA marker在1.0%~1.5%的瓊脂糖凝膠上電泳,嗅氛藍染色,在凝膠成像系統上觀察擴增的條帶,采集圖片后,用圖像分析軟件PDQuest進行分析,測量灰度值,計算mRNA的相對表達量。
1.2.5 細胞凋亡檢測 根據Annexin V-異硫氰酸熒光素(FITC)/碘化丙啶(PI)雙染細胞凋亡檢測試劑盒說明書操作:將細胞以1×105~2×105接種于6孔板,轉染72 h后收集約1×105個細胞,加入500 μL Binding Buffer懸浮細胞,TPC-1細胞懸液中先加入5 μL Annexin V-FITC室溫孵育5 min后再加入5 μL PI 雙染混合液混勻,室溫避光反應15~20 min,1 h內進行流式細胞儀的檢測。數據結果的分析與統計用軟件為WinMDI2.9。

表1 目的基因上、下游引物及產物大小
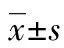
2 結 果
2.1 轉染效率 分別細胞轉染于轉染24、48、72 h后在熒光顯微鏡下觀察轉染情況,計數轉染熒光陽性的細胞,估算轉染效率,在48~72 h轉染效率達80%以上。見圖1。
A:ANX A1-siRNA3組;B:陰性對照組;C:空白組
圖1 TPC-1細胞轉染24 h后熒光顯微鏡下圖像(×200)
2.2 RT-PCR檢測各組ANX A1 mRNA表達情況 各組TPC-1細胞中ANX A1 mRNA的比較,RT-PCR結果表明,轉染72 h后,ANX A1基因的PCR擴增產物經電泳及凝膠成像后,由PDQuest軟件分析ANX A1/β-actin的比值:ANX A1-siRNA1組、ANX A1-siRNA2組、ANX A1-siRNA3組基因mRNA表達水平分別為0.51±0.11、 0.49±0.08、0.41±0.14,空白組、脂質體組及陰性對照組的基因mRNA表達水平分別為1.34+0.17、1.15+0.10、1.25+0.18 。各實驗組mRAN表達水平較其他組明顯下降(P<0.05),其中,ANX A1-siRNA3組下降最明顯。而空白組、脂質體組及陰性對照組的基因mRNA表達無明顯變化,差異無統計學意義(P>0.05)。見圖2。
2.3 凋亡能力 siRNA干擾ANX A1基因后對TPC-1細胞凋亡能力的影響:轉染72 h后,ANX A1-siRNA3組細胞凋亡率為 (18.93±1.16)% ,而陰性對照組和空白組的細胞凋亡率分別為(6.04±0.72)%、(5.19±0.65)%,ANX A1-siRNA3組與陰性對照組和空白組比較凋亡增加,差異有統計學意義(P<0.05),而陰性對照組與空白組比較差異無統計學意義(P>0.05)。見圖3。
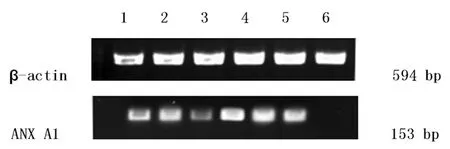
1、2、3分別為ANX A1-siRNA1、2、3組;4:陰性對照組;5:空白組;6:脂質體組
圖2 RT-PCR檢測ANX A1基因mRNA的表達

A:ANX A1-siRNA3組;B:陰性對照組;C:空白組。
圖3 Annexin A1基因對甲狀腺乳頭狀癌TPC-1細胞凋亡率的影響
3 討 論
PTC是TC的最常見類型。PTC的治療方法有藥物治療、手術治療、放射治療、放射性131I治療、甲狀腺激素(TSH)抑制治療、靶向治療等[8]。PTC雖然惡性程度較低、生存期長,但易轉移和復發,其中尤以手術導致的喉返神經損傷引起聲音嘶啞、呼吸困難甚至窒息等為甲狀腺手術的嚴重并發癥。因此,深入探討如何提高PTC的療效,改善患者的生活質量具有重要的臨床價值。PTC的發生不僅僅由環境、電離輻射等因素引起,更是多基因、多通路、多因素共同調控的結果。其中,多基因調控如已知的有 BRAF、RAS、RET/PTC 癌基因,多通路則包括磷酸肌醇(-3)激酶(PI3K)/AKT信號通路和絲裂原活化蛋白激酶(MAPK)信號通路等。ANX A1是一類鈣依賴型、高豐度蛋白,與細胞增殖、細胞凋亡的信號傳導及腫瘤發生機制密切相關。目前,關于ANX A1的研究已成為腫瘤治療領域的熱點。ANX A1與組織學不同類型的肺癌關聯,它在肺腺癌和小細胞肺癌表達比在肺鱗癌更豐富[9];研究還發現ANX A1在直結腸癌中表達上調,可促進結腸癌的發生[10]。ANX A1蛋白的周期調控,參與惡性腫瘤的發生和發展過程可能與ANX A1和酪氨酸蛋白激酶的底物結合,且有多個磷酸化位點,參與細胞內信號傳遞有關[11]。 ANX A1也參與MAPK信號通路傳導、基因轉錄因子激活及各種生長因子蛋白結合等,引發一系列反應,導致細胞增殖、凋亡細胞分化和炎性反應[12]。故猜測ANX A1與PTC的發生有一定程度的關聯性。
目前,關于ANX A1與PTC關系研究的文獻,國內外報道極少,國內已有ANX A2在TC中及PTC中的表達及意義的研究。國外有關于ANX A1在TC類組織中的表達情況研究,包括乳頭狀癌、濾泡狀癌、未分化癌。但都是僅研究了表達情況,未做進一步基因阻低試驗[13]。還有關于ANX A1在甲狀腺未分化癌中的基因阻低試驗[14],但也未見ANX A1與PTC的阻低試驗的報道。
本實驗前期的研究發現,ANX A1蛋白在PTC組織及淋巴結轉移組織中高表達,在癌旁正常組織中低表達,并與淋巴結轉移和腫瘤大小相關。也提示了ANX A1與PTC發生的相關性。這為ANX A1在PTC的分子診斷、治療方法、療效及預后評估上的研究提供了很好的著眼點,抑制ANX A1基因功能是否影響PTC的生物學特性成為本次研究的目的。研究也證明,ANX A1在腫瘤的發生、發展中有很重要的作用,通過干擾其活性顯示很好的抑制小細胞肺癌的效果[15]。分子靶向治療PTC顯示出一定的治療前景,如索拉菲尼、舒尼替尼靶向血管內皮生長因子(VEGF)通道,小分子多靶點酪酸激酶抑制劑凡德他尼等。但這些靶向治療也存在一些不足,如是否提高總體生存率,能否恢復放射性131I治療的敏感性等,且這些靶向藥物缺乏直接比較研究,有沒有一種靶向治療的藥物都優于所有的藥物也尚未明確。
siRNA能引起RNA的沉默和抑制靶蛋白的表達。因此,siRNA對很多疾病(如腫瘤、基因疾病、病毒性干擾等)具有極好的治療前景。本研究結果顯示,設計并合成的siRNA在mRNA水平顯著抑制了ANX A1的表達,具有高效性和專一性。進而利用篩選的效率最高的siRNA作為研究工具,進行細胞轉染,觀察干擾后對細胞凋亡的影響。結果表明siRNA顯著干擾了ANX A1蛋白的表達,促進了TPC-1細胞的凋亡。這可能與ANX A1和PTC基因中的某些通路有相似的結構域和與特異配體相結合,參與細胞內信號傳遞有關[11-12]。這也與已有文獻報道的ANX A1抑制在甲狀腺未分化癌的凋亡結果一致[16]。提示ANX A1在PTC中可能作為一個癌基因。ANX A1在癌組織中高表達,運用siRNA技術干擾ANX A1在PTC中的表達,有促進細胞凋亡的作用,這為PTC的臨床治療提供了新思路,即通過靶向抑制ANX A1蛋白表達來抑制腫瘤的生長,從而達到控制腫瘤的作用。但是ANX A1通過何種方式參與,其具體機制還不十分清楚。本實驗的缺陷在于siRNA干預方法雖然高效,但容易降解,價格昂貴,干擾或沉默時效短,不適合做長期的基因抑制研究,未對ANX A1通過何種機制來調控PTC細胞的增殖、凋亡等生物學行為進行深入探討,這也是下一步需改進和研究的方向。
總之,本實驗設計合成并篩選了高效專一的能夠抑制ANX A1基因的siRNA,成功干擾了PTC細胞ANX A1基因的表達,抑制ANX A1表達的同時,促進了腫瘤細胞的凋亡,這為ANX A1作為PTC治療靶點提供了新方向。
[1]Liu X,Li S,Lin XE,et al.AXIN2 is Associated With Papillary Thyroid Carcinoma[J].Iran Red Crescent Med J,2016,18(2):e20960.
[2]Gomez Saez JM.Diagnostic and prognostic markers in differentiated thyroid cancer[J].Curr Genomics,2011,12(8):597-608.
[3]Hodak S,Tuttle RM,Maytal G,et al.Changing the cancer diagnosis:the case of follicular variant of papillary thyroid Cancer-Primum Non nocere and NIFTP[J].Thyroid,2016,26(7):869-871.
[4]Rescher U,Gerke V.Annexins--unique membrane binding proteins with diverse functions[J].J Cell Sci,2004,117(Pt 13):2631-2639.
[5]鐘雪梅,陳敏,鄧世山,等.AnnexinA1在甲狀腺乳頭狀癌中的表達及臨床意義[J].重慶醫學,2015,44(25):3488-3490.
[6]Higuchi DY,Kawakami S,Hashida M.Strategies for in vivo delivery of siRNAs:recent progress[J].Biodrugs,2010,24(3):195-205.
[7]Ren T,Qing Y,Dai N,et al.Apurinic/apyrimidinic endonuclease 1 induced upregulation of fibroblast growth factor 2 and its receptor 3 induces angiogenesis in human osteosarcoma cells[J].Cancer Sci,2014,105(2):186-194.
[8]Ardito G,Revelli L,Polistena A,et al.Complications of neck dissections in papillary thyroid carcinoma:a modified procedure to reduce parathyroid morbidity[J].In Vivo,2016,30(3):303-308.
[9]Liu YF,Zhang PF,Li MY,et al.Identification of annexin A1 as a proinvasive and prognostic factor for lung adenocarcinoma[J].Clin Exp Metastasis,2011,28(5):413-425.
[10]He ZY,Wen H,Shi CB,et al.Up-regulation of hnRNP A1,Ezrin,tubulin β-2C and Annexin A1 in sentinel lymph nodes of colorectal cancer[J].World J Gastroenterol,2010,16(37):4670-4676.
[11]Monastyrskaya K,Babiychuk EB,Draeger A.The annexins:spatial and temporal coordination of signaling events during cellular stress[J].Cell Mol Life Sci,2009,66(16):2623-2642.
[12]D′Acquisto F,Piras G,Rattazzi L.Pro-inflammatory and pathogenic properties of Annexin-A1:the whole is greater than the sum of its parts[J].Biochem Pharmacol,2013,85(9):1213-1218.
[13]Petrella A,Festa M,Ercolino SF,et al.Annexin-1 downregulation in thyroid cancer correlates to the degree of tumor differentiation[J].Cancer Biol Ther,2006,5(6):643-647.
[14]Petrella A,Festa M,Ercolino SF,et al.Induction of annexin-1 during TRAIL-induced apoptosis in thyroid carcinoma cells[J].Cell Death Diffe,2005,12(10):1358-1360.
[15]Fang Y,Guan XY,Cai TH,et al.Knockdown of ANXA1 suppresses the biological behavior of human NSCLC cells in vitro[J].Mol Med Rep,2016,13(5):3858-3866.
[16]Alldridge LC,Bryant CE.Annexin 1 regulates cell proliferation by disruption of cell morphology and inhibition of cyclin D1 expression through sustained activation of the ERK1/2 MAPK signal[J].Exp Cell Res,2003,290(1):93-107.
Influnence of siRNA interfering Annexina A1 expression on apoptosis of papillary thyroid carcinomar TPC-1 cells*
ZhongXuemei1,LinYimin2△,ZhouYuan1,DengShishan3,DingHao1
(1.DepartmentofClinicalMedicine,ChongqingMedicalandPharmaceuticalCollege,Chongqing401331,China;2.DepartmentofClinicalLaboratory,ChongqingCancerInstitute,Chongqing400030,China;3.SchoolofBasicMedicalSciences,NorthSichuanMedicalCollege,Nanchong,Sichuan637000,China)
Objective To investigate the effect of ANX A1 on the biological characteristics of papillary thyroid carcinom cells by interfering with the expression of Annexina A1 (ANX A1) in papillary thyroid carcinoma cells through small interfering RNAs (siRNA).Methods The designed highly efficient siRNA was used to conduct the specific interfence on ANXA1 expression in the papillary thyroid carcinoma TPC-1 cells.The effect of ANXA1 on TPC-1 apoptosis in PTC was observed by flow cytometry.Results The designed siRAN could efficiently inhibit the expression of ANXA1 mRNA in PTC,enhanced the cell apoptosis in TPC-1 cells in vitro.Conclusion siRNA can interfere with the expression of ANXA1 and promote the apoptosis of papillary thyroid carcinoma which suggesting that ANXA1 may be an important biological target for the treatment of papillary thyroid carcinoma.
thyroid neoplasms;papilloma;annexin A1;TPC-1 cells;RNA,small Interfering; apoptosisec
國家自然科學基金資助項目(81172496)。
鐘雪梅(1980-),講師,碩士,主要從事內分泌基礎與臨床研究。
△通信作者,E-mail:3102175660@qq.com。
10.3969/j.issn.1671-8348.2017.23.004
R736.1
A
1671-8348(2017)23-3180-04
2017-03-10
2017-04-20)
論著·基礎研究

