脫氧膽酸在大腸癌形成過程中的作用
李 雪 綜述,南 瓊 審校
(昆明醫科大學附屬醫院消化內科,昆明 650032)
·綜 述·
脫氧膽酸在大腸癌形成過程中的作用
李 雪 綜述,南 瓊△審校
(昆明醫科大學附屬醫院消化內科,昆明 650032)
脫氧膽酸;大腸腫瘤;發生機制;飲食因素
膽汁酸中的脫氧膽酸是一種腫瘤刺激因子,在大腸癌的發展過程中起著重要的作用。大腸癌的形成是一個多階段的過程,脫氧膽酸可以通過多種機制誘導大腸癌的發生,同時可以通過合理的飲食降低脫氧膽酸的濃度以預防大腸癌的發生。
大腸癌是我國常見的惡性腫瘤之一,在西方國家其發病率居惡性腫瘤的第2~3位。近年來,隨著人們生活水平的提高和生活方式的改變,大腸癌的發病率也日益增加,在我國其發病率已經躍居惡性腫瘤的第3~5位[1]。大腸癌的形成是一個多階段的過程,從腺瘤形成和發展到上皮不典型增生逐漸加重,最后進展為惡性腫瘤,這個過程被稱為腺瘤-癌序列[2]。膽汁酸分為初級膽汁酸和次級膽汁酸。初級膽汁酸,是肝臟中膽固醇合成的,包括膽酸和鵝脫氧膽酸。初級膽汁酸被分泌到十二指腸,促進脂肪的消化和吸收,大部分初級膽汁酸在回腸末端重吸收,然后通過門靜脈運輸回肝臟,少量未吸收的初級膽汁酸進入大腸,在腸道厭氧菌作用下轉化成次級膽汁酸,次級膽汁酸包括脫氧膽酸和石膽酸[3]。次級膽汁酸中的脫氧膽酸與大腸癌的發生密切相關,以下將對脫氧膽酸在大腸癌形成過程中的作用作一簡要綜述。
1 脫氧膽酸誘導大腸癌發生的證據
脫氧膽酸誘導大腸癌發生的證據在流行病學、動物實驗研究和細胞實驗研究中都得到了證明。(1)Bernstein等[4]通過動物實驗研究表明,喂食脫氧膽酸的小組與對照組相比糞便中的脫氧膽酸水平明顯升高,并且大腸癌的發生率也明顯增加,表明脫氧膽酸可以誘導大腸癌的發生。(2)Kawano等[5]通過流行病學研究證明腫瘤組患者糞便脫氧膽酸水平明顯高于控制組,并且在腫瘤組中,脫氧膽酸水平高的一個組比脫氧膽酸水平低的一個組大腸癌的復發風險高,這表明高濃度脫氧膽酸可促進大腸腫瘤發生與發展。(3)Pai等[6]通過細胞實驗研究表明,脫氧膽酸通過激活信號轉導通路促進大腸癌上皮細胞的侵襲和生長。
2 脫氧膽酸誘導大腸癌的發生機制
2.1 脫氧膽酸通過表皮生長因子受體(EGFR)-絲裂原活化蛋白激酶(MAPK)和Wnt /β-catenin信號通路的致癌作用 EGFR-MAPK信號通路已被證實在大腸癌的發生、發展過程中起作用。脫氧膽酸誘導的EGFR-MAPK信號通路機制如下:(1)通過激活MAPK信號通路導致原癌基因激活蛋白-1(AP-1)活化和抑癌基因p53的抑制[7];(2)通過MUC2(結腸癌中異常表達的一種黏蛋白)激活細胞外信號調節激酶(EPK)信號通路[8]。Wnt/β-catenin信號通路的突變多數情況下能引發大腸癌。CBP和p300介導Wnt信號通路靶基因表達的改變,使β-catenin的核轉位影響Wnt信號通路的幾個關鍵表達模式的下游靶點,包括survivin、Cyclin D1和c-myc靶點[9]。此外,脫氧膽酸可以誘導Wnt/β-catenin信號轉導通路中的環氧合酶-2(COX-2)的表達和前列腺素E2(PGE2)的合成[10]。其作用機制有兩種:(1)通過蛋白激酶-C(PKC)依賴機制誘導COX-2 的表達和PGE2 的合成。PGE2通過EP2激活GS軸蛋白β-catenin信號轉導通路,誘導Bcl-2蛋白抑制細胞凋亡[11]。(2)通過AP-1 基因誘導COX-2的表達。AP-1 基因是一種原癌基因,脫氧膽酸通過增加AP-1復合物C-JUN 蛋白的磷酸化,從而抑制PKC 途徑的激活。此外,AP-1 的轉錄因子復合物,通過CAMP 作用激活COX-2 啟動子,誘導COX-2 的表達[12]。Wnt2在結腸癌細胞中高度表達,它能增強Wnt/β-catenin信號轉導通路靶基因的表達;更重要的是,耗減或消除大腸癌內表達的Wnt2不僅能減少Wnt/β-catenin靶基因的表達,并且能夠抑制大腸癌細胞增殖[13]。
2.2 脫氧膽酸導致基因組的不穩定 脫氧膽酸誘導的基因組不穩定性有多種機制,包括DNA的氧化損傷,線粒體及內質網的損傷,微核率和染色體非整倍體突變[14]。其機制如下:(1)脫氧膽酸誘導DNA的氧化損傷,是在長期的高濃度脫氧膽酸的作用下使細胞硝基化和氧化,而使細胞凋亡或發生DNA損傷,DNA損傷的細胞繼續在長期高濃度脫氧膽酸的作用下發生突變,經過長期的突變和自然選擇最后發展為癌癥細胞[15]。此外,脫氧膽酸可以使DNA錯配修復酶的功能障礙而導致幾個DNA錯配修復基因(如APC和TP53)發生突變,這種DNA錯配修復功能的障礙是基因組中微區突變的結果[16]。(2)脫氧膽酸誘導線粒體及內質網的損傷是通過線粒體的損傷產生過量的活性氧(ROS),過量ROS的產生使 Ca離子通過三磷酸肌醇和蘭尼堿受體的活化從ER膜釋放,損壞了ER膜并導致蛋白質折疊,并且過量的ROS的產生超過了細胞的抗氧化能力,最終導致結腸上皮細胞死亡[17]。(3)脫氧膽酸誘導微核率和染色體非整倍體突變的機制有兩種:通過著絲粒和端粒的不穩定導致染色體的缺失和易位;通過基因控制有絲分裂的過程導致染色體不對稱偏析,發起自催化核型,最后進展為癌細胞[18]。
2.3 脫氧膽酸對結直腸癌細胞增殖與凋亡的作用 脫氧膽酸在腫瘤形成的前期是強烈的促進因素,可以通過多種機制促進癌前病變發展為大腸癌。其誘導細胞增殖與凋亡的機制如下:(1)通過酪氨酸磷酸化的穩定和轉位的β-catenin進入細胞核并刺激uPA、uPAR和cyclin D1的表達。酪氨酸磷酸化分解β-catenin從而誘導細胞黏附損失,uPA/uPAR受體介導的蛋白水解酶降解細胞外基質并伴隨cyclin D1/uPA/uPA誘導細胞增殖,從而提高結腸癌細胞的生長和進展。(2)半胱天冬酶Caspase 是一類凋亡特異性蛋白酶,對細胞凋亡的反應起著關鍵作用,它通過激活特定的信號觸發細胞基質的蛋白水解,從而執行凋亡發生。其激活主要有兩個途徑,包括內源性途徑和外源性途徑,內源性途徑即線粒體依賴途徑,線粒體細胞色素c釋放到細胞質中的細胞應力,在ATP存在的情況下,它與Apaf-1聯合,增強caspase-9活化和內源性底物PARP裂解,導致細胞凋亡。外源性途徑即死亡受體介導的信號傳導途徑,死亡受體通過與“死亡配體”特異性結合后將凋亡信號由胞外傳入胞內,激活Caspase-8,導致細胞凋亡[19]。見圖1。
3 飲食因素對脫氧膽酸致大腸癌作用的影響
3.1 低脂飲食 飲食中的脂肪攝入過高導致肝臟合成的膽固醇和膽汁酸增加。脂肪、固醇類、膽汁酸在腸腔內經代謝生成致癌物質(脫氧膽酸)可促使腺瘤生長和演變,誘導上皮增生進而使腫瘤惡變[20]。并且越來越多的研究表明,脫氧膽酸可以促進大腸癌的發生、發展。因此,低脂飲食可以通過降低脫氧膽酸水平降低大腸癌的發生與發展。
3.2 高膳食纖維攝入 膳食纖維是一種不被人體消化吸收的碳水化合物,但確是人體必需的膳食成分。日常生活中的新鮮蔬菜、水果、豆類全麥類食品等都富含豐富的膳食纖維,高膳食纖維的攝入可以通過降低脫氧膽酸的濃度預防結腸癌的發生。其作用機制如下:(1)縮短排泄物的運輸時間從而減少致癌物脫氧膽酸的暴露;(2)在結腸中發酵產生短鏈脂肪酸具有抗增殖、凋亡、分化的特性;(3)改善腸道菌群,為益生菌的增殖提供能量和營養;(4)促進腸蠕動并吸附腸道中的有害物質(脫氧膽酸)以便排出[21]。
3.3 高鈣和維生素D的攝入 越來越多的證據表明,鈣和維生素D可以防止大腸腫瘤的發展。鈣可以與脫氧膽酸結合形成不溶性的皂化物,減輕其對腸上皮的刺激及毒性作用。Aggarwal等[22]的研究表明,高維生素D飲食可以減少細胞增殖、分化和凋亡。Park等[23]的研究也表明鈣穩態為癌性腫瘤發展的關鍵抑制因素,維生素D的活性代謝物在腸道起到鈣吸收中介的角色,以防止穩態中斷。此外除了防止結直腸癌變,維生素D和鈣都不同程度地參與生物反應,如抑制由內源性或外源性因素引起的DNA合成雙鏈斷裂,從而降低患結直腸癌或腺瘤的風險[24]。
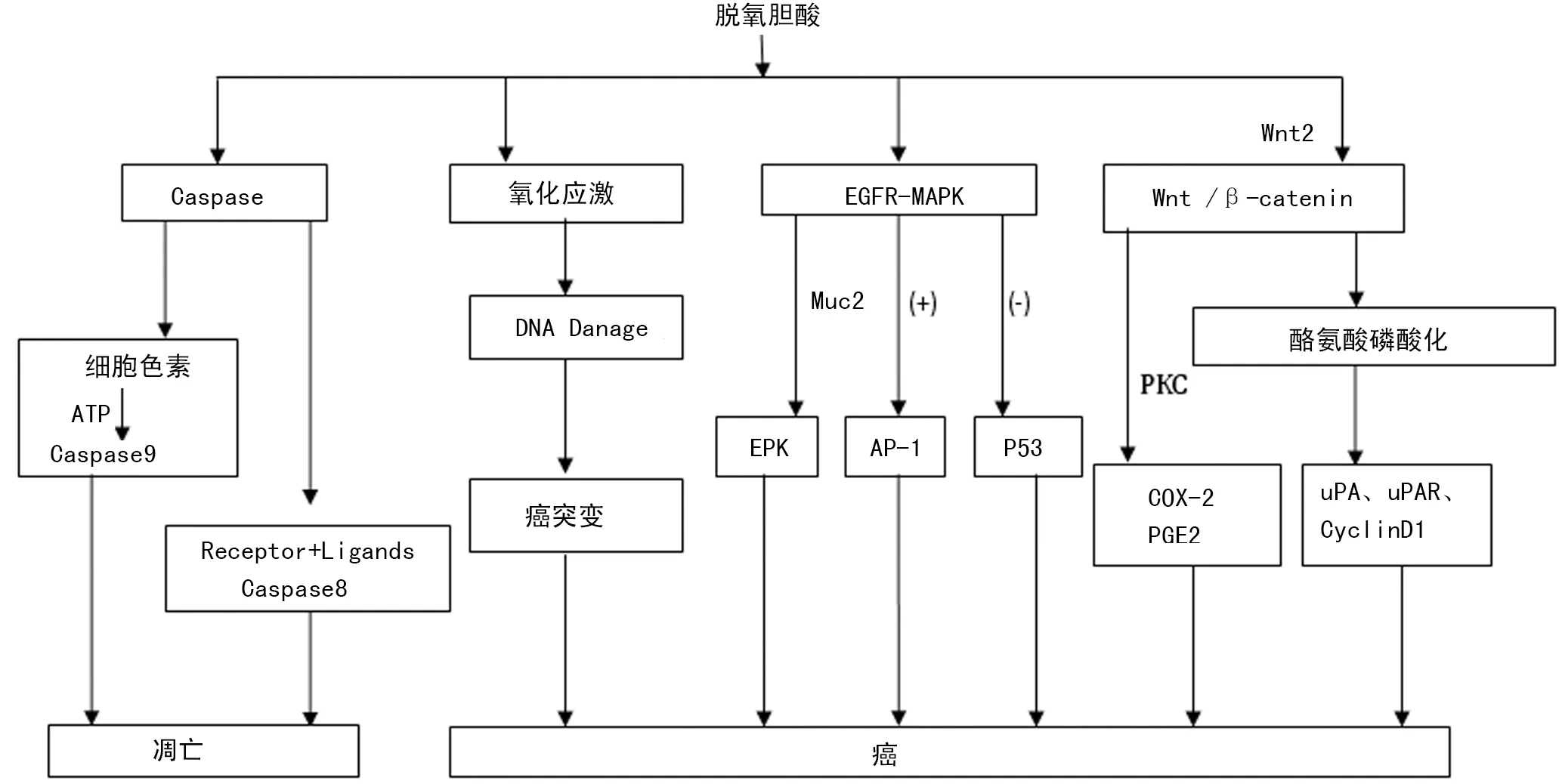
圖1 脫氧膽酸誘導大腸癌的發生機制
3.4 維生素B6的攝入 研究表明維生素B6顯著降低了糞便脫氧膽酸的生成,并顯著降低脫氧膽酸與石膽酸的比值,而且維生素B6通過提高糞便黏蛋白的水平改變了結腸腔的環境[25]。
4 結 論
大腸癌的發生是一個多階段的過程,脫氧膽酸在大腸癌發展過程中發揮著重要作用,其發生機制和影響因素錯綜復雜。盡管脫氧膽酸促進大腸癌發生的作用在流行病學、動物與細胞學實驗等研究中得以證實,但其具體機制并未明確。進一步充分了解脫氧膽酸促進大腸癌發生的具體機制及降低脫氧膽酸的因素,有助于大腸癌的預防、診斷和治療。
[1]El Zoghbi M,Cummings LC.New era of colorectal cancer screening[J].World J Gastrointest Endosc,2016,8(5):252-258.
[2]Szylberg L,Janiczek M,Popiel A,et al.Serrated polyps and their alternative pathway to the colorectal cancer:a systematic review[J].Gastroenterol Res Pract,2015(2015):573814.
[3]李慧娟,關景明,王仙琦,等.脫氧膽酸誘導大腸癌發生的研究[J].胃腸病學和肝病學雜志,2014,23(1):5-8.
[4]Bernstein C,Holubec H,Bhattacharyya AK,et al.Carcinogenicity of deoxycholate,a secondary bile acid[J].Arch Toxicol,2011,85(8):863-871.
[5]Kawano A,Ishikawa H,Kamano T,et al.Significance of fecal deoxycholic acid concentration for colorectal tumor enlargement[J].Asian Pac J Cancer Prev,2010,11(6):1541-1546.
[6]Pai R,Tarnawski AS,Tran T.Deoxycholic acid activates beta-catenin signaling pathway and increases colon cell cancer growth and invasiveness[J].Mol Biol Cell,2004,15(5):2156-2163.
[7]Centuori SM,Martinez JD.Differential regulation of EGFR-MAPK signaling by deoxycholic acid(DCA) and ursodeoxycholic acid(UDCA) in colon cancer[J].Dig Dis Sci,2014,59(10):2367-2380.
[8]Lee HY,Crawley S,Hokari R,et al.Bile acid regulates MUC2 transcription in colon cancer cells via positive EGFR/PKC/Ras/ERK/CREB,PI3K/Akt/IkappaB/NF-kappaB and p38/MSK1/CREB pathways and negative JNK/c-Jun/AP-1 pathway.[J].Int J Oncol,2010,36(4):941-953.
[9]Zhang J,Kong LM,Zhan R,et al.Two Natural ent -kauranoids as Novel Wnt Signaling Inhibitors[J].Nat Prod Bioprospect,2014,4(3):135-140.
[10]Zhu Y,Zhu M,Lance P.Stromal COX-2 signaling activated by deoxycholic acid mediates proliferation and invasiveness of colorectal epithelial cancer cells[J].Biochem Biophys Res Commun,2012,425(3):607-612.
[11]Goss AM,Ying T,Tsukiyama T,et al.Wnt2/2b and β-Catenin Signaling Are Necessary and Sufficient to Specify Lung Progenitors in the Foregut[J].Dev Cell,2009,17(2):290-298.
[12]王邦茂,翟春穎.膽汁酸對結腸癌細胞環氧合酶2表達及前列腺素E2合成作用的研究[J].天津醫科大學學報,2003,9(4):498-501.
[13]Jung YS,Jun S,Lee SH,et al.Wnt2 complements Wnt/β-catenin signaling in colorectal cancer[J].Oncotarget,2015,6(35):37257-37268.
[14]Payne CM,Bernstein C,Dvorak K,et al.Hydrophobic bile acids,genomic instability,Darwinian selection,and colon carcinogenesis[J].Clin Exp Gastroenterol,2008,1:19-47.
[15]Peng S,Huo X,Rezaei D,et al.In Barrett′s esophagus patients and Barrett′s cell lines,ursodeoxycholic acid increases antioxidant expression and prevents DNA damage by bile acids[J].Am J Physiol Gastrointest Liver Physiol,2014,307(2):G129-139.
[16]Noffsinger AE.Serrated polyps and colorectal cancer:new pathway to malignancy[J].Annu Rev Pathol,2009,4:343-364.
[17]Ignacio BJ,Olmo N,Pérez-Ramos P,et al.Deoxycholic and chenodeoxycholic bile acids induce apoptosis via oxidative stress in human colon adenocarcinoma cells[J].Apoptosis,2011,16(10):1054-1067.
[18]Payne CM,Crowleyskillicorn C,Bernstein C,et al.Molecular and cellular pathways associated with chromosome 1p deletions during colon carcinogenesis[J].Clin Exp Gastroenterol,2011,4(2):75-119.
[19]Zhao W,Yang Y,Zhang YX,et al.Fluoride-containing podophyllum derivatives exhibit antitumor activities throughenhancing mitochondrial apoptosis pathway by increasing the expression of caspase-9 inHeLa cells[J].Sci Rep,2015,5:17175.
[20]孫麗紅.飲食因素與大腸癌關系的研究進展[J].世界華人消化雜志,2010,18(19):2033-2037.
[21]Azeem S,Gillani SW,Siddiqui A,et al.Diet and Colorectal Cancer Risk in Asia--a Systematic Review[J].Asian Pac J Cancer Prev,2015,16(13):5389-5396.
[22]Aggarwal A,H?baus J,Tennakoon S,et al.Active vitamin D potentiates the anti-neoplastic effects of calcium in the colon:A cross talk through the calcium-sensing receptor[J].J Steroid Biochem Mol Biol,2016,155(Pt B):231-238.
[23]Park Y,Kim J.Association of Dietary Vitamin D and Calcium With Genetic Polymorphisms in Colorectal Neoplasia[J].J Cancer Prev,2015,20(2):97-105.
[24]Li DY.Nutritional Genomics:The impact of dietary regulation of gene function on human disease[J].Nutr Clin Pract,2013,28(3):409.
[25]Okazaki Y,Utama Z,Suidasari S,et al.Consumption of vitamin B(6) reduces fecal ratio of lithocholic acid to deoxycholic acid,a risk factor for colon cancer,in rats fed a high-fat diet.[J].J Nutr Sci Vitaminol,2012,58(5):366-370.
李雪(1991-),在讀碩士,主要從事大腸癌發病機制的研究。△
,E-mail:nanqiong@163.com。
10.3969/j.issn.1671-8348.2017.22.040
R735.3+4
A
1671-8348(2017)22-3141-04
2017-02-22
2017-04-10)

