IL-18激活NF-κB細(xì)胞信號(hào)通路對(duì)人臍靜脈內(nèi)皮細(xì)胞損傷作用的體外研究*
李光第,趙學(xué)凌,周如丹△
(1.貴州醫(yī)科大學(xué)附屬醫(yī)院骨科,貴陽(yáng) 550004;2.昆明醫(yī)科大學(xué)第一附屬醫(yī)院骨科,昆明 650032)
·論 著·
IL-18激活NF-κB細(xì)胞信號(hào)通路對(duì)人臍靜脈內(nèi)皮細(xì)胞損傷作用的體外研究*
李光第1,趙學(xué)凌2,周如丹2△
(1.貴州醫(yī)科大學(xué)附屬醫(yī)院骨科,貴陽(yáng) 550004;2.昆明醫(yī)科大學(xué)第一附屬醫(yī)院骨科,昆明 650032)
目的 探討促炎因子白細(xì)胞介素-18(IL-18)通過激活核因子-κB(NF-κB)介導(dǎo)的細(xì)胞信號(hào)通路,對(duì)靜脈內(nèi)皮細(xì)胞功能的影響及其與深靜脈血栓形成(DVT)的聯(lián)系。方法 利用重組人IL-18作用體外培養(yǎng)的人臍靜脈內(nèi)皮細(xì)胞(HUVECs),并以NF-κB激活抑制劑進(jìn)行干預(yù),通過實(shí)時(shí)熒光定量PCR、Western blot、免疫熒光、流式細(xì)胞儀等檢測(cè)手段,驗(yàn)證IL-18是否通過激活NF-κB介導(dǎo)的細(xì)胞信號(hào)轉(zhuǎn)導(dǎo)通路,影響HUVECs正常狀態(tài)及血管性血友病因子(vWF)、P-選擇素(P-selectin)、組織型纖溶酶原激活物(t-PA)等內(nèi)皮細(xì)胞功能標(biāo)記物的表達(dá),結(jié)合既往研究對(duì)IL-18參與DVT的機(jī)制進(jìn)行綜合分析。結(jié)果 IL-18可激活內(nèi)皮細(xì)胞內(nèi)NF-κB,使細(xì)胞核內(nèi)p65表達(dá)增高、細(xì)胞內(nèi)IκBα表達(dá)降低,并使HUVECs早期凋亡細(xì)胞明顯增多;添加QNZ(EVP4593)可使IL-18對(duì)NF-κB的激活作用明顯抑制,細(xì)胞損傷、凋亡的發(fā)生顯著減少;IL-18可促使vWF、P-selectin和t-PA等DVT相關(guān)的內(nèi)皮細(xì)胞標(biāo)志物發(fā)生表達(dá)異常(P<0.05),而各標(biāo)志物可在NF-κB激活抑制后恢復(fù)常規(guī)表達(dá)。結(jié)論 IL-18及NF-κB間的相互作用導(dǎo)致HUVECs生長(zhǎng)狀態(tài)和功能異常,可能是與DVT發(fā)病相關(guān)的疾病機(jī)制。
白細(xì)胞介素18;NF-κB;內(nèi)皮細(xì)胞;靜脈血栓形成
深靜脈血栓形成(DVT)的病理生理變化、預(yù)診指標(biāo)及疾病機(jī)制的研究,均是相關(guān)研究中探討較為集中的問題。DVT在大量研究中被發(fā)現(xiàn)與炎性反應(yīng)關(guān)系密切,脈管內(nèi)膜組織可因炎性因素引發(fā)損傷而導(dǎo)致血栓性疾病。Tsai等[1]學(xué)者發(fā)現(xiàn)多種炎性標(biāo)志物的血漿含量變化可視為發(fā)生靜脈血栓的危險(xiǎn)因素,而體內(nèi)某些炎性標(biāo)記物的變化可影響炎癥的發(fā)生與發(fā)展;曾有研究認(rèn)為深靜脈血栓可導(dǎo)致炎性反應(yīng)的發(fā)生和炎性因子上調(diào)[2];但是臨床實(shí)際工作中可見下肢創(chuàng)傷患者雙側(cè)發(fā)病者并非少見,這些均反映了炎性反應(yīng)與血栓形成間相輔相成的密切聯(lián)系[3]。組織因子(TF)、血管性假血友病因子(vWF)、P-選擇素(P-selectin)、組織型纖溶酶原激活物(t-PA)和纖維連接蛋白(FN)等標(biāo)志物發(fā)生表達(dá)變化,可在靜脈內(nèi)皮細(xì)胞受損時(shí)被發(fā)現(xiàn),這些標(biāo)志物的變化使靜脈內(nèi)皮具備了一定的促凝性。同時(shí),研究證實(shí)白細(xì)胞介素(IL)-18與DVT動(dòng)物模型血栓形成的發(fā)生、發(fā)展有關(guān)[4],其介導(dǎo)的促炎反應(yīng)在靜脈血栓發(fā)生中可能起重要作用。IL-18與臨床患者下肢DVT的發(fā)生密切相關(guān)[5],將其構(gòu)建的過表達(dá)及干擾病毒載體感染人臍靜脈內(nèi)皮細(xì)胞,基因表達(dá)芯片譜測(cè)定顯示可誘發(fā)多條細(xì)胞轉(zhuǎn)導(dǎo)通路的異常改變。因此,為探討IL-18通過對(duì)內(nèi)皮細(xì)胞信號(hào)通路的影響與DVT的聯(lián)系,本實(shí)驗(yàn)對(duì)IL-18影響核因子-κB(NF-κB)介導(dǎo)的細(xì)胞信號(hào)通路所致的人臍靜脈內(nèi)皮細(xì)胞(HUVECs)功能改變,進(jìn)行了更具針對(duì)性的研究。
1 材料與方法
1.1 材料與儀器 重組人IL-18(CYT-269)購(gòu)自ProSpec公司;NF-κB抑制劑QNZ (EVP4593)購(gòu)自Selleck公司;P65、NF-κB抑制(IκB)因子抗體購(gòu)自美國(guó)Proteintech公司;磷酸化p65抗體購(gòu)自美國(guó)CST公司;IF二抗羊抗兔IgG購(gòu)自Thermo公司;t-PA抗體、vWF、P-selectin抗體購(gòu)自Santa Cruz Biotechnology公司;HUVECs購(gòu)自江陰齊氏生物科技有限公司;細(xì)胞培養(yǎng)耗材購(gòu)自Corning公司;細(xì)胞核蛋白與漿蛋白抽提試劑盒(P0028)、線粒體膜電位檢測(cè)試劑盒(C2006)、異硫氰酸熒光素標(biāo)記的膜聯(lián)蛋白V(Annexin V);FITC細(xì)胞凋亡檢測(cè)試劑盒(C1062)購(gòu)自Beyotime Biotechnology公司;Western blot試劑購(gòu)自鼎國(guó)生物技術(shù)有限公司;熒光定量試劑盒購(gòu)自Fermentas公司;熒光定量ABI-7300PCR儀購(gòu)自ABI公司;流式細(xì)胞儀(CyFlow?Space)購(gòu)自PARTEC公司。
1.2 方法
1.2.1 HUVECs細(xì)胞培養(yǎng) 獲取HUVECs新鮮細(xì)胞株后37 ℃、5% CO2、飽和濕度細(xì)胞培養(yǎng)箱靜置2~3 h;棄去原瓶培養(yǎng)液,0.25%乙二胺四乙酸(EDTA)胰酶37 ℃消化2 min,大部分細(xì)胞收縮抱團(tuán)后終止消化,所獲得細(xì)胞接種于2~4個(gè)培養(yǎng)瓶,補(bǔ)充新鮮培養(yǎng)基至每瓶4 mL,靜置培養(yǎng)。此后,倒置顯微鏡動(dòng)態(tài)觀測(cè)生長(zhǎng)情況,HUVECs貼壁生長(zhǎng);72 h首次換液,以后根據(jù)細(xì)胞生長(zhǎng)情況及實(shí)驗(yàn)安排1~2 d換液。
1.2.2 IL-18對(duì)細(xì)胞表達(dá)NF-κB的影響 實(shí)驗(yàn)添加重組人IL-18至HUVECs,檢測(cè)NF-κB-p65表達(dá)。預(yù)實(shí)驗(yàn)選定IL-18最佳濃度和時(shí)間:HUVECs傳代培養(yǎng)48 h,倒置顯微鏡觀察生長(zhǎng)良好;向培養(yǎng)瓶加入IL-18,濃度梯度0、5、10、50、100、500 ng/mL,繼續(xù)培養(yǎng)24 h;提取總蛋白:加200 μL添加PMSF的RIPA,冰浴裂解30 min;4 ℃、12 000×g離心5 min。Western blot檢測(cè)IL-18各濃度作用下NF-κB-p65的表達(dá),選擇IL-18理想濃度。NF-κB表達(dá)活性檢測(cè)顯示:50 ng/mL時(shí)為顯著高表達(dá),直至100 ng/mL活性仍明顯增強(qiáng),此后表達(dá)情況不符合實(shí)驗(yàn)要求。添加50 ng/mL濃度IL-18,分別培養(yǎng)6、12、24、48、72 h;提取細(xì)胞總蛋白,Western blot檢測(cè)NF-κB-p65表達(dá),IL-18作用24 h后 NF-κB-p65表達(dá)活性明顯增強(qiáng),高表達(dá)狀態(tài)可持續(xù)至72 h。
1.2.3 IL-18激活NF-κB細(xì)胞信號(hào)通路相關(guān)測(cè)定 HUVECs分3組進(jìn)行預(yù)處理,A組:正常培養(yǎng)24 h;B組:IL-18預(yù)作用24 h,50 ng/mL,培養(yǎng)24 h;C組:IL-18預(yù)作用12 h,添加QNZ(EVP4593)、50 μmol/mL,繼續(xù)培養(yǎng)至24 h。
1.2.3.1 HUVECs核蛋白與漿蛋白分離提取 室溫融解細(xì)胞核蛋白與漿蛋白抽提試劑、混勻置冰,取適量胞漿蛋白抽提試劑A加入PMSF(終濃度1 mmol/L)。EDTA處理后移液器吹打細(xì)胞,離心后吸盡上清液;每20 μL細(xì)胞沉淀加200 μL添加PMSF的試劑A;渦旋振蕩10 s,懸浮分散沉淀;冰浴10~15 min,加胞漿蛋白抽提試劑B 10 μL,渦旋振蕩5 s、冰浴1 min;渦旋振蕩5 s,(12 000~16 000)×g、4 ℃離心5 min;吸取上清液至預(yù)冷EP管,即為胞漿蛋白。吸盡沉淀殘余上清液,加50 μL細(xì)胞核蛋白抽提試劑高速渦旋振蕩30 s懸浮分散,置冰浴、每隔1~2 min高速渦旋振蕩30秒/次,共30 min;(12 000~16 000)×g、4 ℃離心10 min;吸取上清液至預(yù)冷EP管中,即為細(xì)胞核蛋白;蛋白濃度檢測(cè)(BCA)法檢測(cè)胞漿、核蛋白濃度。
1.2.3.2 Western blot NF-κB-p65和IκBα分別在胞漿和胞核中的表達(dá)情況檢測(cè):吸取各組蛋白上清液,按20%體積加入5×十二烷基硫酸鈉(SDS)、置沸水10 min,80 V濃縮膠電壓和140 V分離膠電壓行SDS-聚丙烯酰胺凝膠電泳。裁剪濾紙及聚偏氟乙烯(PVDF)經(jīng)甲醇處理,濾紙、膠和膜浸泡于轉(zhuǎn)膜緩沖液5 min;按順序疊放,對(duì)齊后玻璃棒滾除氣泡,20 V電壓轉(zhuǎn)膜60 min;轉(zhuǎn)膜后清水浸潤(rùn)PVDF膜,溫箱37 ℃干燥后100%甲醇浸潤(rùn),雙蒸水浸洗,5%脫脂奶粉三羥甲基氨基甲烷緩沖鹽水(TBS-T)溶液20~25 ℃封閉過夜;封閉后膜TBS-T漂洗3次、10分鐘/次;含1%脫脂奶粉TBS-T稀釋一抗(1∶500~1∶1 000),4 ℃孵育過夜,TBS-T漂洗3次、10分鐘/次;含1%脫脂奶粉TBS-T稀釋二抗(1∶5 000),20~25 ℃孵育60 min,再次將膜浸TBS-T漂洗3次,10分鐘/次;增強(qiáng)化學(xué)發(fā)光法(ECL Plus)顯色、Bio-Rad膜成像系統(tǒng)檢測(cè)。
1.2.3.3 免疫熒光檢測(cè) 3組HUVECs分別制成細(xì)胞懸液(2×104個(gè)/毫升),高壓滅菌蓋玻片置于24孔板,滴加50 μL上述細(xì)胞懸液;培養(yǎng)過夜,細(xì)胞貼壁生長(zhǎng)后,每孔添加1 mL培養(yǎng)基,相同條件再次培養(yǎng)過夜;吸出培養(yǎng)基,磷酸鹽緩沖液(PBS)輕洗2次; 4%多聚甲醛室溫固定30 min;PBS輕洗2次,3% H2O2室溫封閉15 min;PBS洗2次;每孔滴加一抗100 μL,濕盒孵育2 h;PBS輕洗2次,每次5 min;滴加二抗室溫避光孵育1 h;PBS洗3次,4′,6-二脒基-2-苯基吲哚(DAPI)核染;熒光顯微鏡觀察。
1.2.4 IL-18激活NF-κB對(duì)細(xì)胞狀態(tài)、功能的影響
1.2.4.1 線粒體膜電位檢測(cè) 線粒體膜電位檢測(cè)試劑盒(JC-1),HUVECs分組培養(yǎng)于六孔板,吸除培養(yǎng)液,PBS洗滌1次,加1 mL新鮮培養(yǎng)液;JC-1工作液:每50 μL JC-1(200×)加8 mL超純水稀釋后劇烈渦旋振蕩,再加2 mL JC-1染色緩沖液(5×),混勻?yàn)镴C-1染色工作液;培養(yǎng)板每孔加JC-1工作液1 mL,培養(yǎng)箱孵育20 min;孵育期間,以每毫升 JC-1染色緩沖液(5×)加4 mL蒸餾水,配制JC-1染色緩沖液(1×),冰浴;孵育結(jié)束吸除上清液,JC-1染色緩沖液(1×)洗滌2次;加2 mL培養(yǎng)液;Nikon Eclipse 90i熒光顯微鏡觀察。
1.2.4.2 Annexin Ⅴ-FITC/碘化丙啶(PI)流式細(xì)胞儀檢測(cè) Annexin Ⅴ-FITC細(xì)胞凋亡檢測(cè)試劑盒,細(xì)胞分組培養(yǎng)及預(yù)處理,將培養(yǎng)液分別吸出留存,PBS洗滌1次,胰酶消化、室溫孵育至輕吹可使貼壁細(xì)胞脫落時(shí),棄胰酶;分別加入各組收集的原培養(yǎng)液,稍混勻,移至離心管內(nèi),1 000×g離心5 min,棄上清液收集細(xì)胞,PBS重懸計(jì)數(shù);取各組HUVECs[(5~10)×104],1 000×g離心5 min,棄上清液、加195 μL Annexin Ⅴ-FITC結(jié)合液,重懸;加5 μL Annexin V-FITC混勻,鋁箔包裹25 ℃避光孵育10 min;1 000×g離心5 min,棄上清液,加190 μL Annexin V-FITC結(jié)合液重懸;加10 μL PI染色液混勻,冰浴避光放置;流式細(xì)胞儀檢測(cè)。
1.2.4.3 內(nèi)皮細(xì)胞相關(guān)標(biāo)志物檢測(cè) 依照前序研究分為3組進(jìn)行預(yù)處理,檢測(cè)細(xì)胞與DVT形成相關(guān)的標(biāo)志物表達(dá),觀察IL-18激活NF-κB介導(dǎo)細(xì)胞信號(hào)轉(zhuǎn)導(dǎo)通路發(fā)生改變后,引起下游功能標(biāo)志物的表達(dá)情況。(1)蛋白水平差異測(cè)定:Western blot檢測(cè)各組vWF、p-selectin、t-PA的蛋白表達(dá),獲得蛋白相對(duì)表達(dá)水平后,分析IL-18在激活NF-κB后,HUVECs功能相關(guān)蛋白的表達(dá)變化。(2)mRNA水平測(cè)定:抽提各組HUVECs總RNA, RevertAid First Strand cDNA合成試劑盒進(jìn)行cDNA合成;GenBank搜索待測(cè)基因完整mRNA序列,BLAST和primer 5.0分析設(shè)計(jì)特異性real-time PCR引物(Human vWF 正向引物5′- TCC TCC TAC TCT GCC CCC C-3′,反向引物5′- TCC ATC CGC TGA ATC ACC TC-3′;Human p-selectin 正向引物5′- CCG TGC GTA ATT ACT CCC CC-3′,反向引物5′- AGG CTT TCT CGG CTT CAT CTG-3′;Human t-PA 正向引物5′- CCC AGA TCG AGA CTC AAA GCC-3′,反向引物5′- TGA CCC ATT CCC AAA GTA GCA G-3′;Human β-actin正向引物5′- ACG GCA AGT TCA ACG GCA CAG-3′,反向引物5′- GAC GCC AGT AGA CTC CAC GAC A-3′)。依據(jù)Maxima?SYBR Green/ROX qPCR Master Mix (2×) 試劑盒,以ABI Prism 7300HT real-time PCR擴(kuò)增儀行熒光定量PCR檢測(cè),2-ΔΔCt法(DataAssistTMv3.0 Software,ABI)進(jìn)行實(shí)驗(yàn)分析。
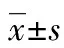
2 結(jié) 果
2.1 IL-18介導(dǎo)NF-κB激活情況的測(cè)定結(jié)果
2.1.1 NF-κB-p65和IκBα表達(dá) 實(shí)驗(yàn)成功分離提取HUVECs各組蛋白,Western blot檢測(cè)各組IκBα、胞漿和細(xì)胞核蛋白中p65。依據(jù)結(jié)果換算IκBα、p65的各組 Ratio值,A、B、C 3組IκBα分別為:0.744、0.487、0.615;胞核內(nèi)p65分別為:0.777、1.177、0.749;胞漿內(nèi)p65分別為:0.978、0.579、1.153。胞漿中NF-κB-p65的表達(dá),B組明顯減少,而C組相對(duì)表達(dá)量較B組增多(圖1)。
2.1.2 免疫熒光檢測(cè)結(jié)果 p-p65通常在正常臍靜脈內(nèi)皮細(xì)胞中呈現(xiàn)低表達(dá)狀態(tài);NF-κB受到IL-18的作用后明顯激活,染色結(jié)果可見p65-p50二聚體向細(xì)胞核內(nèi)發(fā)生明顯轉(zhuǎn)移活動(dòng);在IL-18處理后的細(xì)胞中加入QNZ后,NF-κB受抑制的細(xì)胞中p-p65表達(dá)水平明顯出現(xiàn)下降。
2.2.2 IL-18激活NF-κB對(duì)細(xì)胞的影響
2.2.2.1 線粒體膜電位檢測(cè) 實(shí)驗(yàn)結(jié)果可觀察到正常培養(yǎng)的HUVECs細(xì)胞線粒體基質(zhì)中,存在明顯的JC-1聚合物,線粒體膜電位較高(顯示為明顯的紅色熒光);HUVECs中添加IL-18后JC-1單體明顯增多,細(xì)胞線粒體膜電位較低(顯示為綠色熒光);然而,添加NF-κB抑制劑QNZ后,IL-18的NF-κB激活作用受到抑制,線粒體膜電位正常的紅色熒光細(xì)胞數(shù)量明顯增多,而顯示綠色熒光的凋亡細(xì)胞減少。
2.2.2.2 Annexin V-FITC/PI細(xì)胞凋亡檢測(cè) Q1表示檢測(cè)許可范圍內(nèi)誤差,無實(shí)際意義;Q2象限表示凋亡晚期和壞死細(xì)胞量;Q3象限表示正常活細(xì)胞量;Q4象限為早期凋亡細(xì)胞量。其中,正常體外培養(yǎng)的A組細(xì)胞Q3象限檢測(cè)量為3組最多(98.71%),Q2、Q4象限均為3組最少(0.14%、0.02%);NF-κB受到激活的B組細(xì)胞Q2、Q4象限均為3組最多(1.51%、27.76%),而正常活細(xì)胞最少(68.70%);NF-κB激活受抑制后的C組細(xì)胞,各象限細(xì)胞檢測(cè)量均接近正常細(xì)胞。見圖2。

圖1 IκBα及NF-κB-p65相對(duì)表達(dá)水平

A:正常培養(yǎng)細(xì)胞;B:NF-κB受到激活;C:NF-κB激活受抑制。
圖2 流式細(xì)胞儀檢測(cè)結(jié)果

圖3 Western blot檢測(cè)vWF、P-selectin、t-PA的蛋白表達(dá)

a:P<0.05;b:P<0.01
圖4 real-time PCR檢測(cè)基因的表達(dá)水平
2.3 內(nèi)皮細(xì)胞相關(guān)標(biāo)志物檢測(cè)
2.3.1 Western blot結(jié)果 實(shí)驗(yàn)結(jié)果可見IL-18激活NF-κB后可影響各功能標(biāo)志物的表達(dá)水平(圖3)。測(cè)得A、B、C組Ratio值(蛋白相對(duì)表達(dá)水平)為, vWF:0.593、1.301、0.825;P-selectin:1.029、1.476、1.315;t-PA:1.281、0.650、0.832。相對(duì)以A組為1計(jì)算的各組Ratio值可見:B組細(xì)胞受IL-18作用后vWF(2.19)、P-selectin(1.43)均明顯增高,t-PA(0.51)表達(dá)明顯降低;C組細(xì)胞中添加QNZ后vWF(1.39)、P-selectin(1.28)表達(dá)回降,t-PA(0.64)表達(dá)有所增加。
2.3.2 熒光定量PCR檢測(cè)結(jié)果 獲取檢測(cè)結(jié)果后以2-ΔΔCt法進(jìn)行數(shù)據(jù)分析(表1)。B組vWF、P-selectin表達(dá)明顯增加(P<0.05),t-PA較A組明顯下調(diào)(P<0.01)。

表1 real-time PCR檢測(cè)基因的表達(dá)水平
a:P<0.05;b:P<0.01,與A組相比
C組中添加QNZ后IL-18對(duì)HUVECs的損傷及功能影響受到有效抑制(圖4):C組vWF、P-selectin明顯較B組表達(dá)下調(diào)并接近A組表達(dá)水平,且與B組相比差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。C組t-PA表達(dá)恢復(fù)接近正常,與B組比較差異有統(tǒng)計(jì)學(xué)意義(P<0.01)。
3 討 論
炎性因素導(dǎo)致的血管內(nèi)皮受損是DVT形成的常見原因,血栓形成過程中靜脈內(nèi)膜致凝作用產(chǎn)生優(yōu)勢(shì)效應(yīng),這與靜脈內(nèi)皮組織中FN、TF和vWF等異常表達(dá)密不可分,并促使了血栓的形成和發(fā)展。內(nèi)皮細(xì)胞具備生理性抗凝血及病理性血栓形成的調(diào)控功能,其損傷在血栓疾病發(fā)展過程中發(fā)揮了重要作用。相關(guān)研究也證實(shí)了,除溶性凝血因子的激活和血小板黏附聚集釋放外,內(nèi)皮細(xì)胞損傷可視為血栓形成的3個(gè)獨(dú)立要素之一[4]。
內(nèi)皮細(xì)胞是循環(huán)中免疫和炎性介質(zhì)的主要靶點(diǎn)。Chandrasekar等[5]研究證實(shí),L-18作用于血管內(nèi)皮細(xì)胞,促使細(xì)胞凋亡信號(hào)活化、導(dǎo)致細(xì)胞生長(zhǎng)及功能異常,并且IL-18直接激活了血管內(nèi)皮細(xì)胞中的NF-κB而誘導(dǎo)HCMECs發(fā)生死亡。本課題組既往研究證實(shí),IL-18在DVT患者及動(dòng)物模型血液中均存在異常表達(dá),其變化與DVT的發(fā)生與發(fā)展存在密切聯(lián)系[6-7];同時(shí),通過構(gòu)建IL-18過表達(dá)和抑制的病毒載體感染人臍靜脈內(nèi)皮細(xì)胞,可對(duì)細(xì)胞的生理活性產(chǎn)生顯著影響[5]。Baker等[8]研究結(jié)果可見,NF-κB的持續(xù)激活可促進(jìn)多種炎性因子表達(dá)發(fā)生改變,通過促發(fā)炎癥進(jìn)展過程而引發(fā)細(xì)胞損傷,從而導(dǎo)致了疾病的發(fā)生。靜息狀態(tài)下的NF-κB在胞質(zhì)以二聚體(p65-p50)形式存在,其與抑制物/IκB結(jié)合為無活性狀態(tài)[9];受激活物作用后結(jié)合物可解離,NF-κB二聚體轉(zhuǎn)移入細(xì)胞核中激活其介導(dǎo)的細(xì)胞信號(hào)通路,從而發(fā)揮靶基因轉(zhuǎn)錄等重要作用[10]。
本研究中IL-18作用HUVECs后發(fā)現(xiàn)細(xì)胞內(nèi)NF-κB表達(dá)出現(xiàn)明顯變化,分別對(duì)HUVECs胞漿、胞核蛋白進(jìn)行檢測(cè),發(fā)現(xiàn)受IL-18作用時(shí)胞核中p65表達(dá)量明顯上調(diào),而胞漿中表達(dá)量較正常減少,證實(shí)了IL-18可有效激活細(xì)胞內(nèi)NF-κB;研究中加入NF-κB激活抑制劑QNZ后可有效阻礙IL-18的上述作用效應(yīng),使細(xì)胞核中p65的表達(dá)明顯下調(diào)接近正常。研究中免疫熒光檢測(cè)結(jié)果亦證實(shí),IL-18作用后NF-κB明顯激活,發(fā)生磷酸化的p65-p50二聚體向核內(nèi)轉(zhuǎn)移,可見熒光信號(hào)閃亮、呈亮綠色;而該效應(yīng)在QNZ干預(yù)后發(fā)生顯著改變。相關(guān)研究也證實(shí),QNZ可使細(xì)胞內(nèi)NF-κB介導(dǎo)的信號(hào)轉(zhuǎn)導(dǎo)通路激活受影響,并有效干擾了細(xì)胞和動(dòng)物模型體內(nèi)相關(guān)靶基因的轉(zhuǎn)錄過程[11-12]。
本研究對(duì)IL-18作用后的HUVECs進(jìn)行線粒體膜電位檢測(cè),發(fā)現(xiàn)大量細(xì)胞發(fā)生了線粒體膜電位的下降,證明細(xì)胞受到明顯影響處于非正常生長(zhǎng)狀態(tài),并使大多數(shù)細(xì)胞發(fā)生凋亡早期改變。正常機(jī)體細(xì)胞群體穩(wěn)態(tài)的維持主要通過細(xì)胞凋亡來進(jìn)行動(dòng)態(tài)調(diào)整,該過程發(fā)生異常會(huì)引發(fā)細(xì)胞組群功能改變,甚至導(dǎo)致疾病的發(fā)生和發(fā)展。Choy等[13]研究證實(shí),血管內(nèi)壁受損可因炎性因子所誘發(fā)的內(nèi)皮細(xì)胞凋亡異常所致,而該過程最終可致血管內(nèi)壁損傷、誘發(fā)血凝塊形成,并進(jìn)一步引發(fā)炎性反應(yīng)過程而導(dǎo)致血管內(nèi)血栓或粥樣硬化斑塊等。然而,實(shí)驗(yàn)中使用NF-κB抑制劑阻斷IL-18作用后,正常活細(xì)胞量明顯增加,而細(xì)胞凋亡和壞死量幾乎均接近正常對(duì)照。研究可見,IL-18引起HUVECs生長(zhǎng)狀態(tài)異常,尤其是早期凋亡狀態(tài)細(xì)胞增多;然而,NF-κB介導(dǎo)的細(xì)胞內(nèi)信號(hào)轉(zhuǎn)導(dǎo)通路受阻后,細(xì)胞狀態(tài)得以明確改善。同時(shí),檢測(cè)IL-18作用HUVECs后細(xì)胞功能障礙標(biāo)志物的表達(dá)水平,發(fā)現(xiàn)與正常細(xì)胞比較vWF表達(dá)水平明顯升高,而NF-кB的激活抑制則可影響這一變化。vWF在體內(nèi)同時(shí)存在于血漿及內(nèi)皮組織,為內(nèi)皮細(xì)胞合成的大分子糖蛋白,內(nèi)皮受損或受刺激時(shí)合成、分泌增加。既往研究顯示,動(dòng)脈粥樣硬化(AS)高危因素者和AS確診患者vWF有表達(dá)上調(diào)的改變,vWF在內(nèi)皮細(xì)胞損傷處和血小板一起參與栓子的形成,可作為內(nèi)皮損傷的標(biāo)志物[14]。內(nèi)皮細(xì)胞功能標(biāo)志物中P-selectin亦呈現(xiàn)了與vWF相同的表達(dá)變化趨勢(shì),P-selectin常作為內(nèi)皮細(xì)胞功能障礙的標(biāo)志物和靜脈血栓的臨床危險(xiǎn)因素[15]。內(nèi)皮細(xì)胞受異常刺激或功能異常時(shí),Weibel-Palade小體與細(xì)胞膜融合,P-selectin則演化為細(xì)胞表面的膜糖蛋白,介導(dǎo)了內(nèi)皮細(xì)胞、血小板、白細(xì)胞間的相互作用,其活化可誘導(dǎo)促凝物激活和纖維蛋白形成而致靜脈易栓性。內(nèi)皮細(xì)胞可合成t-PA和尿激酶型纖溶酶原激活物(u-PA),參與構(gòu)成機(jī)體內(nèi)復(fù)雜的纖溶系統(tǒng),從而在血管內(nèi)皮受損時(shí)參與維持正常止凝血過程的動(dòng)態(tài)平衡。t-PA對(duì)纖維蛋白有較高的親和力,其可在纖維蛋白表面活化纖溶酶原發(fā)揮纖溶作用[16]。本課題實(shí)驗(yàn)發(fā)現(xiàn),IL-18作用后HUVECs產(chǎn)生的t-PA明顯低于正常細(xì)胞,而NF-κB激活抑制劑作用后,IL-18對(duì)HUVECs的影響明顯得到改善,t-PA水平回升至接近正常表達(dá)狀態(tài)。
本研究發(fā)現(xiàn)IL-18可能通過激活NF-кB介導(dǎo)的信號(hào)轉(zhuǎn)導(dǎo)通路,使內(nèi)皮細(xì)胞生長(zhǎng)狀態(tài)、凋亡形式等發(fā)生改變,繼而引發(fā)靜脈細(xì)胞的生理功能障礙,并導(dǎo)致血栓相關(guān)的內(nèi)皮細(xì)胞功能標(biāo)志物vWF、P-selectin、t-PA等產(chǎn)生異常變化,這些因素可能共同參與了血栓疾病的發(fā)生與發(fā)展。DVT形成的機(jī)制極其復(fù)雜,IL-18通過參與炎性反應(yīng)和免疫反應(yīng)調(diào)節(jié)等過程,發(fā)揮其對(duì)內(nèi)皮細(xì)胞正常生長(zhǎng)狀態(tài)和功能的影響,可能是其中較為重要的機(jī)制之一。
[1]Tsai AW,Cushman M,Rosamond WD,et al.Coagulation factors,inflammation markers,and venous thromboembolism:the longitudinal investigation of thromboembolism etiology (LITE)[J].Am J Med,2002,113(8):636-642.
[2]Roumen-Klappe EM,Den Heijer M,Van Uum SH,et al.Inflammatory response in the acute phase of deep vein thrombosis[J].J Vasc Surg,2002,35(4):701-706.
[3]Strukova S.Blood coagulation-dependent inflammation.Coagulation-dependent inflammation and inflammation-dependent thrombosis[J].Front Biosci,2006,11(1):59-80.
[4]Blann AD,Lip GY.Virchow's triad revisited:the importance of soluble coagulation factors,the endothelium,and platelets[J].Thromb Res,2001,101(4):321-327.
[5]Chandrasekar B,Vemula K,Surabhi RM,et al.Activation of intrinsic and extrinsic proapoptotic signaling pathways in interleukin-18-mediated human cardiac endothelial cell death[J].J Biol Chem,2004,279(19):20221-20233.
[6]李光第,白云城,宋恩,等.過表達(dá)或抑制IL-18對(duì)大鼠深靜脈血栓形成的影響[J].南京醫(yī)科大學(xué)學(xué)報(bào)(自然科學(xué)版),2015,32(3):367-372.
[7]李光第,宋恩,趙學(xué)凌,等.白細(xì)胞介素-18與深靜脈血栓疾病的相關(guān)性研究[J].重慶醫(yī)學(xué),2015,44(5):600-604.
[8]Baker RG,Hayden MS,Ghosh S.NF-κB,inflammation,and metabolic disease[J].Cell Metab,2011,13(1):11-22.
[9]Oeckinghaus A,Hayden MS,Ghosh S.Crosstalk in NF-κB signaling pathways[J].Nat Immunol,2011,12(8):695-708.
[10]Hayden MS,Ghosh S.Shared principles in NF-kappa B signaling[J].Cell,2008,132(3):344-362.
[11]Armstrong SJ,Wiberg M,Terenghi G,et al.Laminin activates NF-kappaB in Schwann cells to enhance neurite outgrowth[J].Neurosci Lett,2008,439(1):42-46.
[12]Yang RH,Strong JA,Zhang JM.NF-kappaB mediated enhancement of Potassium currents by the chemokine CXCL1/growth related oncogene in small diameter rat sensory neurons[Z],2009:26.
[13]Choy JC,Granville DJ,Hunt DW,et al.Endothelial cell apoptosis:biochemical characteristics and potential implications for atherosclerosis[J].J Mol Cell Cardiol,2001,33(9):1673-1690.
[14]Blann AD.Plasma von willebrand factor,thrombosis,and the endothelium:the first 30 years[J].Thromb Haemost,2006,95(1):49-55.
[15]Blann AD,Noteboom WM,Rosendaal FR.Increased soluble P-selectin levels following deep venous thrombosis:cause or effect?[J].Br J Haematol,2000,108(1):191-193.
[16]Kruithof EK,Dunoyer-Geindre S.Human tissue-type plasminogen activator[J].Thromb Haemost,2014,112(2):243-254.
In vitro study on injury effect of IL-18 activating NF-κB cell signal pathway on human umbilical vein endothelial cells*
LiGuangdi1,ZhaoXueling2,ZhouRudan2△
(1.DepartmentofOrthopedics,AffiliatedHospital,GuizhouMedicalUniversity,Guiyang,Guizhou550004,China; 2.DepartmentofOrthopedics,FirstAffiliatedHospital,KunmingMedicalUniversity,Kunming,Yunnan650032,China)
Objective To investigate the influence of proinflammatory factor interleukin-18(IL-18) on vein endothelial cell function by activating NF-κB mediated cell signal pathway and its association with deep vein thrombosis(DVT).Methods Recombinant human IL-18 was used to act on in vitro cultured human umbilical vein endothelial cell(HUVECs).The NF-κB activation inhibitor was used to conduct interference.The detection measures of real time fluorescence quantitative PCR,Western blot,immunofluorescence and flow cytometry were used to verify whether IL-18 affect the expression of endothelial cellular function markers such as HUVECs normal statusand vWF,P-selectin and tissue plasminogen activator(t-PA) by activating NF-κB mediated cell signal pathway.Moreover the mechanism of IL-18 participating in the DVT was performed the comprehensive analysis by combining with previous study.Results IL-18 could activate NF-κB in endothelial cell,increased the p65 expression in nucleus,decreased the intracellular IκBα expression and significantly increased early apoptosis cells in HUVECs; adding QNZ(EVP4593) could significantly inhibit the activation effect of IL-18 on NF-κB,the occurrence of cellular injury and apoptosis was significantly reduced; IL-18 could promote the abnormal expression of DVT related endothelial cell markers vWF,P-selectin and t-PA(P<0.05).But various markers could recover conventional expression after inhibiting NF-κB activation.Conclusion The interaction between Il-18 and NF-κB causes the abnormality of HUVECs growth status and function,which may be the DVT onset related pathogenic mechanism.
interleukin-18;NF-kappa B;endothelial cells;venous thrombosis
10.3969/j.issn.1671-8348.2017.24.001
國(guó)家自然科學(xué)基金面上項(xiàng)目(30960389);云南省衛(wèi)生科技計(jì)劃項(xiàng)目(2014NS141);云南省重點(diǎn)新產(chǎn)品開發(fā)計(jì)劃項(xiàng)目(2010BC010);云南省衛(wèi)計(jì)委內(nèi)設(shè)機(jī)構(gòu)項(xiàng)目(2016NS021);貴州醫(yī)科大學(xué)博士基金(院博合J字[2015]019號(hào));貴州省科技廳合作計(jì)劃項(xiàng)目(黔科合LH字[2016]7228號(hào))。
李光第(1981-),副主任醫(yī)師,博士,主要從事骨科常見疾病、深靜脈血栓疾病基礎(chǔ)與臨床的研究。
△通信作者,E-mail:kittypku@qq.com。
R619
A
1671-8348(2017)24-3313-05
2017-02-18
2017-04-06)

