pH調節法制備兔肉分離蛋白及其性質研究
余娛樂,賀稚非,2,李洪軍,2*
1(西南大學 食品科學學院,重慶 北碚,400716) 2(重慶市特色食品工程技術研究中心,重慶 北碚,400716)
生產與科研經驗
pH調節法制備兔肉分離蛋白及其性質研究
余娛樂1,賀稚非1,2,李洪軍1,2*
1(西南大學 食品科學學院,重慶 北碚,400716) 2(重慶市特色食品工程技術研究中心,重慶 北碚,400716)
以伊拉兔兔肉為原料,用pH調節法(pH-shifting)提取兔肉分離蛋白,并對分離蛋白的性質進行研究。實驗結果表明,pH調節法提取兔肉分離蛋白的最佳酸溶解條件pH 3.0、堿溶解條件pH 12.0、沉淀回收條件pH 5.5。此方法下提取蛋白得率分別為酸法46.46%、堿法68.55%。酸/堿分離蛋白中蛋白質含量(干基)均極顯著高于兔肉,脂肪含量(干基)極顯著低于兔肉,蛋白所含必需氨基酸比例均衡,且SDS-PAGE電泳分析表示pH調節法提取兔肉分離蛋白并未造成蛋白質嚴重降解。
pH調節法;兔肉分離蛋白;蛋白質性質
兔肉具有“三高三低”的特點,即高蛋白、高消化率、高賴氨酸、低脂肪、低熱量、低膽固醇[1],營養價值高,不僅肉質鮮美、細嫩,還可預防高血壓、肥胖病、動脈硬化等疾病[2],可滿足不同人群的食用需求。但目前兔肉制品類型單一[3],兔肉雖蛋白質含量高但兔肉蛋白制品的研究和開發卻鮮有報道。此外,兔肉中存在的特殊腥味物質在加工過程中不易除去和掩蓋,對兔肉的加工和食用均有影響[4],兔肉深加工和副產品加工還有待發展。
pH調節法(pH-shifting)制備動物分離蛋白最早由HULTIN等[5]提出,即利用蛋白質溶解度隨pH值變化的原理,先使蛋白質在極端酸性或堿性條件下充分溶解,再利用蛋白質在等電點溶解度最小使其沉淀析出,從而達到分離蛋白的目的。pH調節法具有提取時間短、回收率高、蛋白變形程度小的特點[6],根據已有報道,pH調節法已被用于鯉魚[7]、羅非魚[6, 8]、鰱魚[9]、斑節對蝦[10]、雞肉[11]、火雞[12]以及大豆分離蛋白[13]的制備,但還未見用于兔肉。本實驗以兔肉為原料,確定pH調節法制備兔肉分離蛋白的最佳條件,制備分離蛋白,進一步對pH調節法制備的兔肉分離蛋白的性質和氨基酸、蛋白質組成進行研究。
1 材料與方法
1.1材料與試劑
實驗兔購于重慶阿興記食品有限公司統景養兔場,品種為伊拉兔配套系,70日齡公兔20只,按常規方法擊暈放血宰殺,去皮后取背最長肌分裝于自封袋中,每只伊拉兔取約140 g背肌,按50 g/袋分裝并作好標記,-18℃儲藏備用。
牛血清蛋白為生化試劑,上海伯奧生物科技有限公司;其他試劑均為分析純。
1.2儀器與設備
UB-7 pH計,德國Sartorius AG公司;電子分析天平,賽多利斯科學儀器有限公司;722型可見分光光度計 上海元析儀器有限公司;TGL16M型高速冷凍離心機,長沙湘智離心機儀器有限公司;XHF-D 型勻漿機寧波新芝生物科技股份有限公司;L-8900型高速氨基酸分析儀,日本日立公司;小型垂直電泳槽,美國BIO-RAD公司。
1.3實驗方法
1.3.1 pH調節法提取兔肉分離蛋白酸溶條件的確定
參照CHOMNAWANG的方法[14],并稍作修改。稱取5 g碎肉,與預冷的去離子水按1∶9(g∶mL)混合后均質處理,每份勻漿用2 mol/L HCl調節pH值分別至1.5、2.0、2.5、3.0、3.5、4.0,在4℃條件下浸提3 h并不時攪拌。浸提后勻漿于4℃、10 000 r/min條件下離心15 min,收集上清液即得到酸溶解蛋白溶液,蛋白液用100 mL容量瓶定容后用雙縮脲法測定上清液中蛋白質含量(標準曲線y=0.042 3x-0.003 6,R2=0.999 6),并測定各酸溶pH條件下蛋白質溶解度[15]。
1.3.2 pH調節法提取兔肉分離蛋白堿溶條件的確定
參照1.3.1方法,稱取5 g伊拉兔背最長肌碎肉,與預冷的去離子水按1∶9(g∶mL)混合后均質處理,每份勻漿用2 mol/L NaOH調節pH值分別至10.0、10.5、11.0、11.5、12.0、12.5,在4℃條件下浸提3 h并不時攪拌。浸提后勻漿于4℃、10 000 r/min條件下離心15 min,收集上清液即得到堿溶解蛋白溶液,蛋白液用100 mL容量瓶定容后用雙縮脲法測定上清液中蛋白質含量,并測定各堿溶pH值條件下蛋白質溶解度[15]。
1.3.3 蛋白質回收pH值的確定
將上述最佳酸溶/堿溶條件下得到的蛋白溶液,用2 mol/L HCl或NaOH分別調節pH值至4.5、5.0、5.5、6.0,于4℃、10 000 r/min條件下離心15 min,用雙縮脲法分別測定離心后上清液中蛋白質含量,并計算回收率[15]。
1.3.4 兔肉分離蛋白的制備
根據上述實驗結果制備兔肉分離蛋白,制備工藝如下:
兔肉碎肉→1∶9 (g∶mL)加入預冷的去離子水并勻漿→調節pH至最佳溶解pH→4℃浸提3 h→10 000 r/min,4℃離心15 min→取上清液調節pH值至最佳回收pH→10 000 r/min,4℃離心15 min→取沉淀,一部分于4 ℃冰箱短期保存備用,一部分冷凍干燥備用
1.3.5 pH調節法提取兔肉分離蛋白提取率計算
(1)
蛋白質含量測定均采用凱氏定氮法。
1.3.6 兔肉分離蛋白基本組成測定
水分測定:直接干燥法GB 5009.3—2010。
粗蛋白測定:凱氏定氮法GB/T 5009.5—2010。
粗脂肪測定:索氏抽提法GB/T5009.6—2003。
灰分測定:灼燒稱重法GB 5009.4—2016。
1.3.7 兔肉分離蛋白SDS-PAGE分析
參考JIN[16]方法并根據實驗條件稍作修改,將兔肉肌肉勻漿、酸/堿分離蛋白制備成蛋白濃度2 mg/mL的蛋白溶液,進行SDS-PAGE電泳分析,分離膠濃度10%,濃縮膠濃度5%,上樣量15 μL,采用考馬斯亮藍R-250染色檢測。
1.3.8 兔肉分離蛋白氨基酸組成分析
取0.500 g樣品于試管中,加入10 mL 6 mol/L HCl后抽真空封管,(110±2)℃烘箱水解22 h,參照國標GB/T5009.124—2003方法進行氨基酸分析。
1.3.9 數據分析
采用Excel 2016進行數據處理,SPSS 19.0進行方差和相關性分析,Orign 8.1繪圖。
2 結果與分析
2.1pH調節法提取兔肉分離蛋白最佳條件的確定
2.1.1 最佳酸溶條件的確定
由圖1可知,pH變化對肌肉蛋白的溶解度有明顯影響,pH為2.0~3.5,兔肉蛋白具有較高的溶解度,均大于80%,在pH 3.0條件下具達到最大溶解度86.97%,由此確定酸法提取兔肉分離蛋白最佳酸溶條件為pH 3.0。
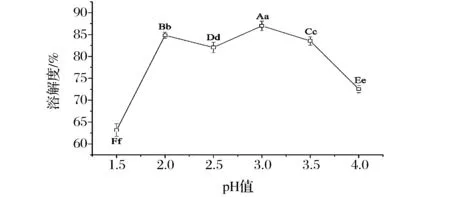
圖1 不同酸性pH值條件下兔肉蛋白溶解度變化Fig. 1 Protein solubility of rabbit muscle at acidic pH conditions注:不同小寫字母表示結果之間具有顯著差異(P<0.05);不同大寫字母表示極顯著差異(P<0.01)。
2.1.2 最佳堿溶條件的確定

圖2 不同堿性pH值條件下兔肉蛋白溶解度變化Fig.2 Protein solubility of rabbit muscle at alkaline pH conditions注:不同小寫字母表示結果之間具有顯著差異(P<0.05);不同大寫字母表示極顯著差異(P<0.01)。
由圖2可知,在pH為10.0~12.5時,肌肉蛋白溶解度隨pH值升高呈現升高后下降的趨勢,pH 10和pH 10.5條件下蛋白溶解度較低,而在pH 12.0時溶解度達到最大為94.77%,由此確定酸法提取兔肉分離蛋白的最佳酸溶條件為pH 3.0。通常蛋白質在堿性條件下的溶解度會大于酸性條件,酸/堿溶最佳pH條件和制備魚類分離蛋白基本相似[7, 17-18]。
2.1.3 蛋白回收pH值的確定
由圖3可看出,無論是酸溶還是堿溶,在pH 4.5~6.0時,兔肉肌肉蛋白均可通過pH調節得到比較高的回收率,蛋白回收率隨著pH值的升高先增大后減小,并且在pH 5.5時達到最大值,通常堿溶條件下蛋白的回收率比酸溶更高[7, 19]。
2.2兔肉分離蛋白提取率和基本組成分析
實驗結果表明,酸法和堿法提取兔肉分離蛋白的提取率分別為46.46%、68.55%,堿法的提取率高于酸法,和目前魚貝類研究結果基本一致[7, 19-20]。YULIYA[12]比較酸/堿法提取火雞分離蛋白得率時發現pH 10.5和pH 11.5條件下蛋白得率均優于pH 3.5,pH 2.5條件下蛋白得率最高但與堿法2個pH條件下的得率并無顯著差別。
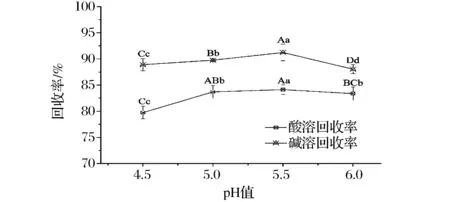
圖3 不同pH值下兔肉蛋白等電點沉淀回收率Fig.3 Protein recovery yields at different pHs during isoelectric precipitation注:不同小寫字母表示結果之間具有顯著差異(P<0.05);不同大寫字母表示極顯著差異(P<0.01)。
表1為兔肉、酸分離蛋白、堿分離蛋白的基本組成。可以看出,酸/堿分離蛋白的含水量比兔肉高,灰分均顯著低于兔肉。但酸/堿分離蛋白的蛋白質含量(干基)均極顯著(P<0.01)高于兔肉,其中堿分離蛋白的蛋白含量比酸分離蛋白更高達到87.73%,脂肪含量(干基)均極顯著(P<0.01)低于兔肉,屬于高蛋白低脂肪的優質蛋白來源。

表1 兔肉及其分離蛋白基本組成 單位:%
注:同一列不同小寫字母表示結果之間具有顯著差異(P<0.05),不同大寫字母表示極顯著差異(P<0.01)。
2.3兔肉分離蛋白SDS-PAGE分析
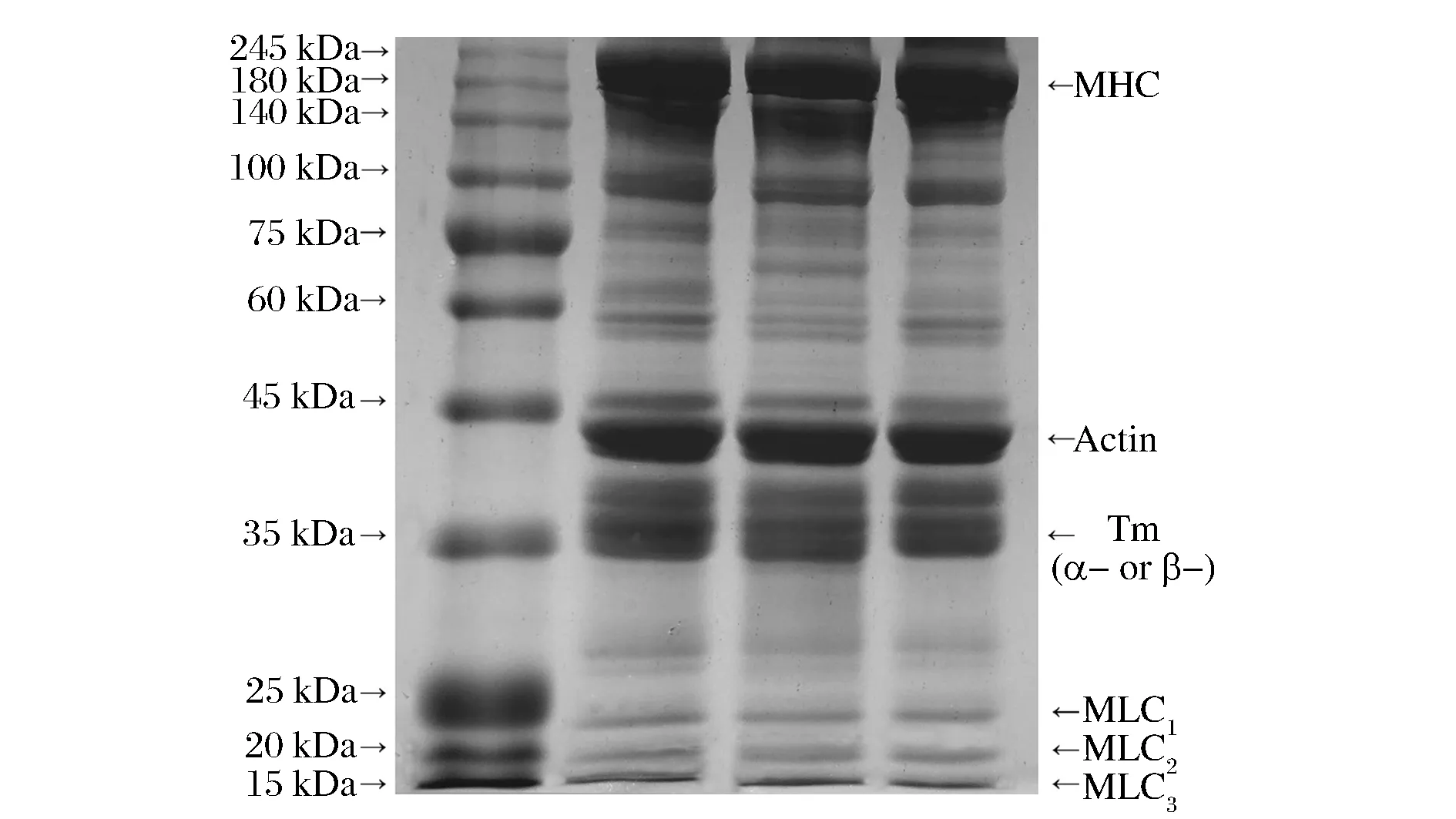
泳道從左到右依次為Mark、兔肉肌肉勻漿、酸分離蛋白、堿分離蛋白圖4 兔肉分離蛋白SDS-PAGE 圖譜Fig.4 SDS-PAGE of the rabbit protein isolate
兔肉肌肉全蛋白以及酸/堿分離蛋白的SDS-PAGE圖譜如圖4所示。無論是兔肉還是兔肉分離蛋白,蛋白質分子質量分布主要集中在200~100 kDa和45~35 kDa范圍內,其中主要有肌球蛋白重鏈(MHC,210kD)、肌動蛋白(Actin,42 Da)和肌球蛋白輕鏈(MLC1、MLC2、MLC3,分子量分別為15、17、24 kDa),在100~45kDa范圍內也有明顯條帶。肌原纖維蛋白由肌球蛋白重鏈、輕鏈, 肌動蛋白等構成[21-22]。可以看出,pH調節法能回收大部分蛋白,并且并沒有造成蛋白質特別是功能性蛋白如肌原纖維蛋白的嚴重降解,這也說明pH調節法制備分離蛋白能有效地防止蛋白質水解和變性。
2.4兔肉分離蛋白氨基酸組成分析
由表2可知,兔肉、酸分離蛋白、堿分離蛋白的氨基酸總量(干基)分別為90.007、88.141、95.506 g/100 g。堿分離蛋白的氨基酸總量極顯著(P<0.01)高于兔肉和酸分離蛋白,酸分離蛋白中氨基酸總量雖顯著低于兔肉(P<0.05),但在P<0.01水平上差異并不顯著,而且并非每種氨基酸都減少。2種分離蛋白的賴氨酸含量均高于兔肉,保留了兔肉高賴氨酸[1]的特點。酸/堿分離蛋白中均含有7中必需氨基酸,分離蛋白WEAA/WTAA均在40%左右,WEAA/WNEAA均高于60%并超過70%,酸分離蛋白和堿分離蛋白的WEAA/WTAA、WEAA/WNEAA均極顯著(P<0.01)優于兔肉。根據FAO/WHO理想模式[23],2種分離蛋白屬于氨基酸比例均衡、營養價值高的優質蛋白,pH調節法提取兔肉分離蛋白的過程并未降低兔肉蛋白的營養價值。
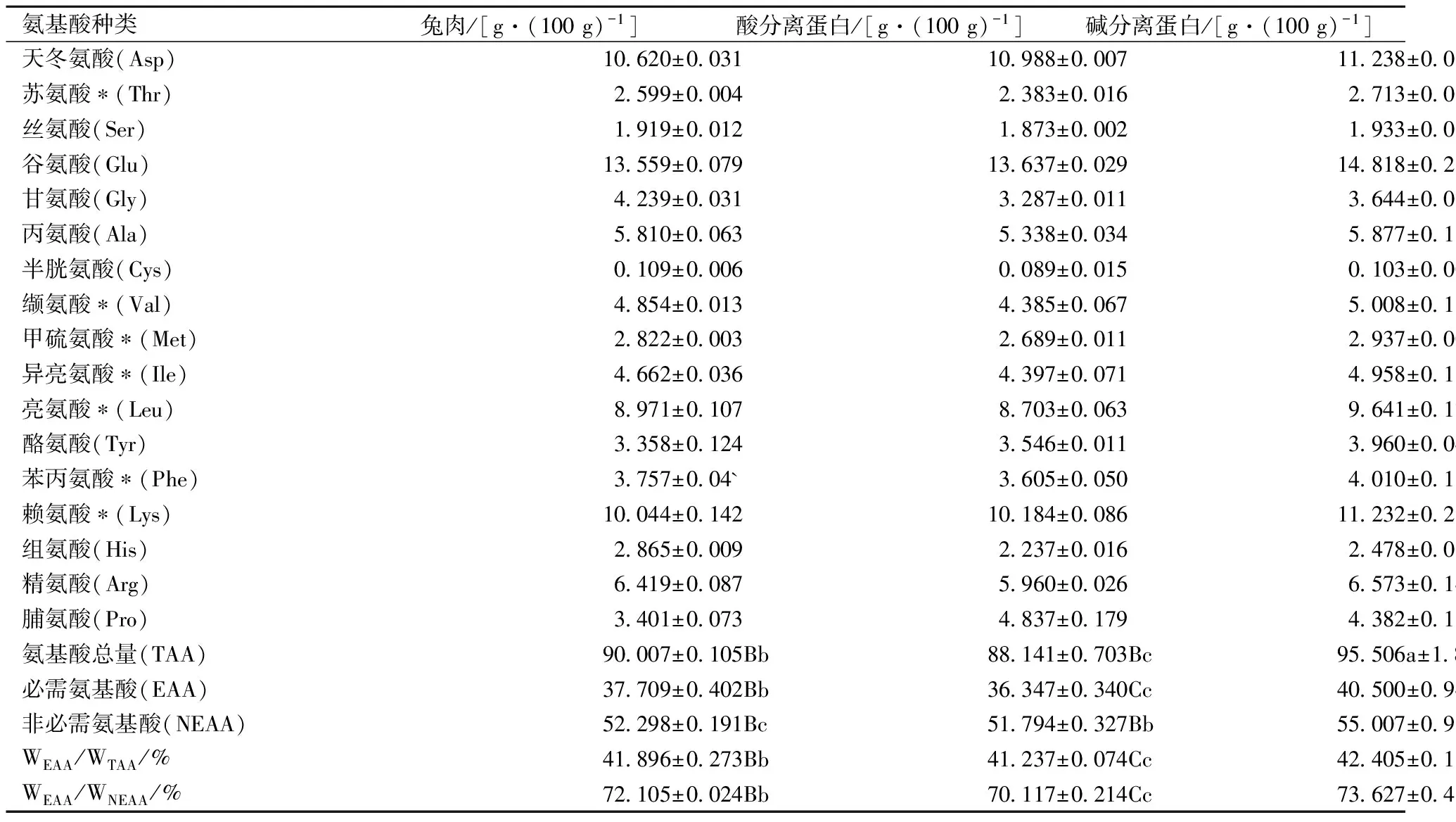
表2 兔肉及分離蛋白氨基酸組成(干基)
注:*表示必需氨基酸;同一行不同小寫字母表示結果之間具有顯著差異(P<0.05);不同大寫字母表示極顯著差異(P<0.01)。
3 結論
由實驗結果可知,pH調節法(pH-shifting)提取兔肉分離蛋白的最佳條件為酸溶解pH 3.0、堿溶解pH 12.0,蛋白沉淀回收pH 5.5。在最佳提取條件下,蛋白提取率分別為酸法46.46%、堿法68.55%,堿法的提取效果優于酸法。
pH調節法制得的分離蛋白蛋白含量(干基)分別為酸法76.65%、堿法87.73%,而脂肪含量(干基)只有1.51%和1.53%,蛋白含量極顯著(P<0.01)高于兔肉而脂肪含量極顯著(P<0.01)低于兔肉。制得的分離蛋白所含必需氨基酸比例均衡,WEAA/WTAA、WEAA/WNEAA均優于FAO/WHO理想模式。酸/堿法提取過程并未導致蛋白質嚴重降解,并且,堿提蛋白性質優于酸提蛋白。因此,pH調節法可以用于制備兔肉分離蛋白,此法制得的兔肉分離蛋白屬于優質蛋白資源,可進一步開發成蛋白產品或用于食品加工。
[1] DALLE Z A, SZENDRO Z. The role of rabbit meat as functional food.[J]. Meat Science, 2011, 88(3):319-31.
[2] MAROUNEK M, DOKOUPILOVA, VOLEK Z, et al. Quality of meat and selenium content in tissues of rabbits fed diets supplemented with sodium selenite, selenized yeast and selenized algae[J]. World Rabbit Science, 2009, 17(4):207-212.
[3] 樊金山. 兔肉加工現狀及其發展趨勢[J]. 畜牧與飼料科學, 2013, 34(9):77-78.
[4] 王曉君, 夏楊毅, 張丹,等. 不同脫腥方法對兔肉脫腥效果的比較[J]. 現代食品科技, 2016(5):205-212.
[5] HULTIN H O, KELLEHER S D. Process for isolating a protein composition from a muscle source and protein composition: EP, US,6288216B1[P].2001-09-11.
[6] 王瑛. pH值調節誘導羅非魚肌球蛋白結構和性質的變化[D]. 廣州:廣東海洋大學, 2013.
[7] 王偉. pH調節對鯉(Cyprinuscarpio)肌肉蛋白的結構與功能的影響[D]. 大連:大連海洋大學, 2015.
[8] KRISTINSSON H G, INGADOTTIR B. Recovery and properties of muscle proteins extracted from tilapia (oreochromis niloticus) light muscle by ph shift processing[J]. Journal of Food Science, 2006, 71(3):E132-E141.
[9] 孫月娥, 王衛東, 付湘晉. 酸堿法提取鰱魚肌肉蛋白的膠凝特性[J]. 食品科學, 2012,33(6):123-126.
[10] 洪偉, 孫成波, 周春霞,等. 酸堿法分離斑節對蝦蛋白的營養特性研究[J]. 現代食品科技, 2014(7):193-198.
[11] WANG He-nan, WU Jiang-ping, BETTI M. Chemical, rheological and surface morphologic characterisation of spent hen proteins extracted by pH-shift processing with or without the presence of cryoprotectants.[J]. Food Chemistry, 2013, 139(1-4):710-719.
[12] HRYNETS Y, OMANA D A, XU Y, et al. Comparative study on the effect of acid- and alkaline-aided extractions on mechanically separated turkey meat (MSTM): Chemical characteristics of recovered proteins[J]. Process Biochemistry, 2011, 46(1):335-343.
[13] JIANG Jiang, XIONG You-ling, CHEN Jie. pH shifting alters solubility characteristics and thermal stability of soy protein isolate and its globulin fractions in different pH, salt concentration, and temperature conditions[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 8 035-8 042.
[14] CHOMNAWANG C, YONGSAWATDIGUL J. Protein recovery of tilapia frame by-products by pH-shift method[J]. Journal of Aquatic Food Product Technology, 2012, 22(2):112-120.
[15] SUN L C, KANEKO K, OKAZAKI E, et al. Comparative study of proteins recovered from whole North Pacific krill Euphausia pacifica, by acidic and alkaline treatment during isoelectric solubilization/precipitation[J]. Fisheries Science, 2013, 79(3):537-546.
[16] JIN Guo-feng, ZHANG Jian-hao, YU Xiang, et al. Lipolysis and lipid oxidation in bacon during curing and drying-ripening[J]. Food Chemistry, 2010, 123(2):465-471.
[17] 劉詩長. 羅非魚分離蛋白的制備及其性質研究[D]. 廣州:廣東海洋大學, 2011.
[19] VARELTZIS P K, UNDELAND I. Protein isolation from blue mussels (Mytilusedulis) using an acid and alkaline solubilisation technique-process characteristics and functionality of the isolates.[J]. Journal of the Science of Food and Agriculture, 2012, 92(15):3 055-3 064.
[20] ABDOLLAHI M, MARMON S, CHAIJAN M, et al. Tuning the pH-shift protein-isolation method for maximum hemoglobin-removal from blood rich fish muscle.[J]. Food Chemistry, 2016, 212:213-224.
[21] 唐小丹. 羅非魚肉蛋白的分離及其性質研究[D].廣州:廣東海洋大學, 2011.
[22] CHOI Y M, KIM B C. Muscle fiber characteristics, myofibrillar protein isoforms, and meat quality[J]. Livestock Science, 2009, 122(2):105-118.
[23] 朱成科, 黃輝, 向梟,等. 泉水魚肌肉營養成分分析及營養學評價[J]. 食品科學, 2013, 34(11):246-249.
RabbitproteinisolatepreparationbypH-shiftinganditproperties
YU Yu-le1,HE Zhi-fei1,2,LI Hong-jun1,2*
1(College of Food Science, Southwest University, Chongqing 400716, China) 2(Chongqing Engineering Research Center of Regional Food, Chongqing 400716, China)
The protein isolate extracted from Ira rabbit meat by pH-shifting method was studied. The result showed that the optimum conditions for acid-soluble and alkali -soluble were pH 3.0 and pH 12.0. The optimum recovery condition was pH 5.5. The yield of rabbit protein isolate were 46.46% by acid method and 68.55% by alkali solution. The protein content (dry basis) of acid method and alkali method were both significantly higher than of rabbit meat, and fat content (dry basis) were both significantly lower than that of rabbit meat. Besides, a variety of essential amino acids of protein isolates were higher than FAO/WHO recommend value. SDS-PAGE pattern indicated no obvious protein degradation was found in the protein isolates extracted by pH-shifting method.
pH-shifting; rabbit protein isolate; protein properties
10.13995/j.cnki.11-1802/ts.013645
碩士研究生(李洪軍教授為通訊作者,E-mail:983362225@qq.com)。
國家自然科學基金項目(31671787);國家現代農業(兔)產業技術體系建設專項(CARS-44-D-1);農業部公益性行業(農業)科研專項(201303144);重慶市特色食品工程技術研究中心能力提升項目(cstc2014pt-gc8001)
2016-12-20,改回日期:2017-01-17

